
全程设计 第一节 化学反应速率
第一节 化学反应速率
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练

素养·目标定位 目标素养 1.知道化学反应速率的表示方法,了解测定化学反应速率的简 单方法。 2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应 速率的影响。 3.知道化学反应是有历程的,认识基元反应活化能对化学反应 速率的影响。 4.能进行化学反应速率的简单计算
导航 1.知道化学反应速率的表示方法,了解测定化学反应速率的简 单方法。 2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应 速率的影响。 3.知道化学反应是有历程的,认识基元反应活化能对化学反应 速率的影响。 4.能进行化学反应速率的简单计算。 素养·目标定位 目 标 素 养
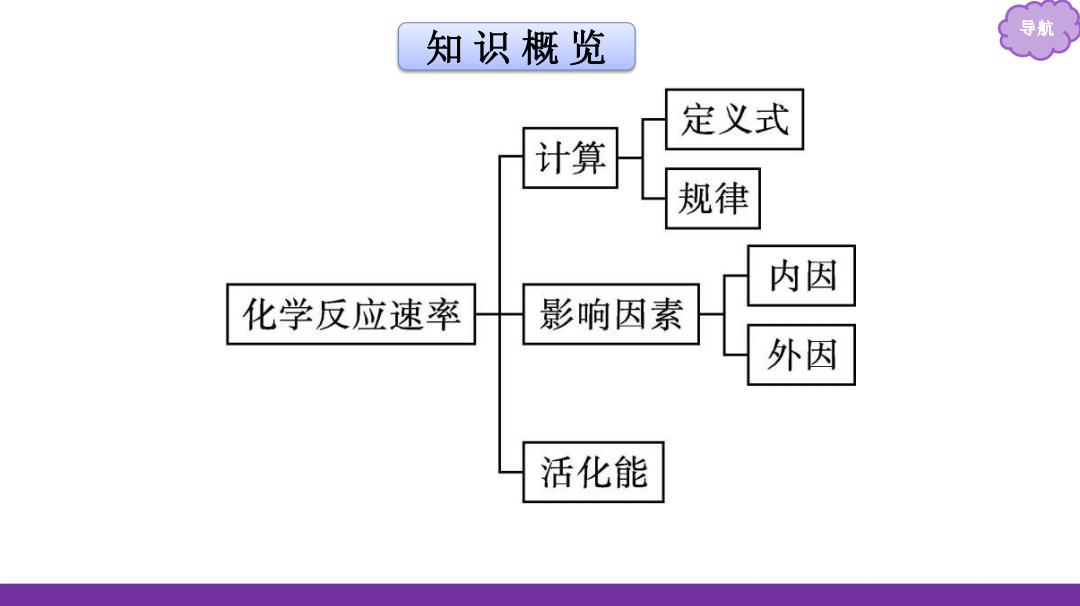
知识概览 导航 定义式 计算 规律 内因 化学反应速率 影响因素 外因 活化能
导航 知 识 概 览

导航 课前·基础认知 自主预习 一、化学反应速率 1.含义:定量描述化学反应 的物理量。 2.表示方法:如果反应体系的体积是恒定的,化学反应速率通 常用单位时间内反应物浓度的 或生成物浓度的 来表示。 3表达式:=
导航 一、化学反应速率 1.含义:定量描述化学反应 快慢程度 的物理量。 2.表示方法:如果反应体系的体积是恒定的,化学反应速率通 常用单位时间内反应物浓度的 减小 或生成物浓度的 增 大 来表示。 3.表达式:v= 𝚫𝒄 𝚫𝒕 。 自 主 预 习 课前·基础认知

导期 4.单位:常用 或 等来表示。 5.对于一个化学反应:mA+nB一pC+qD。 ()用不同物质表示的反应速率分别为 V(A)-Ac(A) (B)2,D)a △t (2)化学反应中各物质的化学反应速率之比等于化学计量数 之比。即v(A):(B):(C):D)=
导航 4.单位:常用 mol/(L·s) 或 mol·L-1·s-1 等来表示。 5.对于一个化学反应:mA+nB══pC+qD。 (1)用不同物质表示的反应速率分别为 v(A)=- 𝚫𝒄(𝐀) 𝚫𝒕 ,v(B)=- 𝚫𝒄(𝐁) 𝚫𝒕 ,v(C)=𝚫𝒄(𝐂) 𝚫𝒕 ,v(D)=𝚫𝒄(𝐃) 𝚫𝒕 。 (2)化学反应中各物质的化学反应速率之比等于化学计量数 之比。即v(A)∶v(B)∶v(C)∶v(D)= m∶n∶p∶q

微思考1探讨有哪些方法可以测定锌与稀硫酸反应的化学 反应速率。 提示:)可以通过测量收集一定体积H,所用时间的长短来 测定化学反应的反应速率;2)可以通过测量相同时间内收集 H,的多少来测定化学反应的反应速率;3)可以通过测量一段 时间内溶液中cH+)的变化来测定化学反应的反应速率
导航 微思考1探讨有哪些方法可以测定锌与稀硫酸反应的化学 反应速率。 提示:(1)可以通过测量收集一定体积H2所用时间的长短来 测定化学反应的反应速率;(2)可以通过测量相同时间内收集 H2的多少来测定化学反应的反应速率;(3)可以通过测量一段 时间内溶液中c(H+ )的变化来测定化学反应的反应速率

特别提醒(1)化学反应速率,是某一时间段的平均速率而不 是瞬时速率 。 (2)不论是反应物还是生成物,其化学反应速率值都取正值。 (3)固体或液体纯物质(不是溶液)的物质的量浓度可视为不 变的常数,因此,一般不用固体或液体纯物质表示化学反应速 率
导航 特别提醒 (1)化学反应速率,是某一时间段的平均速率而不 是瞬时速率。 (2)不论是反应物还是生成物,其化学反应速率值都取正值。 (3)固体或液体纯物质(不是溶液)的物质的量浓度可视为不 变的常数,因此,一般不用固体或液体纯物质表示化学反应速 率

二、影响化学反应速率的因素 导期 1.主要因素: 反应物的 和 等因素。 2.其他因素: 等因素对化学反应速率有 影响。 在一般情况下,当其他条件相同时,改变化学反应速率的方 法如下。 (1)增大反应物的浓度,化学反应速率 ;降低反应物 的浓度,化学反应速率
二、影响化学反应速率的因素 导航 1.主要因素: 反应物的 组成 、 结构 和 性质 等因素。 2.其他因素: 浓度、压强、温度及催化剂 等因素对化学反应速率有 影响。 在一般情况下,当其他条件相同时,改变化学反应速率的方 法如下。 (1)增大反应物的浓度,化学反应速率 增大 ;降低反应物 的浓度,化学反应速率 减小

(2)升高温度,化学反应速率 ;降低温度,化学反应速航 率 。大量实验证明,温度每升高10℃,化学反应速率 通常增大为原来的 倍,可见温度对化学反应速率的影 响非常 3)催化剂可以 化学反应速率。 (4)对于有气体参加的化学反应,改变压强(改变容器的容积) 同样可以改变化学反应速率 (⑤)通过 放射线辐照、超声波、电弧、强磁场、 等。只要向反应体系中输入 ,都有可能 改变化学反应速率
导航 (2)升高温度,化学反应速率 增大 ;降低温度,化学反应速 率 减小 。大量实验证明,温度每升高10 ℃,化学反应速率 通常增大为原来的 2~4 倍,可见温度对化学反应速率的影 响非常 显著 。 (3)催化剂可以 改变 化学反应速率。 (4)对于有气体参加的化学反应,改变压强(改变容器的容积) 同样可以改变化学反应速率。 (5)通过 光辐照 、放射线辐照、超声波、电弧、强磁场、 高速研磨 等。只要向反应体系中输入 能量 ,都有可能 改变化学反应速率