
全程设计 第1课时 水的电离 溶液的酸碱性与pH
第1课时 水的电离 溶液的酸碱性与pH
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练

导航 第1课时 水的电离 溶液的酸碱性与pH
导航 第1课时 水的电离 溶液的酸碱性与pH

导航 素养·目标定位 目标素养 1.了解水的电离平衡及其影响因素。 2.了解水的离子积常数并能运用其进行简单计算。 3.认识溶液的酸碱性及pH。能进行溶液pH的简单计算,能正 确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液 pH的调控在工农业生产和科学研究中的重要作用。 4.掌握酸碱中和滴定的原理、操作方法和滴定误差分析
导航 1.了解水的电离平衡及其影响因素。 2.了解水的离子积常数并能运用其进行简单计算。 3.认识溶液的酸碱性及pH。能进行溶液pH的简单计算,能正 确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液 pH的调控在工农业生产和科学研究中的重要作用。 4.掌握酸碱中和滴定的原理、操作方法和滴定误差分析。 素养·目标定位 目 标 素 养
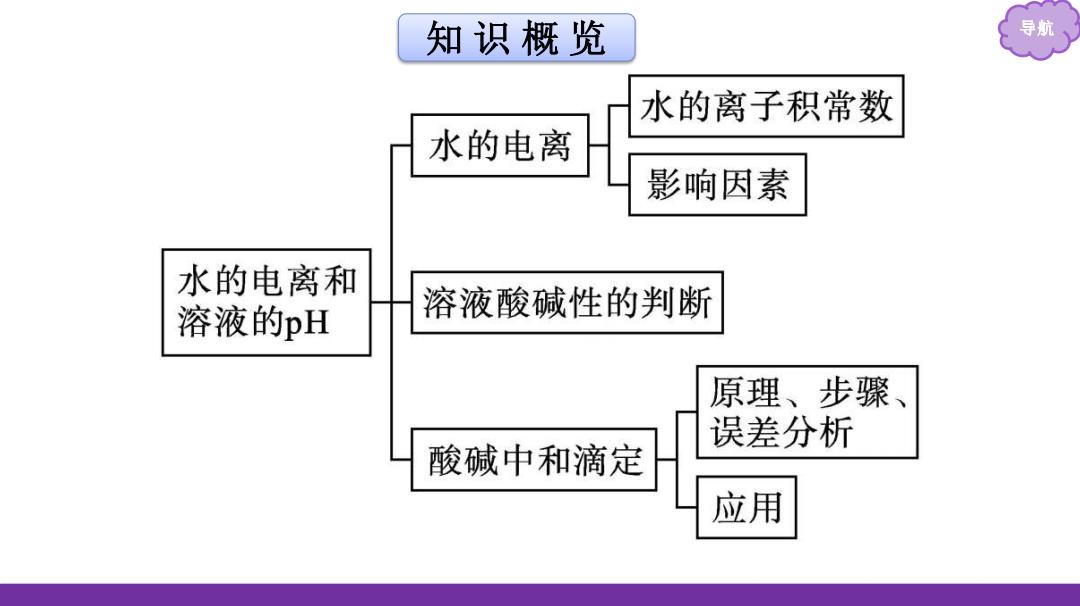
知识概览 导航 水的离子积常数 水的电离 影响因素 水的电离和 溶液的pH 溶液酸碱性的判断 原理、步骤、 误差分析 酸碱中和滴定 应用
知 识 概 览 导航

导航 课前·基础认知 自主预习 一、水的电离 1.电离方程式为 ,简写为 “难”—极难电离 “逆”—可逆过程 2.四个特点: “等”一电离出的H+与0H浓度相等 “吸”—吸热过程
导航 一、水的电离 1.电离方程式为 H2O+H2O H3O+ +OH- ,简写为 H 2 O H + +OH- 。 2.四个特点: “难”——极难电离 “逆”——可逆过程 “等”——电离出的 𝐇 + 与 𝐎 𝐇- 浓度相等 “吸”——吸热过程 自 主 预 习 课前 ·基础认知

3.水的离子积常数。 (1)含义:当水的电离达到平衡时,电离产物H+和OⅢ浓度之 积是一个常数,称为水的离子积常数,简称水的离子积,用Kw 表示。 (2)表达式:Kw= (3)影响因素:Ky只受温度影响,由于水的电离是 过 程,温度升高,Kw 。 在常温下,一般可以认为Kw= (4)适用范围:Ky适用于纯水及稀的电解质水溶液
导航 3.水的离子积常数。 (1)含义:当水的电离达到平衡时,电离产物H+和OH-浓度之 积是一个常数,称为水的离子积常数,简称水的离子积,用KW 表示。 (2)表达式:KW = c(H+ )·c(OH- ) 。 (3)影响因素:KW只受温度影响,由于水的电离是 吸热 过 程,温度升高,KW 增大 。在常温下,一般可以认为KW = 1×10-14 。 (4)适用范围:KW适用于纯水及稀的电解质水溶液

导 微思考1常温下向纯水中通入少量HC或加入少量固体 NaOH或加入少量固体NaC所得的溶液中,水的离子积常数 Kw有变化吗? 提示:不变。Kw是纯水或水溶液中cH)和c(OH)的乘积,Kw 大小只与温度有关,常温下为1×1014,故在常温下向纯水中加 入这些溶质所得的溶液中Ky不变
导航 微思考1常温下向纯水中通入少量HCl或加入少量固体 NaOH或加入少量固体NaCl所得的溶液中,水的离子积常数 KW有变化吗? 提示:不变。KW是纯水或水溶液中c(H+ )和c(OH- )的乘积,KW 大小只与温度有关,常温下为1×10-14 ,故在常温下向纯水中加 入这些溶质所得的溶液中KW不变

二、溶液的酸碱性与pH 1.溶液酸碱性的判断标准是cH)与c(OH)的相对大小。常 温下, 中性溶液:cH)c(OH)= mol-L-1; 酸性溶液:cH) c(0H),cH)1.0X10-7moL1, 且c(H)越大,酸性越 碱性溶液:cH)】 c(OH),cH)1.0×10-7moL1, 且c(OH)越大,碱性越
导航 二、溶液的酸碱性与pH 1.溶液酸碱性的判断标准是c(H+ )与c(OH- )的相对大小。常 温下, 中性溶液:c(H+ ) = c(OH- )= 1.0×10-7 mol·L-1 ; 酸性溶液:c(H+ ) > c(OH- ),c(H+ ) > 1.0×10-7 mol·L-1 , 且c(H+ )越大,酸性越 强 ; 碱性溶液:c(H+ ) < c(OH- ),c(H+ ) < 1.0×10-7 mol·L-1 , 且c(OH- )越大,碱性越 强

导航 2.溶液酸碱性的表示方法。 (1)当c(H)或c(O)大于或等于1moL1时,通常用 直接表示。 (2)当cH+)或c(OH)小于1moL1时,通常用 表示
导航 2.溶液酸碱性的表示方法。 (1)当c(H+ )或c(OH- )大于或等于1 mol·L-1时,通常用 c(H+ ) 或c(OH- ) 直接表示。 (2)当c(H+ )或c(OH- )小于1 mol·L-1时,通常用 pH 表示