
第一章物质及其变化 第一节物质的分类及转化 素养·目标定位 目标素养 知识概览 1,认识元素可以组成不同类别的物质,了解元素与物质的关系。 常见分类法 2.根据物质的组成和性质可以对物质进行分类,了解物质的常见类别。 物质的 3.能利用分类思想进行学习,了解物质分类的常用方法。 分类 根据物质的组成和性质分类 4.能从微观粒子角度对分散系进行分类,并能认识胶体的性质,知道 物质的分 分散系及其分类 胶体是一种重要的分散系。 类及转化 酸、碱、盐的性质 5.通过对酸、碱、盐的性质的学习,了解同类物质具有相似的性质,不 物质的 转化 同类的物质之间可以互相转化。 从分类角度认识物质的转化 第1课时 物质的分类 课前·基础认知 1.根据物质的组成和性质分类。 方法。根据交叉分类法用连线的方式对下列物质进行分类: (1)元素和物质的关系。 答案 ①物质都是由元素组成的,根据元素组成对物质进行 钠盐 分类是化学研究的基础。 根据 可溶 阳离 ②元素可形成单质和化合物。 根据 性盐 Na2SO. 钡盐 子分类 单质是由同种元素形成的纯净物,有的单质有多种形 溶解 性分类 态,如金刚石、石墨和C0都属于碳单质。像这样,由 难溶 BaCO 碳酸盐 根据酸 同一种元素形成的几种性质不同的单质,叫做这种元素的 性盐 根离子 BaSO 硫酸盐 分类 同素异形体。 化合物是由不同的元素形成的纯净物,不同的元素在 (4)氧化物的分类。 形成化合物时,可以按照一定的规律,以不同的方式进行 氧化物是指由两种元素组成,且其中有一种为氧元素 的化合物。根据氧化物的组成元素,可以将氧化物分为金 组合。 (2)利用树状分类法对物质进行分类。 属氧化物和非金属氧化物:根据氧化物能否与酸或碱反 树状分类法是根据物质的组成对物质进行分类的一种 应的性质,可以将氧化物分为碱性氧化物、酸性氧化物 方法,如图: 等。请填写下表: 物质 氧化物 酸性氧化物 碱性氧化物 按是否由同种物质组成分 能与碱反应生成盐和能与酸反应生成盐和水 定义 混合物 纯净物 水的氧化物 的氧化物 按组成物质的元素种类分 CO2、SO3等 CaO、FezO3等 单质 化合物 实例 CO2十2NaOH Fe,O,+6HCI= Na2CO+H2O 2FeCla+3H2O 金属单质 非金属单质 稀有气体 无机化 有机化 合物 合物 属类 大多数非金属氧化物 大多数金属氧化物 按化合物的性质分 微判断D(I)臭氧变成氧气是物理变化。( 氧化物酸 盐 (2)Ca(OH)2既属于碱又属于纯净物。 ( (3)利用交叉分类法对物质进行分类。 (3)胆矾(CuSO,·5H2O)是混合物。 () 交叉分类法是从不同的角度对物质进行分类的一种 (4)HNO3既属于一元酸又属于含氧酸,这种分类方法
第一章 物质及其变化 第一节 物质的分类及转化 素养·目标定位 目 标 素 养 知 识 概 览 1.认识元素可以组成不同类别的物质,了解元素与物质的关系。 2.根据物质的组成和性质可以对物质进行分类,了解物质的常见类别。 3.能利用分类思想进行学习,了解物质分类的常用方法。 4.能从微观粒子角度对分散系进行分类,并能认识胶体的性质,知道 胶体是一种重要的分散系。 5.通过对酸、碱、盐的性质的学习,了解同类物质具有相似的性质,不 同类的物质之间可以互相转化。 第1课时 物质的分类 课前·基础认知 1.根据物质的组成和性质分类。 (1)元素和物质的关系。 ①物质都是由 元素 组成的,根据元素组成对物质进行 分类是化学研究的基础。 ②元素可形成单质和化合物。 单质是由 同种 元素形成的纯净物,有的单质有多种形 态,如 金刚石 、石墨 和 C60 都属于碳单质。像这样,由 同一种元素形成的几种性质不同的单质,叫做这种元素的 同素异形体 。 化合物是由 不同 的元素形成的纯净物,不同的元素在 形成化合物时,可以按照一定的规律,以不同的方式进行 组合。 (2)利用树状分类法对物质进行分类。 树状分类法是根据物质的组成对物质进行分类的一种 方法,如图: (3)利用交叉分类法对物质进行分类。 交叉分类法是 从不同的角度 对物质进行分类的一种 方法。根据交叉分类法用连线的方式对下列物质进行分类: 答案 (4)氧化物的分类。 氧化物是指由 两 种元素组成,且其中有一种为氧元素 的化合物。根据氧化物的组成元素,可以将氧化物分为 金 属 氧化物和 非金属 氧化物;根据氧化物能否与酸或碱反 应的性质,可以将氧化物分为 碱 性氧化物、酸 性氧化物 等。请填写下表: 氧化物 酸性氧化物 碱性氧化物 定义 能与 碱反应生成盐和 水 的氧化物 能与 酸反应生成盐和水 的氧化物 实例 CO2 、SO3 等 CaO 、Fe2O3 等 CO2+2NaOH Na2CO3+H2O Fe2O3+6HCl 2FeCl3+3H2O 属类 大多数非金属氧化物 大多数金属氧化物 微判断 1 (1)臭氧变成氧气是物理变化。 ( ) (2)Ca(OH)2 既属于碱又属于纯净物。 ( ) (3)胆矾(CuSO4·5H2O)是混合物。 ( ) (4)HNO3 既属于一元酸又属于含氧酸,这种分类方法 1

化学 必修 第一册 配人教版 是树状分类法。 ②胶体的制备和性质 (5)所有非金属氧化物都是酸性氧化物。 填写下表: (6)混合物肯定由两种以上元素组成。 实验操作 实验现象 (7)含有氧元素的化合物都是氧化物。 答案(1)×(2)√(3)×(4)×(5)× (6)X 1.取两个100mL小烧杯,分别加入CuSO4溶液为蓝 (7)× 40mL蒸馏水和40mL.CuSO,色。 2.分散系及其分类。 溶液。 加入FeCla饱和溶 (1)分散系及其分类。 将烧杯中的蒸馏水加热至沸腾,向沸液,继续煮沸,烧杯内 ①分散系。 水中逐滴加人5~6滴FC饱和溶液体逐渐变为红褐 把一种(或多种)物质以粒子形式 定义分散到另一种(或多种)物质中 液,继续煮沸 E 所形成的混合物 分散系 分散系中被分散成粒子的物质 组成 分散质 2.把两个烧杯置于暗处,分别用红色光束通过氢氧化铁胶 →分散剂 激光笔照射烧杯中的液体,在与光束体时,可以看到一条 举例:如溶液中, 垂直的方向进行观察 光亮的“通路” 溶液 →溶质+溶剂 属于 属于 实验结论及解释: 在沸水中滴加氯化铁饱和溶液,继续煮沸所得到的红褐 分散系+ +分散质+分散剂 色液体为氢氧化铁胶体。 ②分散系的分类。 光线通过胶体时,由于胶体粒子对光线的散射而形成了 (溶液) (胶体),(悬浊液或乳浊液】 条光亮的“通路”,这个现象叫做丁达尔效应。 ·微判断2(1)溶液、胶体和悬浊液的本质区别是分 0 1 nm 100nm 分散质 粒子直径 散质粒子的直径大小。 () (2)胶体。 (2)氯化铁溶液的分散质是固体小颗粒。 () ①分类。 (3)云、雾的分散质是小液滴,故它们都是液溶胶。 胶体 分散剂 实例 (4)向氢氧化钠溶液中边滴加饱和FCL,溶液边振荡制 液溶胶 液体 Fe(OH)3胶体 备Fe(OH)3胶体。 () (5)放映机到银幕间光柱的形成是因为丁达尔效应。 气溶胶 气体 云、雾 () (6)直径为1~100nm的粒子称为胶体。 () 固溶胶 固体 有色玻璃 答案(1)/(2)×(3)×(4)×(5)/(6)× 课堂 重难突破 分类法及物质的分类 2.常用的两种分类方法。 (1)树状分类法:对不同物质按照一定标准进行分类,并 重难归纳 对分类结果再分类,形成具有一定从属关系的一种分类方 法。所得物质类别间存在从属关系,如盐属于化合物,而化 1.对分类的理解及认识。 合物又属于纯净物等。 分类是根据研究对象的共同点和差异点,将它们区分为 (2)交叉分类法:按照不同的标准,从不同的角度对同一 不同种类和层次的科学方法。科学的分类能够反映事物的 物质进行分类的一种分类方法。所得类别之间存在交叉关 本质特征,有利于人们分门别类地进行深入研究。 系,如Na2SO,、K,SO分别属于钠盐、钾盐,但它们又都属 分类都是有一定的标准的,根据不同的标准,对物质进 于硫酸盐。 行分类可以得到不同的结果。 常见的物质分类标准: 7思考发现 (1)根据物质的组成(纯净物和混合物): I.在某食品的包装袋内有一个上面写着“生石灰干燥 (2)根据物质的导电性(导体、半导体和绝缘体): 剂”的小纸袋,内装白色颗粒状固体A,裸露在空气中过一段 (3)根据物质在水中的溶解性(易溶、可溶、微溶、难溶): 时间后纸袋内的白色颗粒黏在一起,成为块状固体B。 (4)根据物质的存在状态(气体、液体、固体等)。 Ⅱ.《天工开物》中的《蟠石》篇载有:“百里内外,土中必
化 学 必修 第一册 配人教版 是树状分类法。 ( ) (5)所有非金属氧化物都是酸性氧化物。 ( ) (6)混合物肯定由两种以上元素组成。 ( ) (7)含有氧元素的化合物都是氧化物。 ( ) 答案 (1)× (2)√ (3)× (4)× (5)× (6)× (7)× 2.分散系及其分类。 (1)分散系及其分类。 ①分散系。 分散系— 定义 → 把一种(或多种)物质以粒子形式 分散到另一种(或多种)物质中 所形成的混合物 组成 分散系中 被分散成粒子 的物质 →分散质 →分散剂 举例:如溶液中, ②分散系的分类。 (2)胶体。 ①分类。 胶体 分散剂 实例 液溶胶 液体 Fe(OH)3 胶体 气溶胶 气体 云、雾 固溶胶 固体 有色玻璃 ②胶体的制备和性质。 填写下表: 实验操作 实验现象 1.取两个100mL小烧杯,分别加入 40 mL 蒸 馏 水 和 40 mL CuSO4 溶液。 将烧杯中的蒸馏水加热至沸腾,向沸 水中逐滴加入5~6滴FeCl3 饱和溶 液,继续煮沸 CuSO4 溶液 为 蓝 色。 加 入 FeCl3 饱 和 溶 液,继续煮沸,烧杯内 液体逐渐变为 红褐 色 2.把两个烧杯置于暗处,分别用红色 激光笔照射烧杯中的液体,在与光束 垂直的方向进行观察 光束通过氢氧化铁胶 体时,可以看到 一条 光亮的“通路” 实验结论及解释: 在沸水中滴加氯化铁饱和溶液,继续煮沸所得到的红褐 色液体为氢氧化铁胶体。 光线通过胶体时,由于胶体粒子对光线的散射而形成了 一条光亮的“通路”,这个现象叫做 丁达尔效应 。 微判断 2 (1)溶液、胶体和悬浊液的本质区别是分 散质粒子的直径大小。 ( ) (2)氯化铁溶液的分散质是固体小颗粒。 ( ) (3)云、雾的分散质是小液滴,故它们都是液溶胶。 ( ) (4)向氢氧化钠溶液中边滴加饱和FeCl3 溶液边振荡制 备Fe(OH)3 胶体。 ( ) (5)放映机到银幕间光柱的形成是因为丁达尔效应。 ( ) (6)直径为1~100nm的粒子称为胶体。 ( ) 答案 (1)√ (2)× (3)× (4)× (5)√ (6)× 课堂·重难突破 一 分类法及物质的分类 重难归纳 1.对分类的理解及认识。 分类是根据研究对象的共同点和差异点,将它们区分为 不同种类和层次的科学方法。科学的分类能够反映事物的 本质特征,有利于人们分门别类地进行深入研究。 分类都是有一定的标准的,根据不同的标准,对物质进 行分类可以得到不同的结果。 常见的物质分类标准: (1)根据物质的组成(纯净物和混合物); (2)根据物质的导电性(导体、半导体和绝缘体); (3)根据物质在水中的溶解性(易溶、可溶、微溶、难溶); (4)根据物质的存在状态(气体、液体、固体等)。 2.常用的两种分类方法。 (1)树状分类法:对不同物质按照一定标准进行分类,并 对分类结果再分类,形成具有一定从属关系的一种分类方 法。所得物质类别间存在从属关系,如盐属于化合物,而化 合物又属于纯净物等。 (2)交叉分类法:按照不同的标准,从不同的角度对同一 物质进行分类的一种分类方法。所得类别之间存在交叉关 系,如 Na2SO4、K2SO4 分别属于钠盐、钾盐,但它们又都属 于硫酸盐。 Ⅰ.在某食品的包装袋内有一个上面写着“生石灰干燥 剂”的小纸袋,内装白色颗粒状固体 A,裸露在空气中过一段 时间后纸袋内的白色颗粒黏在一起,成为块状固体B。 Ⅱ.《天工开物》中的《燔石》篇载有:“百里内外,土中必 2
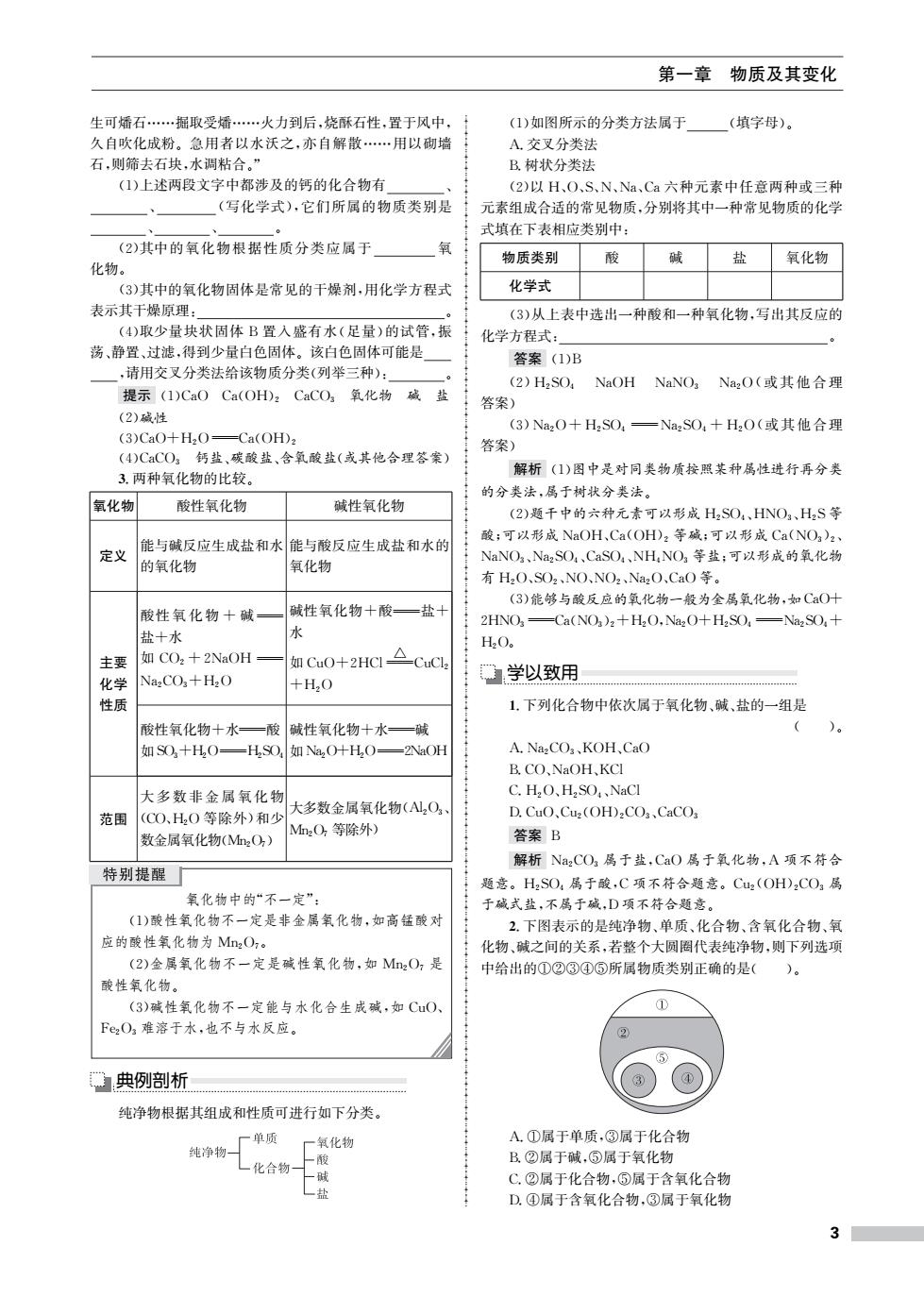
第一章 物质及其变化 生可蟠石…掘取受燔…火力到后,烧酥石性,置于风中, (1)如图所示的分类方法属于 (填字母)。 久自吹化成粉。急用者以水沃之,亦自解散…用以砌墙 A.交叉分类法 石,则筛去石块,水调粘合。” B.树状分类法 (1)上述两段文字中都涉及的钙的化合物有 (2)以H、O、S、N、Na、Ca六种元素中任意两种或三种 (写化学式),它们所属的物质类别是 元素组成合适的常见物质,分别将其中一种常见物质的化学 式填在下表相应类别中: (2)其中的氧化物根据性质分类应属于 氧 物质类别 酸 碱 盐 氧化物 化物。 (3)其中的氧化物固体是常见的干燥剂,用化学方程式 化学式 表示其干燥原理: (3)从上表中选出一种酸和一种氧化物,写出其反应的 (4)取少量块状固体B置入盛有水(足量)的试管,振 化学方程式: 荡、静置、过滤,得到少量白色固体。该白色固体可能是 答案(1)B ,请用交叉分类法给该物质分类(列举三种): (2)H,SO, NaOH NaNO Na2O(或其他合理 提示(1)CaO Ca(OH)2CaCO,氧化物碱盐 答案) (2)碱性 (3)Na2O+HzSO,一Na2SO,+H2O(或其他合理 (3)CaO+H,O=Ca(OH) 答案) (4)CCO。钙盐、碳酸盐、含氧酸盐(或其他合理答案) 3.两种氧化物的比较。 解析(1)图中是对同类物质按照某种属性进行再分类 的分类法,属于树状分类法。 氧化物 酸性氧化物 碱性氧化物 (2)题千中的六种元素可以形成H2SO,、HNO3、H2S等 酸;可以形成NaOH,Ca(OH)2等碱;可以形成Ca(NO3)2 能与碱反应生成盐和水能与酸反应生成盐和水的 定义 NaNO2、Na2SO4、CaSO4、NHNO3等盐;可以形成的氧化物 的氧化物 氧化物 有H2O、SO2、NO、NO2、Na2O、CaO等。 (3)能够与酸反应的氧化物一般为金属氧化物,如CaO十 酸性氧化物十碱 碱性氧化物+酸一盐十 2HNO-Ca(NO3)2+H2O,NazO+H2SO,-NazSO+ 盐+水 水 H2O。 主要 如CO2十2NaOH 如Cu0+2HCl△CC 化学 NazCO+H2O +H,O 学以致用 性质 1.下列化合物中依次属于氧化物、碱、盐的一组是 酸性氧化物十水一酸 碱性氧化物十水—碱 )。 如SO,十H,O一H,S0,如Na,O+H,O =2NaOH A.NazCO3、KOH、CaO B.CO、NaOH、KCI 大多数非金属氧化物 C.H,O、H,SO,、NaCI 大多数金属氧化物(A12O3 范围 (CO、H2O等除外)和少 D.CuO、Cu2(OH)2COs、CaCO3 M2O2等除外) 数金属氧化物(2O) 答案B 解析Na2CO3属于盐,CaO属于氧化物,A项不符合 特别提醒 题意。H2SO4属于酸,C项不符合题意。Cu2(OH)2CO3属 氧化物中的“不一定”: 于碱式盐,不属于碱,D项不符合题意。 (1)酸性氧化物不一定是非金属氧化物,如高锰酸对 2.下图表示的是纯净物、单质、化合物、含氧化合物、氧 应的酸性氧化物为Mn2O,。 化物、碱之间的关系,若整个大圆圈代表纯净物,则下列选项 (2)金属氧化物不一定是碱性氧化物,如M2O,是 中给出的①②③④⑤所属物质类别正确的是( 酸性氧化物。 (3)碱性氧化物不一定能与水化合生成碱,如CuO、 Fe2O2难溶于水,也不与水反应。 典例剖析 纯净物根据其组成和性质可进行如下分类。 单质 一氧化物 A.①属于单质,③属于化合物 纯净物 一酸 B.②属于碱,⑤属于氧化物 化合物 一碱 C.②属于化合物,⑤属于含氧化合物 一盐 D.④属于含氧化合物,③属于氧化物 3
第一章 物质及其变化 生可燔石……掘取受燔……火力到后,烧酥石性,置于风中, 久自吹化成粉。急用者以水沃之,亦自解散……用以砌墙 石,则筛去石块,水调粘合。” (1)上述两段文字中都涉及的钙的化合物有 、 、 (写化学式),它们所属的物质类别是 、 、 。 (2)其中的氧化物根据性质分类应属于 氧 化物。 (3)其中的氧化物固体是常见的干燥剂,用化学方程式 表示其干燥原理: 。 (4)取少量块状固体 B置入盛有水(足量)的试管,振 荡、静置、过滤,得到少量白色固体。该白色固体可能是 ,请用交叉分类法给该物质分类(列举三种): 。 提示 (1)CaO Ca(OH)2 CaCO3 氧化物 碱 盐 (2)碱性 (3)CaO+H2OCa(OH)2 (4)CaCO3 钙盐、碳酸盐、含氧酸盐(或其他合理答案) 3.两种氧化物的比较。 氧化物 酸性氧化物 碱性氧化物 定义 能与碱反应生成盐和水 的氧化物 能与酸反应生成盐和水的 氧化物 主要 化学 性质 酸性 氧 化 物 + 碱 盐+水 如 CO2 +2NaOH Na2CO3+H2O 碱性氧化物+酸盐+ 水 如CuO+2HCl △ CuCl2 +H2O 酸性氧化物+水酸 如SO3+H2OH2SO4 碱性氧化物+水碱 如Na2O+H2O2NaOH 范围 大 多 数 非 金 属 氧 化 物 (CO、H2O等除外)和少 数金属氧化物(Mn2O7) 大多数金属氧化物(Al2O3、 Mn2O7 等除外) 氧化物中的“不一定”: (1)酸性氧化物不一定是非金属氧化物,如高锰酸对 应的酸性氧化物为 Mn2O7。 (2)金属氧化物不一定是碱性氧化物,如 Mn2O7 是 酸性氧化物。 (3)碱性氧化物不一定能与水化合生成碱,如 CuO、 Fe2O3 难溶于水,也不与水反应。 典例剖析 纯净物根据其组成和性质可进行如下分类。 (1)如图所示的分类方法属于 (填字母)。 A.交叉分类法 B.树状分类法 (2)以 H、O、S、N、Na、Ca六种元素中任意两种或三种 元素组成合适的常见物质,分别将其中一种常见物质的化学 式填在下表相应类别中: 物质类别 酸 碱 盐 氧化物 化学式 (3)从上表中选出一种酸和一种氧化物,写出其反应的 化学方程式: 。 答案 (1)B (2)H2SO4 NaOH NaNO3 Na2O(或 其 他 合 理 答案) (3)Na2O+H2SO4 Na2SO4 +H2O(或其他合理 答案) 解析 (1)图中是对同类物质按照某种属性进行再分类 的分类法,属于树状分类法。 (2)题干中的六种元素可以形成 H2SO4、HNO3、H2S等 酸;可以形成 NaOH、Ca(OH)2 等碱;可以形成Ca(NO3)2、 NaNO3、Na2SO4、CaSO4、NH4NO3 等盐;可以形成的氧化物 有 H2O、SO2、NO、NO2、Na2O、CaO等。 (3)能够与酸反应的氧化物一般为金属氧化物,如CaO+ 2HNO3 Ca(NO3)2+H2O,Na2O+H2SO4 Na2SO4+ H2O。 学以致用 1.下列化合物中依次属于氧化物、碱、盐的一组是 ( )。 A.Na2CO3、KOH、CaO B.CO、NaOH、KCl C.H2O、H2SO4、NaCl D.CuO、Cu2(OH)2CO3、CaCO3 答案 B 解析 Na2CO3 属于盐,CaO 属于氧化物,A 项不符合 题意。H2SO4 属于酸,C项不符合题意。Cu2(OH)2CO3 属 于碱式盐,不属于碱,D项不符合题意。 2.下图表示的是纯净物、单质、化合物、含氧化合物、氧 化物、碱之间的关系,若整个大圆圈代表纯净物,则下列选项 中给出的①②③④⑤所属物质类别正确的是( )。 A.①属于单质,③属于化合物 B.②属于碱,⑤属于氧化物 C.②属于化合物,⑤属于含氧化合物 D.④属于含氧化合物,③属于氧化物 3

化学 必修 第一册 配人教版 答案C 典例剖析 解析因大圆图表示纯净物,由题图关系可知,②属于 化合物,①属于单质。氧化物和碱均含氧元素,所以⑤属于 (双选)纳米材料是当今材料科学研究的前沿,其研究成 含氧化合物,C项正确。 果广泛应用于催化及军事科学中。纳米材料是指在三维空 间中至少有一维处于纳米尺寸(1~100nm)或由它们作为 二分散系及其分类 基本单元构成的材料。若将直径为50~70nm的纳米碳分 散到蒸馏水中形成分散系,下列有关该分散系的说法正确的 重难归纳 是()。 溶液、胶体、乳浊液或悬浊液三类分散系的比较: A.与溶液的本质区别是分散质粒子的直径大小不同 B.因为纳米碳粒子对光线的散射而有丁达尔效应 比较项目 溶液 胶体 乳浊液或悬浊液 C.所得的液体呈胶状 D.所得的分散系一定是悬浊液 分散质粒 答案AB 100nm 子的直径 解析将直径为50~70nm的纳米碳分散到蒸馏水中, 所得的分散系属于胶体:胶体均一,不呈胶状:胶体与溶液的 许多分子的大量分子聚集在 本质区别是分散质粒子的直径大小不同,A项正确,C、D项 分散质 小分子或离 集合体或大起形成的小液滴或 错误。胶体具有丁达尔效应,B项正确。 粒子 分子 固体小颗粒 特别提醒 胶体和其他分散系的本质区别是分散质粒 外观 均一、透明 均一 不均一、不透明 子的直径大小不同,区分胶体和溶液的方法有: 稳定性 稳定 较稳定 不稳定 (1)根据分散质粒子的直径大小来区分。 无丁达尔效有丁达尔效 分散质粒子直径为1~100nm的分散系为胶体,小 鉴别 静置分层 于1nm的分散系为溶液。 应 应 (2)根据有无丁达尔效应来区分。 氢氧化铁胶 实例 食盐水、碘酒 油水混合物、泥水 体、云、雾 学以致用 ?思考发现 1.FeCl3溶液和Fe(OH)3胶体具有的共同性质是 当日光从窗隙射入暗室,或者光线透过树叶间的缝隙射 )。 入密林中时,可以观察到一条“光亮”的通路:放电影时,放映 A.都属于分散系 机到银幕间的光柱。 B.都是呈红褐色的混合物 C.分散质粒子的直径大小相同 D.都具有丁达尔效应 答案A 解析溶液和胶体都属于分散系,A符合题意:FC好 (1)图中的现象在化学上称作 这说明森林中或放映室内的空气具有 的性质。 溶液呈棕黄色,Fe(OH)3胶体呈红褐色,B不符合题意: (2)产生上述现象的根本原因是 FeCl2溶液中,Fe3+和CI-的直径都小于1nm,而Fe(OH)a 胶体粒子是许多“分子”的集合体,直径为1~100nm,C不 (3)此现象在化学上可用来 符合题意;溶液没有丁达尔效应,D不符合题意。 提示(1)丁达尔效应胶体 2.下列液体中,不会出现丁达尔效应的分散系 是( )。 (2)空气中含有的胶体粒子的直径大小为1~100nm, ①鸡蛋清溶液②水③淀粉溶液④硫酸钠溶液 对光线散射形成的 A.② B.①③ C.②④D.④ (3)鉴别胶体和溶液 答案D 解析①③是胶体,能够产生丁达尔效应:④是溶液,不 能产生丁达尔效应。②是纯净物,不是分散系。 4
化 学 必修 第一册 配人教版 答案 C 解析 因大圆圈表示纯净物,由题图关系可知,②属于 化合物,①属于单质。氧化物和碱均含氧元素,所以⑤属于 含氧化合物,C项正确。 二 分散系及其分类 重难归纳 溶液、胶体、乳浊液或悬浊液三类分散系的比较: 比较项目 溶液 胶体 乳浊液或悬浊液 分散质粒 子的直径 100nm 分散质 粒子 小分 子 或 离 子 许多 分 子 的 集合 体 或 大 分子 大量分子聚集在一 起形成的小液滴或 固体小颗粒 外观 均一、透明 均一 不均一、不透明 稳定性 稳定 较稳定 不稳定 鉴别 无丁 达 尔 效 应 有丁 达 尔 效 应 静置分层 实例 食盐水、碘酒 氢氧 化 铁 胶 体、云、雾 油水混合物、泥水 当日光从窗隙射入暗室,或者光线透过树叶间的缝隙射 入密林中时,可以观察到一条“光亮”的通路;放电影时,放映 机到银幕间的光柱。 (1)图中的现象在化学上称作 , 这说明森林中或放映室内的空气具有 的性质。 (2)产生上述现象的根本原因是 。 (3)此现象在化学上可用来 。 提示 (1)丁达尔效应 胶体 (2)空气中含有的胶体粒子的直径大小为1~100nm, 对光线散射形成的 (3)鉴别胶体和溶液 典例剖析 (双选)纳米材料是当今材料科学研究的前沿,其研究成 果广泛应用于催化及军事科学中。纳米材料是指在三维空 间中至少有一维处于纳米尺寸(1~100nm)或由它们作为 基本单元构成的材料。若将直径为50~70nm 的纳米碳分 散到蒸馏水中形成分散系,下列有关该分散系的说法正确的 是( )。 A.与溶液的本质区别是分散质粒子的直径大小不同 B.因为纳米碳粒子对光线的散射而有丁达尔效应 C.所得的液体呈胶状 D.所得的分散系一定是悬浊液 答案 AB 解析 将直径为50~70nm的纳米碳分散到蒸馏水中, 所得的分散系属于胶体;胶体均一,不呈胶状;胶体与溶液的 本质区别是分散质粒子的直径大小不同,A 项正确,C、D项 错误。胶体具有丁达尔效应,B项正确。 胶体和其他分散系的本质区别是分散质粒 子的直径大小不同,区分胶体和溶液的方法有: (1)根据分散质粒子的直径大小来区分。 分散质粒子直径为1~100nm 的分散系为胶体,小 于1nm的分散系为溶液。 (2)根据有无丁达尔效应来区分。 学以致用 1.FeCl3 溶液和Fe(OH)3 胶体具有的共同性质是 ( )。 A.都属于分散系 B.都是呈红褐色的混合物 C.分散质粒子的直径大小相同 D.都具有丁达尔效应 答案 A 解析 溶液和胶体都属于分散系,A 符合题意;FeCl3 溶液呈棕黄色,Fe(OH)3 胶体呈红褐色,B 不符合题意; FeCl3 溶液中,Fe3+ 和Cl- 的直径都小于1nm,而Fe(OH)3 胶体粒子是许多“分子”的集合体,直径为1~100nm,C不 符合题意;溶液没有丁达尔效应,D不符合题意。 2.下 列 液 体 中,不 会 出 现 丁 达 尔 效 应 的 分 散 系 是( )。 ①鸡蛋清溶液 ②水 ③淀粉溶液 ④硫酸钠溶液 A.② B.①③ C.②④ D.④ 答案 D 解析 ①③是胶体,能够产生丁达尔效应;④是溶液,不 能产生丁达尔效应。②是纯净物,不是分散系。 4
第一章物质及其变化 随堂训练 L.下列各组物质中属于同素异形体的是( )。 A氧化物 B.单质 A冰与水 B.铁丝与铁块 C碱 D.金属氧化物 C.金刚石与石墨 D.CO2和CO 答案B 答案C 解析碱性氧化物可以与酸反应生成盐和水,A项可能; 解析由同一种元素形成的不同的单质互为同素异形体, 酸与碱可以发生中和反应生成盐和水,C项可能:金属氧 A,D项是化合物,B项中铁丝与铁块是形状不同的同种 化物可能是碱性氧化物,如CuO,D项可能。 单质。 6.下列能用有关胶体的观点解释的现象是( )。 2.用特殊方法把固体物质加工成纳米级(1100m)的超 A.光线能透过CuSO,溶液 细粉末粒子,从而制得纳米材料。下列分散系中分散质的 B.酚酞溶液在NaOH溶液中显红色 粒子直径和这种超细粉末粒子的直径具有相同数量级的 C.将一束强光通过蛋白质溶液,能产生丁达尔效应 是()。 D.通过溶解、过滤,可以除去粗盐中的少量泥沙 A溶液 B.悬浊液 答案C C.胶体 D.乳浊液 解析CSO,溶液不属于胶体;蛋白质溶液为胶体,具有 答案C 丁达尔效应;粗盐中的泥沙不能透过滤纸,可用过滤法将 3.下列关于物质的分类正确的是( )。 其除去,与胶体无关。 选项 混合物 化合物 单质 盐 7.牙膏是日常生活中常用的清洁用品,由粉状摩擦剂、湿润 剂、表面活性剂、黏合剂、香料、甜味剂及其他特殊成分构 A 盐酸 NaOH固体 石墨 氯化钠 成。下表列出了三种牙膏中的摩擦剂。 B 碱石灰 金刚石 03 硫酸钡 牙膏 X牙膏 Y牙膏 Z牙膏 c 空气 澄清石灰水 软 碳酸钙 D Cuso4·5H2O CaCl2 水银 CaO 摩擦剂 氢氧化铝 碳酸钙 二氧化硅 答案A 摩擦剂物质类别 解析金刚石是单质,不是化合物,B项错误。澄清石灰 (指酸、碱、盐、氧化物】 水是混合物,不是化合物,C项错误。CuSO,·5H20是纯 (1)将上述摩擦剂所属物质的正确类别填入空格。 净物,氧化钙是氧化物,不是盐,D项错误。 (2)你推测上述三种摩擦剂都 (填“溶于”或“难溶 4.下列关于胶体的说法中正确的是()。 于”)水,理由是 A,胶体与溶液有明显不同的外观特征 B.胶体很不稳定,静置后易产生沉淀 (3)已知二氧化硅的化学式为SiO2,该物质能与NaOH溶 C.将Fe(OH):胶体进行过滤,所得到的滤液与原来胶体 液反应,反应的化学方程式为2NaOH+SiO2— 的组成不同 Na2SiO十HzO,Na2SiO3属于 (填“酸”“碱”或 D.豆浆是胶体,因为豆浆中的分散质粒子直径为1~ “盐”)类。由此可知SiO2属于 (填“酸性”或 100nm “碱性”)氧化物。非金属氧化物SO2也具有类似的性 答案D 质,请你写出SO2与NaOH溶液反应的化学方程式: 解析有些液溶胶是透明的,用肉眼很难与溶液相区分, A项错误。胶体较稳定,静置后不易产生沉淀,B项错误。 答案(1)盐氧化物 胶体的分散质粒子可以透过滤纸,所以将Fe(OH)3胶体 进行过滤时,胶体会透过滤纸,滤液与胶体的组成一致,C (2)难溶于摩擦剂是通过牙刷的运动摩擦来去除牙 项错误。胶体区别于其他分散系的本质是其分散质粒子 齿表面的牙垢,所以应难溶于水(合理即可) 直径为1~100nm,D项正确。 (3)盐酸性2NaOH+SO2一Na2SO3+H2O 5.若A十酸=盐十水,则A不可能属于()
第一章 物质及其变化 随堂训练 1.下列各组物质中属于同素异形体的是( )。 A.冰与水 B.铁丝与铁块 C.金刚石与石墨 D.CO2 和CO 答案 C 解析 由同一种元素形成的不同的单质互为同素异形体, A、D项是化合物,B项中铁丝与铁块是形状不同的同种 单质。 2.用特殊方法把固体物质加工成纳米级(1~100nm)的超 细粉末粒子,从而制得纳米材料。下列分散系中分散质的 粒子直径和这种超细粉末粒子的直径具有相同数量级的 是( )。 A.溶液 B.悬浊液 C.胶体 D.乳浊液 答案 C 3.下列关于物质的分类正确的是( )。 选项 混合物 化合物 单质 盐 A 盐酸 NaOH 固体 石墨 氯化钠 B 碱石灰 金刚石 O3 硫酸钡 C 空气 澄清石灰水 铁 碳酸钙 D CuSO4·5H2O CaCl2 水银 CaO 答案 A 解析 金刚石是单质,不是化合物,B项错误。澄清石灰 水是混合物,不是化合物,C项错误。CuSO4·5H2O是纯 净物,氧化钙是氧化物,不是盐,D项错误。 4.下列关于胶体的说法中正确的是( )。 A.胶体与溶液有明显不同的外观特征 B.胶体很不稳定,静置后易产生沉淀 C.将Fe(OH)3 胶体进行过滤,所得到的滤液与原来胶体 的组成不同 D.豆浆是胶体,因为豆浆中的分散质粒子直径为 1~ 100nm 答案 D 解析 有些液溶胶是透明的,用肉眼很难与溶液相区分, A项错误。胶体较稳定,静置后不易产生沉淀,B项错误。 胶体的分散质粒子可以透过滤纸,所以将Fe(OH)3 胶体 进行过滤时,胶体会透过滤纸,滤液与胶体的组成一致,C 项错误。胶体区别于其他分散系的本质是其分散质粒子 直径为1~100nm,D项正确。 5.若 A+酸盐+水,则 A不可能属于( )。 A.氧化物 B.单质 C.碱 D.金属氧化物 答案 B 解析 碱性氧化物可以与酸反应生成盐和水,A 项可能; 酸与碱可以发生中和反应生成盐和水,C项可能;金属氧 化物可能是碱性氧化物,如CuO,D项可能。 6.下列能用有关胶体的观点解释的现象是( )。 A.光线能透过CuSO4 溶液 B.酚酞溶液在 NaOH 溶液中显红色 C.将一束强光通过蛋白质溶液,能产生丁达尔效应 D.通过溶解、过滤,可以除去粗盐中的少量泥沙 答案 C 解析 CuSO4 溶液不属于胶体;蛋白质溶液为胶体,具有 丁达尔效应;粗盐中的泥沙不能透过滤纸,可用过滤法将 其除去,与胶体无关。 7.牙膏是日常生活中常用的清洁用品,由粉状摩擦剂、湿润 剂、表面活性剂、黏合剂、香料、甜味剂及其他特殊成分构 成。下表列出了三种牙膏中的摩擦剂。 牙膏 X牙膏 Y牙膏 Z牙膏 摩擦剂 氢氧化铝 碳酸钙 二氧化硅 摩擦剂物质类别 (指酸、碱、盐、氧化物) — (1)将上述摩擦剂所属物质的正确类别填入空格。 (2)你推测上述三种摩擦剂都 (填“溶于”或“难溶 于”)水,理由是 。 (3)已知二氧化硅的化学式为SiO2,该物质能与 NaOH溶 液反 应,反 应 的 化 学 方 程 式 为 2NaOH+SiO2 Na2SiO3+H2O,Na2SiO3 属于 (填“酸”“碱”或 “盐”)类。由此可知SiO2 属于 (填“酸性”或 “碱性”)氧化物。非金属氧化物SO2 也具有类似的性 质,请你写出SO2 与 NaOH 溶液反应的化学方程式: 。 答案 (1)盐 氧化物 (2)难溶于 摩擦剂是通过牙刷的运动摩擦来去除牙 齿表面的牙垢,所以应难溶于水(合理即可) (3)盐 酸性 2NaOH+SO2 Na2SO3+H2O 5

化学 必修 第一册 配人教版 课后·训练提升 1.下列关于KNO,的说法中,不正确的是( (2)Al2(SO4)。十6H20一2A1(OH)3(胶体)+ A.从其阳离子看,属于钾盐 3H,SO, B.从其阴离子看,属于硝酸盐 (3)不是。因为黄河水中除含有泥沙等物质,还含有 C.它属于纯净物中的无机化合物 其他溶质,而明矾净水只是除去泥沙等杂质,所以净化后 D.因为含有氧元素,故它属于氧化物 的黄河水不是纯净物。 答案D 5.在宏观一微观一符号之间建立联系,是化学学科特有的思 解析氧化物必须是只含有两种元素,且其中一种元素是 维方式。汽车尾气是造成大气污染的主要原因之一,在汽 氧元素。 车排气管上安装“催化转换器”便可以使汽车的尾气转换 2.化学与生产、生活密切相关。下列叙述正确的是( )。 成无毒气体。如用●表示碳原子,用○表示氧原子,用○ A.二水氯化钙(CaCl2·2H2O)属于混合物 表示氮原子,下图为气体转换的微观过程。请根据图示回 B.葡萄糖注射液不能产生丁达尔效应 答下列问题: C.食盐水属于浊液 ○催化剂 D.碳酸铵不属于盐类 加热 答案B A C D 解析二水氯化钙是纯净物,A项错误。葡萄糖注射液中 (I)A、B,C三种物质可以归为一类的依据是 分散质颗粒小于1nm,形成的是溶液,不是胶体,因此不 能产生丁达尔效应,B项正确。食盐水属于溶液,C项错 (2)将C归为化合物,将D归为单质的理由是 误。碳酸铵属于盐类,D项错误。 3.按溶液、浊液、胶体的顺序排列正确的是( )。 A矿泉水、牛奶、豆浆 (3)图示反应用化学方程式表示为】 B.碘酒、泥水、血液 ,化学变化过程中消耗的A物质和生成的C物质 C.白糖水、食盐水、茶叶水 的质量比为 D.Ca(OH)2悬浊液、澄清石灰水、石灰浆 (4)从微观的角度去描述你获得的关于化学变化的有关信 答案B 息(答出一条即可) 答案(1)都是氧化物 解析牛奶、豆浆、血液都是常见的胶体,食盐水属于溶 (2)二氧化碳是由两种元素原子构成的分子,而氮气 液,石灰浆属于悬浊液,故B项正确。 是由同种元素原子构成的分子 4.将浑浊的黄河水变为清澈的饮用水,净水是重要的环节。 明矾是常见的净水剂之一。 (3)2N0+2C0催化剂 C02+N215:22 明矾是由硫酸钾和硫酸铝混合形成的复盐。明矾一碰 (4)化学变化中原子的种类、数目没有发生改变(其他 D ② 到水,就会发生化学变化。在这个化学变化中,硫酸铝是主 合理答案也可) ④ 解析根据题意及图示可知:A为NO,B为CO,C为 角。硫酸铝与水发生化学变化后生成白色絮状物一 CO2,D为N2。 氨氧化铝胶体。氢氧化铝胶体粒子带正电荷。它一碰上带 ⑤ (1)根据A、B、C含有的元素种类可知,这三种物质都 负电荷的泥沙胶体粒子,彼此就中和了。失去了电荷的胶 属于氧化物,可以归为一类。 ⑥ (2)C为CO2,D为N2,二氧化碳含有两种元素,氨气 体粒子,很快就会聚结在一起,粒子越结越大,终于沉入水 含有一种元素,所以二氧化碳是化合物,氮气是单质。 底。这样,水就变得清澈千净了。 (3)同一化学反应中,分子数之比等于其化学计量数 根据相应材料,结合知识,回答下列问题。 (1)上述短文标有序号的物质中,属于混合物的是 之比,所以该反应的化学方程式为2N0十2C0催化剂 △ (填序号,下同),属于纯净物的是 ,属 2CO2十N2。A为NO、C为CO2,化学变化过程中消耗的 于盐的是 A物质和生成的C物质的质量比=2×(14十16):2× (2)短文中提到“硫酸铝与水发生化学变化后生成白色絮 (12+2×16)=15:22。 状物一氢氧化铝胶体”,请写出该反应的化学方程 (4)从微观角度可以看出,化学变化中原子的种类、数 式: 目没有发生改变(其他合理答案也可)。 (3)用明矾净化后的黄河水是不是纯净物?为什么? 6.胶体金即金溶胶,其具有光吸收性、呈色性和胶体性等特 点。免疫胶体金技术作为胶体金标记物,可实现对抗原抗 答案(1)⑥①②③④⑤①②③ 体的测定
化 学 必修 第一册 配人教版 课后·训练提升 1.下列关于 KNO3 的说法中,不正确的是( )。 A.从其阳离子看,属于钾盐 B.从其阴离子看,属于硝酸盐 C.它属于纯净物中的无机化合物 D.因为含有氧元素,故它属于氧化物 答案 D 解析 氧化物必须是只含有两种元素,且其中一种元素是 氧元素。 2.化学与生产、生活密切相关。下列叙述正确的是( )。 A.二水氯化钙(CaCl2·2H2O)属于混合物 B.葡萄糖注射液不能产生丁达尔效应 C.食盐水属于浊液 D.碳酸铵不属于盐类 答案 B 解析 二水氯化钙是纯净物,A项错误。葡萄糖注射液中 分散质颗粒小于1nm,形成的是溶液,不是胶体,因此不 能产生丁达尔效应,B项正确。食盐水属于溶液,C项错 误。碳酸铵属于盐类,D项错误。 3.按溶液、浊液、胶体的顺序排列正确的是( )。 A.矿泉水、牛奶、豆浆 B.碘酒、泥水、血液 C.白糖水、食盐水、茶叶水 D.Ca(OH)2 悬浊液、澄清石灰水、石灰浆 答案 B 解析 牛奶、豆浆、血液都是常见的胶体,食盐水属于溶 液,石灰浆属于悬浊液,故B项正确。 4.将浑浊的黄河水变为清澈的饮用水,净水是重要的环节。 明矾是常见的净水剂之一。 明矾 ① 是由硫酸钾 ② 和硫酸铝 ③ 混合形成的复盐。明矾一碰 到水 ④ ,就会发生化学变化。在这个化学变化中,硫酸铝是主 角。硫酸铝与水发生化学变化后生成白色絮状物——— 氢氧化铝 ⑤ 胶体。氢氧化铝胶体粒子带正电荷。它一碰上带 负电荷的泥沙 ⑥ 胶体粒子,彼此就中和了。失去了电荷的胶 体粒子,很快就会聚结在一起,粒子越结越大,终于沉入水 底。这样,水就变得清澈干净了。 根据相应材料,结合知识,回答下列问题。 (1)上述短文标有序号的物质中,属于混合物的是 (填序号,下同),属于纯净物的是 ,属 于盐的是 。 (2)短文中提到“硫酸铝与水发生化学变化后生成白色絮 状物———氢氧化铝胶体”,请写出该反应的化学方程 式: 。 (3)用明矾净化后的黄河水是不是纯净物? 为什么? 答案 (1)⑥ ①②③④⑤ ①②③ (2)Al2 (SO4)3 +6H2O 2Al(OH)3 (胶 体)+ 3H2SO4 (3)不是。因为黄河水中除含有泥沙等物质,还含有 其他溶质,而明矾净水只是除去泥沙等杂质,所以净化后 的黄河水不是纯净物。 5.在宏观—微观—符号之间建立联系,是化学学科特有的思 维方式。汽车尾气是造成大气污染的主要原因之一,在汽 车排气管上安装“催化转换器”便可以使汽车的尾气转换 成无毒气体。如用 表示碳原子,用 表示氧原子,用 表示氮原子,下图为气体转换的微观过程。请根据图示回 答下列问题: (1)A、B、C三种物质可以归为一类的依据是 。 (2)将C归为化合物,将D归为单质的理由是 。 (3)图示反应用化学方程式表示为 ,化学变化过程中消耗的 A物质和生成的C物质 的质量比为 。 (4)从微观的角度去描述你获得的关于化学变化的有关信 息(答出一条即可) 。 答案 (1)都是氧化物 (2)二氧化碳是由两种元素原子构成的分子,而氮气 是由同种元素原子构成的分子 (3)2NO+2CO 催化剂 △ 2CO2+N2 15∶22 (4)化学变化中原子的种类、数目没有发生改变(其他 合理答案也可) 解析 根据题意及图示可知:A 为 NO,B 为 CO,C 为 CO2,D为 N2。 (1)根据 A、B、C含有的元素种类可知,这三种物质都 属于氧化物,可以归为一类。 (2)C为CO2,D为 N2,二氧化碳含有两种元素,氮气 含有一种元素,所以二氧化碳是化合物,氮气是单质。 (3)同一化学反应中,分子数之比等于其化学计量数 之比,所以该反应的化学方程式为2NO+2CO 催化剂 △ 2CO2+N2。A为 NO、C为CO2,化学变化过程中消耗的 A物质和生成的 C物质的质量比=2×(14+16)∶2× (12+2×16)=15∶22。 (4)从微观角度可以看出,化学变化中原子的种类、数 目没有发生改变(其他合理答案也可)。 6.胶体金即金溶胶,其具有光吸收性、呈色性和胶体性等特 点。免疫胶体金技术作为胶体金标记物,可实现对抗原抗 体的测定。 6

第一章物质及其变化 用白磷还原法可制得一种金的分散系,该分散系在临床诊断 (2)该分散系属于 ,其分散质是 及药物检测等方面有着广泛的应用。 (3)步骤a过程发生 (填“化学”或“物理”,下 其操作步骤如下: 同)变化,步骤b过程发生 变化。 a,取20%白磷(①)的乙醚溶液0.5mL,加蒸馏水(②) 答案(1)①②④④ 60mL。 (2)胶体金颗粒 b.先滴加1%的氯化金水溶液(③)0.75mL,再滴加 (3)物理化学 1.2%的K2CO,(④)溶液0.6mL,振荡变成棕红色。 解析(1)①白磷属于单质,②蒸馏水属于化合物,③氯化 c加热煮沸至溶液变成透明红色。 金水溶液属于混合物,④K2CO3属于盐。(2)所得分散系 d.分离提纯,除去无机溶质。 中金颗粒的直径在5~l2m之间,所以形成的分散系属 所得分散系中,金颗粒直径在5~l2nm之间。请回答下 于胶体,其分散质是金颗粒。(3)由题目描述可知,步骤 列问题。 过程发生物理变化,步骤b过程发生化学变化。 (1)上述物质①②③④中属于单质的是 (填序号,下 同),属于化合物的是 ,属于盐的是 第2课时 物质的转化 课前·基础认知 1.酸、碱、盐的性质。 续表 (1)酸的性质。 盐的主要化学性质 反应实例(写出一个化学方程式即可) 以硫酸为例,填写下表: 酸的主要化学性质 反应实例(写出一个化学方程式即可) CuSO,2KOH -K,SO,+ 盐与碱反应 Cu(OH)2¥ 酸与活泼金属反应 H2SO,+Fe—FeSO,+H2↑ 酸与碱性氧化物反应 H2SO,+CuO=CuSO,+H2O CuSO+BaCl2 CuCl2+ 盐与某些盐反应 BasO,¥ H2SO+2NaOH =Na2SO+ 酸与碱反应 2H20 微判断(1)氢氧化钠溶液中滴加几滴石蕊溶液, 溶液变红色。 () H2SO+NazCO -Na2SO+ (2)酸具有相似的化学性质,是因为不同的酸溶液中都 酸与某些盐反应 CO2↑+H20 含有Ht。 () (3)反应Fe,0,+3C0高温 2Fe+十3CO2属于置换反应。 (2)碱的性质。 () 以氢氧化钠为例,填写下表: (4)碱性氧化物都可以与水反应生成相应的碱。() 碱的主要化学性质 反应实例(写出一个化学方程式即可) (5)一般来说,酸与碱、盐与酸、盐与碱、盐与盐之间的反 应都属于复分解反应。 () 碱与酸性氧化物反应 2NaOH+CO2-NazCO3+H2O 答案(1)X(2)√(3)×(4)×(5)/ 2.物质的转化。 碱与酸反应 NaOH+HCI=NaCl+H,O (1)物质的转化。 根据物质的组成和性质,通过化学变化可以实现物质 2NaOH+CuSO,—Na2SO,+ 之间的转化。在化学变化过程中,元素是不会改变的。 碱与某些盐反应 Cu(OHD2¥ 写出下列物质之间转化的化学方程式,体会物质间的转 化关系: (3)盐的性质。 ①Ca→CaO→Ca(OH)2→CaSO, 以硫酸铜为例,填写下表: 提示2Ca十02=2Ca0 盐的主要化学性质 反应实例(写出一个化学方程式即可) CaO+H2O=Ca(OH)2 Ca(OH)2+H2SO,-CaSO,+2H2O 盐与活泼金属反应 CuSO+Fe=FeSO+Cu ②C→C02→H,C02→CaCO3 提示C+O,点燃c0
第一章 物质及其变化 用白磷还原法可制得一种金的分散系,该分散系在临床诊断 及药物检测等方面有着广泛的应用。 其操作步骤如下: a.取20%白磷(①)的乙醚溶液0.5mL,加蒸馏水(②) 60mL。 b.先滴加 1% 的氯化金水溶液 (③)0.75 mL,再滴加 1.2%的 K2CO3(④)溶液0.6mL,振荡变成棕红色。 c.加热煮沸至溶液变成透明红色。 d.分离提纯,除去无机溶质。 所得分散系中,金颗粒直径在5~12nm 之间。请回答下 列问题。 (1)上述物质①②③④中属于单质的是 (填序号,下 同),属于化合物的是 ,属于盐的是 。 (2)该分散系属于 ,其分散质是 。 (3)步骤a过程发生 (填“化学”或“物理”,下 同)变化,步骤b过程发生 变化。 答案 (1)① ②④ ④ (2)胶体 金颗粒 (3)物理 化学 解析 (1)①白磷属于单质,②蒸馏水属于化合物,③氯化 金水溶液属于混合物,④K2CO3 属于盐。(2)所得分散系 中金颗粒的直径在5~12nm 之间,所以形成的分散系属 于胶体,其分散质是金颗粒。(3)由题目描述可知,步骤a 过程发生物理变化,步骤b过程发生化学变化。 第2课时 物质的转化 课前·基础认知 1.酸、碱、盐的性质。 (1)酸的性质。 以硫酸为例,填写下表: 酸的主要化学性质 反应实例(写出一个化学方程式即可) 酸与活泼金属反应 H2SO4+FeFeSO4+H2↑ 酸与碱性氧化物反应 H2SO4+CuOCuSO4+H2O 酸与碱反应 H2SO4 +2NaOH Na2SO4 + 2H2O 酸与某些盐反应 H2SO4 + Na2CO3 Na2SO4 + CO2↑+H2O (2)碱的性质。 以氢氧化钠为例,填写下表: 碱的主要化学性质 反应实例(写出一个化学方程式即可) 碱与酸性氧化物反应 2NaOH+CO2 Na2CO3+H2O 碱与酸反应 NaOH+HClNaCl+H2O 碱与某些盐反应 2NaOH +CuSO4 Na2SO4 + Cu(OH)2↓ (3)盐的性质。 以硫酸铜为例,填写下表: 盐的主要化学性质 反应实例(写出一个化学方程式即可) 盐与活泼金属反应 CuSO4+FeFeSO4+Cu 续表 盐的主要化学性质 反应实例(写出一个化学方程式即可) 盐与碱反应 CuSO4 + 2KOH K2SO4 + Cu(OH)2↓ 盐与某些盐反应 CuSO4 + BaCl2 CuCl2 + BaSO4↓ 微判断 1 (1)氢氧化钠溶液中滴加几滴石蕊溶液, 溶液变红色。 ( ) (2)酸具有相似的化学性质,是因为不同的酸溶液中都 含有 H+ 。 ( ) (3)反应Fe2O3+3CO 高温 2Fe+3CO2 属于置换反应。 ( ) (4)碱性氧化物都可以与水反应生成相应的碱。( ) (5)一般来说,酸与碱、盐与酸、盐与碱、盐与盐之间的反 应都属于复分解反应。 ( ) 答案 (1)× (2)√ (3)× (4)× (5)√ 2.物质的转化。 (1)物质的转化。 根据物质的组成和性质,通过 化学变化 可以实现物质 之间的转化。在化学变化过程中,元素 是不会改变的。 写出下列物质之间转化的化学方程式,体会物质间的转 化关系: ①Ca →CaO →Ca(OH)2 →CaSO4 提示 2Ca+O2 2CaO CaO+H2OCa(OH)2 Ca(OH)2+H2SO4 CaSO4+2H2O ②C →CO2 →H2CO3 →CaCO3 提示 C+O2 点燃 CO2 7

化学 必修 第一册 配人教版 CO2+H2O=H2CO 考虑因素 H2CO+Ca(OH)2=CaCOa+2H2O 徽判断2(1)化学变化过程中,物质和元素都会发 生改变。 反应进行的可能性原料来源成本高低设备要求… (2)金属单质可与氧气反应生成碱性氧化物。( 实例一工业上制取NaOH,可以用以下3种方法: (3)在一定条件下,Na,CO2与酸、碱、盐都能反应。 ①Na,O+H,O=2NaOH:(Na,O作为原料,来源 ( 少、成本高) (4)制取某种碱,可以采取盐与另一种碱发生反应。 ②电解饱和食盐水:2NaC1+2H,0电解H,+C,++ 答案(1)×(2)/(3)√(4)√ 2NaOH; (2)物质的转化的应用。 ③用纯碱和熟石灰反应:Na2CO,+Ca(OH)2 根据物质的组成和性质,以及物质之间转化的关系,我 CaCO3¥+2NaOH. 们可以确定制取某类物质的可能方法。 综合考虑反应进行的可能性,选取的最适当的方法为方 最适当方法的选择: 法②。 课堂·重难突破 酸、碱、盐、氧化物之间的转化关系 ?思考发现 生活中处处有化学。 重难归纳 I.用水壶长期加热澄清的自来水,水壶里会出现一层厚 1.不同类别物质间的转化关系。 厚的水垢水垢的主要成分是碳酸钙和Mg(OH)2]。水垢碎 运用分类的方法,不仅能使有关化学物质及其变化的知 片进入胃中会与盐酸反应,产生氯化钙、氯化镁和二氧化碳。 识系统化,还可以发现物质及其变化的规律。一般来说,酸、 碱、盐、氧化物之间的转化关系如下: 金国 非金属 Ⅱ.菠菜中含有丰富的草酸、草酸钠(Na2C2O,):豆腐中 含有较多的钙盐,如硫酸钙等:草酸钙是一种难溶于水的沉 性 酸性 淀。从营养学的观点看,有人认为菠菜和豆腐混合食用不利 氧化物 氧化物 于它们营养成分的吸收。 和 Ⅲ.生活中常用白醋(含有CH,COOH,CH COOH为一 盐和水 元弱酸)擦拭某些日用品上的铁锈(主要成分为F2O3)。 酸 根据以上生活常识,回答下列问题。 (1)请你写出水垢在胃中发生反应的化学方程式: 碱和盐 一酸和盐 另两种盐 (2)写出草酸钠与氯化钙反应的化学方程式: ,该反应属于 2.化学反应的分类。 反应。 根据反应物和生成物的种类和数量可以把化学反应分 (3)铁锈的主要成分Fe2O3属于 (填“酸性”或 为化合反应、分解反应、置换反应、复分解反应。 “碱性”)氧化物,其与CH COOH溶液反应的化学方程式为 化合反应是指由两种或两种以上的物质生成一种物质 0 的化学反应: 分解反应是指一种物质生成两种或两种以上物质的化 提示(1)CaCO3+2HC1=CaCl2+H2O+CO2↑ 学反应: Mg(OH),+2HCI=MgCl,+2H2O 置换反应是指一种单质与一种化合物生成另一种单质 (2)NazC2O,十CaC2=CaC2O,¥+2NaCI复分解 和另一种化合物的化学反应; (3)碱性FeO2+6 CHCOOH一2(CH,COO),Fe十 复分解反应是指两种化合物互相交换成分生成另外两 3H,O 种化合物的化学反应
化 学 必修 第一册 配人教版 CO2+H2OH2CO3 H2CO3+Ca(OH)2 CaCO3↓+2H2O 微判断 2 (1)化学变化过程中,物质和元素都会发 生改变。 ( ) (2)金属单质可与氧气反应生成碱性氧化物。 ( ) (3)在一定条件下,Na2CO3 与酸、碱、盐都能反应。 ( ) (4)制取某种碱,可以采取盐与另一种碱发生反应。 ( ) 答案 (1)× (2)√ (3)√ (4)√ (2)物质的转化的应用。 根据物质的组成和性质,以及物质之间转化的关系,我 们可以确定制取某类物质的可能方法。 最适当方法的选择: 实例———工业上制取NaOH,可以用以下3种方法: ①Na2O+H2O 2NaOH ;(Na2O作为原料,来源 少、成本高) ②电解饱和食盐水:2NaCl+2H2O 电解 H2↑+Cl2↑+ 2NaOH; ③用纯碱和熟石灰反应: Na2CO3 +Ca(OH)2 CaCO3↓+2NaOH 。 综合考虑反应进行的可能性,选取的最适当的方法为方 法②。 课堂·重难突破 酸、碱、盐、氧化物之间的转化关系 重难归纳 1.不同类别物质间的转化关系。 运用分类的方法,不仅能使有关化学物质及其变化的知 识系统化,还可以发现物质及其变化的规律。一般来说,酸、 碱、盐、氧化物之间的转化关系如下: 2.化学反应的分类。 根据反应物和生成物的种类和数量可以把化学反应分 为化合反应、分解反应、置换反应、复分解反应。 化合反应是指由两种或两种以上的物质生成一种物质 的化学反应; 分解反应是指一种物质生成两种或两种以上物质的化 学反应; 置换反应是指一种单质与一种化合物生成另一种单质 和另一种化合物的化学反应; 复分解反应是指两种化合物互相交换成分生成另外两 种化合物的化学反应。 生活中处处有化学。 Ⅰ.用水壶长期加热澄清的自来水,水壶里会出现一层厚 厚的水垢[水垢的主要成分是碳酸钙和 Mg(OH)2]。水垢碎 片进入胃中会与盐酸反应,产生氯化钙、氯化镁和二氧化碳。 Ⅱ.菠菜中含有丰富的草酸、草酸钠(Na2C2O4);豆腐中 含有较多的钙盐,如硫酸钙等;草酸钙是一种难溶于水的沉 淀。从营养学的观点看,有人认为菠菜和豆腐混合食用不利 于它们营养成分的吸收。 Ⅲ.生活中常用白醋(含有CH3COOH,CH3COOH 为一 元弱酸)擦拭某些日用品上的铁锈(主要成分为Fe2O3)。 根据以上生活常识,回答下列问题。 (1)请你写出水垢在胃中发生反应的化学方程式: , 。 (2)写出草酸钠与氯化钙反应的化学方程式: ,该反应属于 反应。 (3)铁锈的主要成分Fe2O3 属于 (填“酸性”或 “碱性”)氧化物,其与CH3COOH 溶液反应的化学方程式为 。 提示 (1)CaCO3+2HClCaCl2+H2O+CO2↑ Mg(OH)2+2HClMgCl2+2H2O (2)Na2C2O4+CaCl2 CaC2O4↓+2NaCl 复分解 (3)碱性 Fe2O3+6CH3COOH2(CH3COO)3Fe+ 3H2O 8

第一章 物质及其变化 典例剖析 答案C 解析该过程中发生的反应依次是 在稀硫酸、纯碱、二氧化碳、铜片、食盐、氧化铜、一氧化 碳、铁片和木炭粉9种物质中,存在如图所示的相互关系,选 CaCO,越挑ca0+CO,↑(分解反应: 择①~⑤中适当的物质,使有连线的两种物质能发生反应。 CaO+H2O=Ca(OH)2(化合反应): Ca(OH)2+KzCO3一CaCO3¥+2KOH(复分解 单质:可 氧化物:③ 反应)。 2.物质A~E均含同种元素,都是中学化学中常见的物 酸:② 氧化物:④ 质,它们可发生如图所表示的反应(除A一E外的其他物质 盐:⑤ 已略去): 氯化钡 (1)请推断出它们的化学式分别为:① :② ④ :③ :④ :⑤ (2)写出下列序号对应的物质之间反应的化学方程式: 稀硫酸③ A ①和②: H,① ②和④: 2 加热 D ②和⑤: 6 ③和④: (1)写出相应物质的类别: 答案(1)①Fe②HSO,③C0④CuO 物质 B C D ⑤NazCO3 (2)Fe十H2SO,—FeSO,+H2↑ 类别 H2SO,+CuO=CuSO,+H2O (2)在以上反应中(用序号填空): H2SO,+Na2CO3—Na2SO4+H2O+CO2↑ 属于置换反应的是 ,属于复分解反应的是 CO+CuO-A-Cu+CO: (3)写出反应③和⑦的化学方程式: 解析(1)根据单质①能与酸②发生反应,推知①应为 活泼金属,即①为F,所给9种物质中酸只有稀硫酸,即② 答案(1)盐碱氧化物 为稀硫酸:氧化物④能与酸反应,应为碱性氧化物,为氧化 铜,氧化物③能与氧化铜反应,为CO:⑤属于盐,能与酸反 (2)①⑦③④⑤ 应,则⑤为Na2CO3。 (3)CuO+H2SO,=CuSO,+H2O CuSO,+Fe- (2)①和②反应的化学方程式为Fe十H2SO4 Cu+FeSO FeSO4十H2↑:②和④反应的化学方程式为HzSO,十CuO 解析由反应③D十稀硫酸一→E,反应④E十BaCl2 一CuSO,十H2O:②和⑤反应的化学方程式为HzSO,十 →B推断E为硫酸盐,B为氯化物;由反应⑦E十Fe→ Na2CO3一Na2SO,十H,O十C02↑:③和④反应的化学方 A、反应①D十H2→A,推测⑦①可能为置换反应,结合各 程式为C0+Cu0△Cu+C0. 物质为中学常见物质,则A为Cu,E为CuSO,B为CuC2, C为Cu(OH)2:由转化⑥C在加热条件下生成D,则D为 学以致用 CuO:反应③为CuO十H2SO,→CuSO4,反应①为CuO十 H2→Cu,反应②为Cu十O2→CuO,验证符合转化 1.KOH在我国古代纺织业中常用作漂洗的洗涤剂。 关系。 古代制取KOH的流程如下: (1)由上述分析可知,B是CuCl2,属于盐:C是 草木灰(KC0) Cu(OH)2,属于碱:D是CuO,属于氧化物。 (2)反应①是CuO十H2→Cu十H2O,为置换反应:反 贝壳(CaCO) 发烧生石灰CaO) KOH 应②是Cu十O2→CuO,为化合反应:反应③是CuO十 H2SO4→CuSO,十H2O,属于复分解反应:反应④是 CuSO,十BaCL2→BaSO,十CuCl2,属于复分解反应:反应 ⑤是CuCl2十碱→Cu(OH)2十新盐,属于复分解反应:反 上述流程中没有涉及的化学反应类型是( A化合反应 B分解反应 应⑥是Cu(OH)2→CuO十H2O,属于分解反应:反应⑦是 C.置换反应 CuSO,十Fe→Cu十FeSO,属于置换反应。 D.复分解反应 9
第一章 物质及其变化 典例剖析 在稀硫酸、纯碱、二氧化碳、铜片、食盐、氧化铜、一氧化 碳、铁片和木炭粉9种物质中,存在如图所示的相互关系,选 择①~⑤中适当的物质,使有连线的两种物质能发生反应。 (1)请推断出它们的化学式分别为:① ;② ;③ ;④ ;⑤ 。 (2)写出下列序号对应的物质之间反应的化学方程式: ①和②: ; ②和④: ; ②和⑤: ; ③和④: 。 答案 (1)①Fe ②H2SO4 ③CO ④CuO ⑤Na2CO3 (2)Fe+H2SO4 FeSO4+H2↑ H2SO4+CuOCuSO4+H2O H2SO4+Na2CO3 Na2SO4+H2O+CO2↑ CO+CuO △ Cu+CO2 解析 (1)根据单质①能与酸②发生反应,推知①应为 活泼金属,即①为Fe,所给9种物质中酸只有稀硫酸,即② 为稀硫酸;氧化物④能与酸反应,应为碱性氧化物,为氧化 铜,氧化物③能与氧化铜反应,为 CO;⑤属于盐,能与酸反 应,则⑤为 Na2CO3。 (2)① 和 ② 反应的化学方程式 为 Fe+ H2SO4 FeSO4+H2↑;②和④反应的化学方程式为 H2SO4+CuO CuSO4+H2O;②和⑤反应的化学方程式为 H2SO4+ Na2CO3 Na2SO4+H2O+CO2↑;③和④反应的化学方 程式为CO+CuO △ Cu+CO2。 学以致用 1.KOH 在我国古代纺织业中常用作漂洗的洗涤剂。 古代制取 KOH 的流程如下: 上述流程中没有涉及的化学反应类型是( )。 A.化合反应 B.分解反应 C.置换反应 D.复分解反应 答案 C 解析 该过程中发生的反应依次是 CaCO3 煅烧 CaO+CO2↑(分解反应); CaO+H2OCa(OH)2(化合反应); Ca(OH)2 +K2CO3 CaCO3 ↓ +2KOH(复 分 解 反应)。 2.物质 A~E均含同种元素,都是中学化学中常见的物 质,它们可发生如图所表示的反应(除 A~E外的其他物质 已略去): (1)写出相应物质的类别: 物质 B C D 类别 (2)在以上反应中(用序号填空): 属于置换反应的是 ,属于复分解反应的是 。 (3)写出反应③和⑦的化学方程式: , 。 答案 (1)盐 碱 氧化物 (2)①⑦ ③④⑤ (3)CuO+H2SO4 CuSO4+H2O CuSO4+Fe Cu+FeSO4 解析 由反应③D+稀硫酸 →E,反应④E+BaCl2 →B推断E为硫酸盐,B为氯化物;由反应⑦E+Fe → A、反应①D+H2 →A,推测⑦①可能为置换反应,结合各 物质为中学常见物质,则 A为Cu,E为CuSO4,B为CuCl2, C为Cu(OH)2;由转化⑥C在加热条件下生成 D,则 D 为 CuO;反应③为CuO+H2SO4 →CuSO4,反应①为CuO+ H2 →Cu,反应 ② 为 Cu+O2 →CuO,验证符合转化 关系。 (1)由 上 述 分 析 可 知,B 是 CuCl2,属 于 盐;C 是 Cu(OH)2,属于碱;D是CuO,属于氧化物。 (2)反应①是CuO+H2 →Cu+H2O,为置换反应;反 应②是 Cu+O2 →CuO,为化合反应;反应③是 CuO+ H2SO4 →CuSO4 + H2O,属 于 复 分 解 反 应;反 应 ④ 是 CuSO4+BaCl2 →BaSO4+CuCl2,属于复分解反应;反应 ⑤是CuCl2+碱 →Cu(OH)2+新盐,属于复分解反应;反 应⑥是Cu(OH)2 →CuO+H2O,属于分解反应;反应⑦是 CuSO4+Fe →Cu+FeSO4,属于置换反应。 9

化学 必修 第一册 配人教版 随堂训练 1.下列物质中,不含酸根离子的是( )。 应,不能由一步反应转化为氨氧化铜,故D符合题意。 A.NazSO B.Ba(OH)2 C.KMnO D.KCI 5.各物质间有着一定的转化关系,下列各组物质间可以按下 答案B 图所示直接转化的是( 解析Na2SO,中含有硫酸根离子,KMnO,中含有高锰 物质小一→物质B一物质C一物质A 酸根离子,KCI中含有氯离子,只有Ba(OH)2为碱,由金 A.Fe→FezO3→FeSO,→Fe 属离子和氢氧根离子构成。 B.COCO2→H2CO3→CO 2.下列反应的化学方程式中有一个与其他三个在分类上不 C.NaOH→NaC→NazCOa→NaOH 同,这个反应是( )。 D.HC→CuCl2→BaCl2→HCl AS+0,点燃s0, 答案D B.NazCOa+COz+H2O-2NaHCOa 解析Fe2O,→FeSO,不能一步实现转化,A不符合题 C.NH,HCO,NH,++co2++HO 意:H2CO3→CO不能一步实现转化,B不符合题意; NaC→Na2CO,不能一步实现转化,C不符合题意:HCl D.c0,+C高温2c0 能够与Cu(OH)2反应生成CuCl2,Ba(OH)2与CuC2反 答案C 应生成BaCl2,H2SO,与BaCl2反应生成HCl,均能一步 解析A,B、D三项中的反应都属于化合反应,而C项中 实现转化,故D符合题意。 的反应属于分解反应。 6.分类法是一种重要的学习方法。 3.以下表示的是碳及其化合物的转化关系,其中涉及的基本 (1)下列4组物质中均有一种物质的类别与其他三种不 反应类型依次是( 同,请分别写出其化学式。 C.Cu H.CO. Ca(OHD:CaCO 煅烧c0: 甲:Na、H2、O2、C2: C02 高温 乙:C0、Na20、CO2、SO2: A化合、置换、分解、复分解 丙:NaOH、KzCO3、KHCO3、K2SO4; B.置换、复分解、化合、分解 丁:NaOH、Ca(OH)2、KOH、NaCl。 C.置换、化合、分解、复分解 甲 ,乙 ,丙 D.置换、化合、复分解、分解 丁 答案D (2)问题(1)中四种物质存在如图所示转化关系,写出序号 解析题述转化关系中涉及的化学反应及反应类型依次 所示反应的化学方程式: 为C+2Cu0高遥2Cu+C0,+,置换反应:C0,十H,0 甲①☑②因③回 —H2CO3,化合反应;H2COa+Ca(OH)2= ① 城烧Ca0十 ② CaCO3¥十2HO,复分解反应;CaCO2 ③ CO2↑,分解反应。 答案(I)Na NazO NaOH NaCl 4.下列物质转化过程中,不能经过一步反应实现的 (2)①4Na+O2=2Na20②Na0+H,0 是()。 2NaOH 3NaOH+HCI-NaCl+H2O A.HC→CuC2 B.Na2SO,→NaCl 解析(I)甲组物质中只有N是金属单质,其余是非金 C.C0→C02 D.CuO→Cu(OH)2 答案D 属单质:乙组物质中只有N2O是金属氧化物,其余是非 金属氧化物:丙组物质中只有NaOH是碱,其余是盐:丁 解析盐酸与氧化铜、氢氧化铜等物质反应可一步生成 组物质中只有NaCl是盐,其余是碱。 氯化铜,故A不符合题意;Na2SO,与氯化钡反应能一步 (2)由题图可知是Na→Na2O→NaOH→NaCl,各反 生成氯化钠,故B不符合题意:CO具有可燃性和还原性, 应的化学方程式是4Na十O2-2Na2O,Na2O+H2O 一氧化碳燃烧或与金属氧化物等反应都可以一步转化为 -2NaOH,NaOH+HCl—NaCl+H2O。 二氧化碳,故C不符合题意:氧化铜难溶于水,与水不反 10
化 学 必修 第一册 配人教版 随堂训练 1.下列物质中,不含酸根离子的是( )。 A.Na2SO4 B.Ba(OH)2 C.KMnO4 D.KCl 答案 B 解析 Na2SO4 中含有硫酸根离子,KMnO4 中含有高锰 酸根离子,KCl中含有氯离子,只有Ba(OH)2 为碱,由金 属离子和氢氧根离子构成。 2.下列反应的化学方程式中有一个与其他三个在分类上不 同,这个反应是( )。 A.S+O2 点燃 SO2 B.Na2CO3+CO2+H2O2NaHCO3 C.NH4HCO3 △ NH3↑+CO2↑+H2O D.CO2+C 高温 2CO 答案 C 解析 A、B、D三项中的反应都属于化合反应,而C项中 的反应属于分解反应。 3.以下表示的是碳及其化合物的转化关系,其中涉及的基本 反应类型依次是( )。 C CuO 高温 →CO2 H2O →H2CO3 Ca(OH)2 →CaCO3 煅烧 →CO2 A.化合、置换、分解、复分解 B.置换、复分解、化合、分解 C.置换、化合、分解、复分解 D.置换、化合、复分解、分解 答案 D 解析 题述转化关系中涉及的化学反应及反应类型依次 为C+2CuO 高温 2Cu+CO2 ↑,置换反应;CO2 +H2O H2CO3,化 合 反 应;H2CO3 + Ca(OH)2 CaCO3↓+2H2O,复 分 解 反 应;CaCO3 煅烧 CaO + CO2↑,分解反应。 4.下 列 物 质 转 化 过 程 中,不 能 经 过 一 步 反 应 实 现 的 是( )。 A.HCl→CuCl2 B.Na2SO4→NaCl C.CO→CO2 D.CuO→Cu(OH)2 答案 D 解析 盐酸与氧化铜、氢氧化铜等物质反应可一步生成 氯化铜,故 A不符合题意;Na2SO4 与氯化钡反应能一步 生成氯化钠,故B不符合题意;CO具有可燃性和还原性, 一氧化碳燃烧或与金属氧化物等反应都可以一步转化为 二氧化碳,故C不符合题意;氧化铜难溶于水,与水不反 应,不能由一步反应转化为氢氧化铜,故D符合题意。 5.各物质间有着一定的转化关系,下列各组物质间可以按下 图所示直接转化的是( )。 物质 A → 物质B → 物质C → 物质 A A.Fe→Fe2O3→FeSO4→Fe B.CO→CO2→H2CO3→CO C.NaOH→NaCl→Na2CO3→NaOH D.HCl→CuCl2→BaCl2→HCl 答案 D 解析 Fe2O3→FeSO4 不能一步实现转化,A 不符合题 意;H2CO3 →CO 不能一步实现转化,B 不符合 题 意; NaCl→Na2CO3 不能一步实现转化,C不符合题意;HCl 能够与Cu(OH)2 反应生成CuCl2,Ba(OH)2 与CuCl2 反 应生成 BaCl2,H2SO4 与 BaCl2 反应生成 HCl,均能一步 实现转化,故D符合题意。 6.分类法是一种重要的学习方法。 (1)下列4组物质中均有一种物质的类别与其他三种不 同,请分别写出其化学式。 甲:Na、H2、O2、Cl2; 乙:CO、Na2O、CO2、SO2; 丙:NaOH、K2CO3、KHCO3、K2SO4; 丁:NaOH、Ca(OH)2、KOH、NaCl。 甲 ,乙 ,丙 , 丁 。 (2)问题(1)中四种物质存在如图所示转化关系,写出序号 所示反应的化学方程式: 甲 ① → 乙 ② → 丙 ③ → 丁 ① 。 ② 。 ③ 。 答案 (1)Na Na2O NaOH NaCl (2)①4Na+O2 2Na2O ②Na2O+H2O 2NaOH ③NaOH+HClNaCl+H2O 解析 (1)甲组物质中只有 Na是金属单质,其余是非金 属单质;乙组物质中只有 Na2O 是金属氧化物,其余是非 金属氧化物;丙组物质中只有 NaOH 是碱,其余是盐;丁 组物质中只有 NaCl是盐,其余是碱。 (2)由题图可知是 Na→Na2O→NaOH→NaCl,各反 应的化学方程式是4Na+O2 2Na2O,Na2O+H2O 2NaOH,NaOH+HClNaCl+H2O。 10