
全程设计 第2课时 电解原理的应用
第2课时 电解原理的应用

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随堂训练
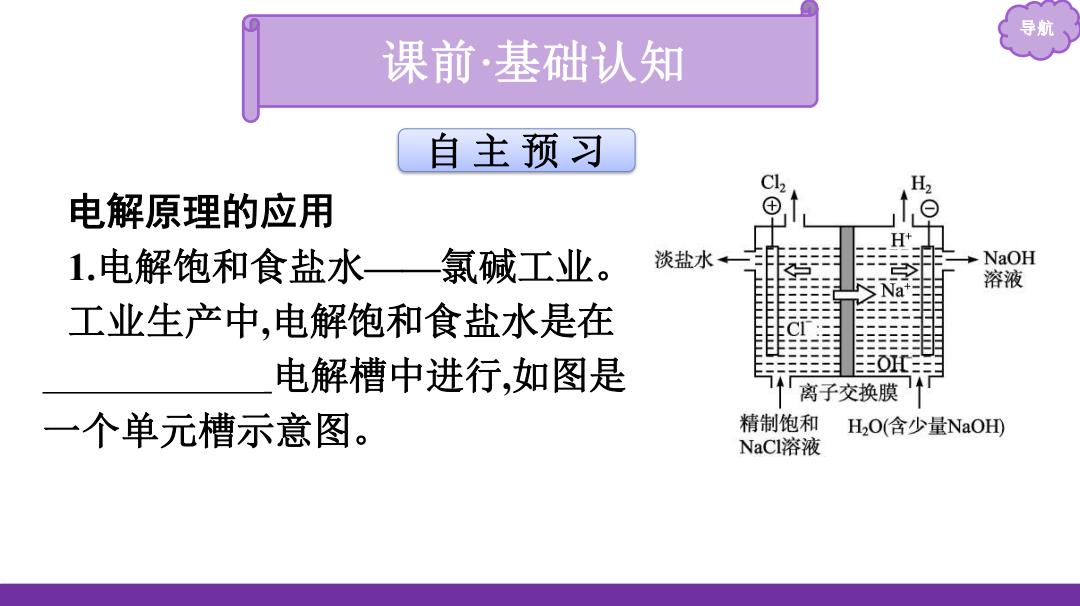
导航 课前·基础认知 自主预习 H, 电解原理的应用 ⊕ 1.电解饱和食盐水一氯碱工业。 淡盐水←一 -NaOH 溶液 工业生产中,电解饱和食盐水是在 电解槽中进行,如图是 离子交换膜 一个单元槽示意图。 精制饱和 H2O(含少量NaOD NaCl溶液
导航 电解原理的应用 1.电解饱和食盐水——氯碱工业。 工业生产中 ,电解饱和食盐水是在 离子交换膜 电解槽中进行 ,如图是 一个单元槽示意图 。 自 主 预 习 课前 ·基础认知

导航 (1)阳极反应式: 阴极反应式: 2)总反应方程式: (3)在阴极区可得到产品NaOH的原因:
导航 (1)阳极反应式: 2Cl- -2e-══Cl2↑ , 阴极反应式: 2H2O+2e-══H2↑+2OH- 。 (2)总反应方程式: 2Cl- +2H2O 2OH- +H2↑+Cl2↑ 。 (3)在阴极区可得到产品NaOH的原因: H2O在阴极放电产 生OH- ,阳极区的Na+通过阳离子交换膜进入阴极区,两者结合 即得NaOH

导航 微思考1工业上电解饱和食盐水时,若将电解槽中的阳离子 交换膜去掉,对产品会有什么影响? 提示:阳极产生的Cl,会扩散至阴极区,与阴极产物NaOH反 应,降低产率,且使产品不纯
导航 微思考1工业上电解饱和食盐水时,若将电解槽中的阳离子 交换膜去掉,对产品会有什么影响? 提示:阳极产生的Cl2会扩散至阴极区,与阴极产物NaOH反 应,降低产率,且使产品不纯

2.电镀。 电镀是一种利用 原理在某些金属表面 镀上一薄层 的加工工艺。如 图是在铁钥匙上镀铜的工作示意图,据此回答问题: (1)镀件(钥匙)作 极,镀层金属(铜)作 极,含有 (Cu+)的溶液作电镀液。 (2)阳极上发生的电极反应为 ;阴极上发 生的电极反应为
导航 2.电镀。 电镀是一种利用 电解 原理在某些金属表面 镀上一薄层 其他金属或合金 的加工工艺。如 图是在铁钥匙上镀铜的工作示意图,据此回答问题: (1)镀件(钥匙)作 阴 极,镀层金属(铜)作 阳 极,含有 镀层金属离子 (Cu2+)的溶液作电镀液。 (2)阳极上发生的电极反应为 Cu-2e-══Cu2+ ;阴极上发 生的电极反应为 Cu2++2e-══Cu

导航 微思考2电镀进行一段时间后,电镀液的浓度是如何变化的? 提示:因阳极溶解的Cu和阴极析出的Cu的量相等,所以电镀 液的浓度基本不变
导航 微思考2电镀进行一段时间后,电镀液的浓度是如何变化的? 提示:因阳极溶解的Cu和阴极析出的Cu的量相等,所以电镀 液的浓度基本不变

导 3.电解精炼铜。 ()利用电解原理进行电解精炼铜时,以粗铜作 极,以 纯铜作 极,通常用 作电解质溶液。 (2)粗铜中含有Zn、Fe、Ni、Ag、Au等杂质金属,其中 可在阳极放电变成相应的金属离子进 入溶液中, 等金属则沉淀在阳极底部形成阳极泥。 写出阳极上发生的电极反应: 写出阴极上发生的电极反应:
导航 3.电解精炼铜。 (1)利用电解原理进行电解精炼铜时,以粗铜作 阳 极,以 纯铜作 阴 极,通常用 CuSO4溶液 作电解质溶液。 (2)粗铜中含有Zn、Fe、Ni、Ag、Au等杂质金属,其中 Zn、Fe、Ni、Cu 可在阳极放电变成相应的金属离子进 入溶液中, Ag、Au 等金属则沉淀在阳极底部形成阳极泥。 写出阳极上发生的电极反应: Zn-2e-══Zn2+,Fe-2e- ══Fe2+ ,Ni-2e-══Ni2+,Cu-2e-══Cu2+ ; 写出阴极上发生的电极反应: Cu2++2e-══Cu

导航 微思考3电解精炼铜时,当电解进行一段时间后,CuSO4溶液 的浓度是如何变化的? 提示:阳极除溶解Cu外,还溶解Zn、Fe、Ni等金属,而阴极只 析出Cu,所以CuSO4溶液的浓度会减小
导航 微思考3电解精炼铜时,当电解进行一段时间后,CuSO4溶液 的浓度是如何变化的? 提示:阳极除溶解Cu外,还溶解Zn、Fe、Ni等金属,而阴极只 析出Cu,所以CuSO4溶液的浓度会减小

导航 4.电治金。 电解法是治炼金属的一种重要方法,利用电解法可以冶炼 Na、Ca、Mg、A等活泼金属。用直流电电解熔融NaCl制 取金属钠的化学方程式为 。阳 极反应为 ;阴极反应为
导航 4.电冶金。 电解法是冶炼金属的一种重要方法,利用电解法可以冶炼 Na、Ca、Mg、Al等活泼金属。用直流电电解熔融NaCl制 取金属钠的化学方程式为 2NaCl(熔融) 2Na+Cl2↑ 。阳 极反应为 2Cl- -2e-══Cl2↑ ;阴极反应为 Na++e-══Na