
第三节 氧化还原反应 第1课时 氧化还原反应 课后·训练提升 合格考基础巩固 1.下列有关氧化还原反应实质的说法中正确的是( A.是否有电子转移 B.是否有元素化合价的变化 C.是否有氧元素的参加 D.是否有原子的重新组合 答案:A 解析:氧化还原反应的实质是有电子转移(包括电子得失和电子对偏移),而外部特 征是有元素化合价发生变化。只要有元素化合价升降的反应就是氧化还原反应, 与是否有氧元素参加无关。 2.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下,则下 列说法不正确的是( 00+Q0-00+Q (说明:一种小球代表一种元素的原子) A.图中的反应物都是化合物 B该反应属于置换反应 C.该反应属于氧化还原反应 D.该反应一定符合质量守恒定律 答案:A 解析:该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的置 换反应,一定是氧化还原反应,所有化学反应都符合质量守恒定律。 3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影 部分的是()。 化合反应 分解反应 氧化还原反应 、置换反应 复分解反应 A.Cl2+2KB1—Br2+2KCI B.2NaHCO;Na2CO3+H2O+CO21
第三节 氧化还原反应 第 1 课时 氧化还原反应 课后· 合格考基础巩固 1.下列有关氧化还原反应实质的说法中正确的是( )。 A.是否有电子转移 B.是否有元素化合价的变化 C.是否有氧元素的参加 D.是否有原子的重新组合 答案:A 解析:氧化还原反应的实质是有电子转移(包括电子得失和电子对偏移),而外部特 征是有元素化合价发生变化。只要有元素化合价升降的反应就是氧化还原反应, 与是否有氧元素参加无关。 2.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下,则下 列说法不正确的是( )。 (说明:一种小球代表一种元素的原子) A.图中的反应物都是化合物 B.该反应属于置换反应 C.该反应属于氧化还原反应 D.该反应一定符合质量守恒定律 答案:A 解析:该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的置 换反应,一定是氧化还原反应,所有化学反应都符合质量守恒定律。 3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影 部分的是( )。 A.Cl2+2KBr Br2+2KCl B.2NaHCO3 Na2CO3+H2O+CO2↑

C.4Fe(OH)2+O2+2H2C-4Fe(OH)3 D.2Na202+2CO2Na2CO3+O2 答案D 解析:图中阴影部分为氧化还原反应,但不属于四种基本反应类型,A项中反应为 置换反应:B项中反应是分解反应,且不属于氧化还原反应:C项中反应是化合反 应:D项中反应是氧化还原反应,但不属于四种基本反应类型。 4.下列反应中有一个反应与其他三个反应不同,则该反应是()。 A.SiO2+2NaOHNa2SiO3+H2O B.SO3+H2C-H2SO4 C.3NO2+H2C-2HNO3+NO D.NaOH+HCINaCl+H2O 答案:C 解析:A、B、D三项涉及的反应中均不存在元素化合价的变化,均不是氧化还原 反应:C项中反应是氧化还原反应。 5.下列反应中(未配平)肯定不正确的是( A.S+KOH-K2S0O3+K2S+H2O B.FeO+HNO:Fe(NO3)3+H2O C.Cu2O+H2SO.*CuSO4+Cu+H2O D.NH4NO→N2O+H2O 答案B 解析:氧化还原反应中必须同时存在元素化合价的升高与降低,B项中的反应只有 元素化合价的升高,无元素化合价的降低,因此一定不正确。 6.下列各氧化还原反应的化学方程式表示的电子转移情况正确的是()。 失去3×2e A.2KCIO, MnO: 2KC+3O2↑ △ 得到6e 失去4Xe B.MO+4HCI(浓)△ MnCL2+Cl2↑+2H2O 得到2c 失去2Xe C.Cl2+2NaOH-NaCl+NaClO+H2O 得到2Xe 失去5×e D.KCIO,+6HCIKCH+3C1++3H.O 得到5e 答案D
C.4Fe(OH)2+O2+2H2O 4Fe(OH)3 D.2Na2O2+2CO2 2Na2CO3+O2 答案:D 解析:图中阴影部分为氧化还原反应,但不属于四种基本反应类型,A 项中反应为 置换反应;B 项中反应是分解反应,且不属于氧化还原反应;C 项中反应是化合反 应;D 项中反应是氧化还原反应,但不属于四种基本反应类型。 4.下列反应中有一个反应与其他三个反应不同,则该反应是( )。 A.SiO2+2NaOH Na2SiO3+H2O B.SO3+H2O H2SO4 C.3NO2+H2O 2HNO3+NO D.NaOH+HCl NaCl+H2O 答案:C 解析:A、B、D 三项涉及的反应中均不存在元素化合价的变化,均不是氧化还原 反应;C 项中反应是氧化还原反应。 5.下列反应中(未配平)肯定不正确的是( )。 A.S+KOH K2SO3+K2S+H2O B.FeO+HNO3 Fe(NO3)3+H2O C.Cu2O+H2SO4 CuSO4+Cu+H2O D.NH4NO3 N2O+H2O 答案:B 解析:氧化还原反应中必须同时存在元素化合价的升高与降低,B 项中的反应只有 元素化合价的升高,无元素化合价的降低,因此一定不正确。 6.下列各氧化还原反应的化学方程式表示的电子转移情况正确的是( )。 A. B. C. D. 答案:D
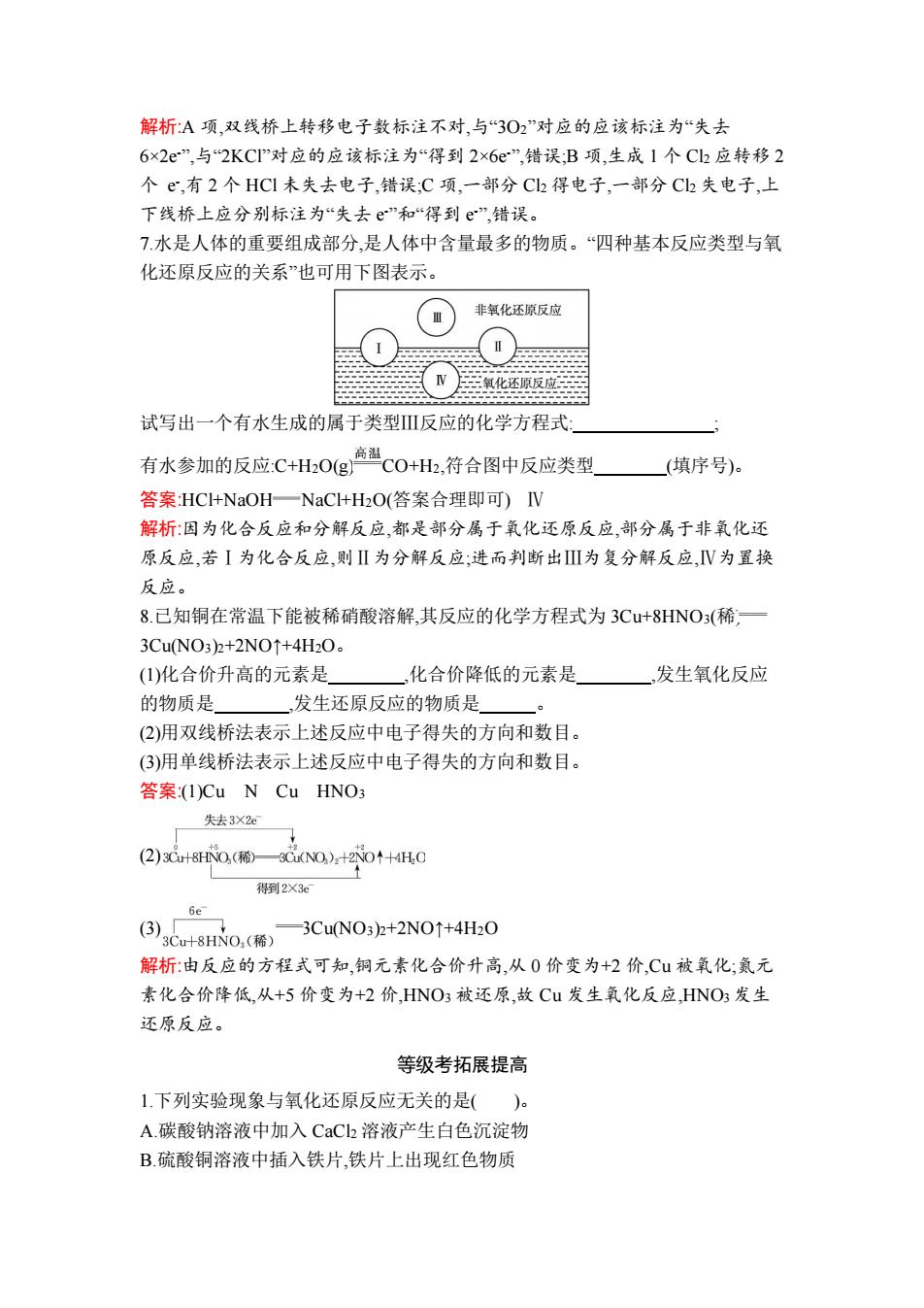
解析:A项,双线桥上转移电子数标注不对,与“3O2”对应的应该标注为“失去 6×2e”,与2KCI”对应的应该标注为“得到2×6e”,错误;B项,生成1个C2应转移2 个e,有2个HC1未失去电子,错误;C项,一部分C2得电子,一部分Ch失电子,上 下线桥上应分别标注为“失去e”和“得到e”,错误。 7水是人体的重要组成部分,是人体中含量最多的物质。“四种基本反应类型与氧 化还原反应的关系”也可用下图表示。 非氧化还原反应 N 氧化还原反应 试写出一个有水生成的属于类型Ⅲ反应的化学方程式: 有水参加的反应C+HO1g高温c0+H,符合图中反应类型 (填序号)。 答案:HC+NaOH一NaC+H2O(答案合理即可)IV 解析:因为化合反应和分解反应,都是部分属于氧化还原反应,部分属于非氧化还 原反应,若I为化合反应,则Ⅱ为分解反应:进而判断出Ⅲ为复分解反应,V为置换 反应。 8.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为3Cu+8HNO3(稀,一 3CuNO3)2+2NO↑+4H2O。 (1)化合价升高的元素是 化合价降低的元素是 ,发生氧化反应 的物质是 发生还原反应的物质是 (2)用双线桥法表示上述反应中电子得失的方向和数目。 (3)用单线桥法表示上述反应中电子得失的方向和数目。 答案(I)Cu N Cu HNO3 失去3×2e (2)3Cu8HNO(稀3C(NO)2+2NO↑+4HO 得到2X3e 6e (3),C+80.(稀 一3CuNO3)2+2NO↑+4H2O 解析:由反应的方程式可知,铜元素化合价升高,从0价变为+2价,Cu被氧化;氮元 素化合价降低,从+5价变为+2价,HNO3被还原,故Cu发生氧化反应,HNO3发生 还原反应。 等级考拓展提高 1.下列实验现象与氧化还原反应无关的是()。 A.碳酸钠溶液中加入CaCl2溶液产生白色沉淀物 B.硫酸铜溶液中插入铁片,铁片上出现红色物质
解析:A 项,双线桥上转移电子数标注不对,与“3O2”对应的应该标注为“失去 6×2e-”,与“2KCl”对应的应该标注为“得到 2×6e-”,错误;B 项,生成 1 个 Cl2 应转移 2 个 e - ,有 2 个 HCl 未失去电子,错误;C 项,一部分 Cl2 得电子,一部分 Cl2 失电子,上 下线桥上应分别标注为“失去 e -”和“得到 e -”,错误。 7.水是人体的重要组成部分,是人体中含量最多的物质。“四种基本反应类型与氧 化还原反应的关系”也可用下图表示。 试写出一个有水生成的属于类型Ⅲ反应的化学方程式: ; 有水参加的反应:C+H2O(g) CO+H2,符合图中反应类型 (填序号)。 答案:HCl+NaOH NaCl+H2O(答案合理即可) Ⅳ 解析:因为化合反应和分解反应,都是部分属于氧化还原反应,部分属于非氧化还 原反应,若Ⅰ为化合反应,则Ⅱ为分解反应;进而判断出Ⅲ为复分解反应,Ⅳ为置换 反应。 8.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为 3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O。 (1)化合价升高的元素是 ,化合价降低的元素是 ,发生氧化反应 的物质是 ,发生还原反应的物质是 。 (2)用双线桥法表示上述反应中电子得失的方向和数目。 (3)用单线桥法表示上述反应中电子得失的方向和数目。 答案:(1)Cu N Cu HNO3 (2) (3) 3Cu(NO3)2+2NO↑+4H2O 解析:由反应的方程式可知,铜元素化合价升高,从 0 价变为+2 价,Cu 被氧化;氮元 素化合价降低,从+5 价变为+2 价,HNO3 被还原,故 Cu 发生氧化反应,HNO3发生 还原反应。 等级考拓展提高 1.下列实验现象与氧化还原反应无关的是( )。 A.碳酸钠溶液中加入 CaCl2 溶液产生白色沉淀物 B.硫酸铜溶液中插入铁片,铁片上出现红色物质

C.甲烷燃烧产生使石灰水变浑浊的气体 D.铁在氧气中燃烧,剧烈反应,火星四射 答案:A 解析:A、B、C、D四项中发生反应的化学方程式分别为: A项,Na2CO3+CaC一CaCO3J+2NaCL B项,CuSO4+Fe一FeSO4+Cu C项,CH4+20.点然C02+2H0, D项,3Fe+20点“Fe;04。 通过分析元素化合价可知,A项中元素的化合价没有发生变化:B、C、D项中均 有元素的化合价发生变化,均属于氧化还原反应。 2(双选)实验室常利用反应NaNO2+NH4C△NaC+N2t+2H0制取少量的2,下 列关于该反应的说法正确的是( A.NaNO2发生氧化反应 B.生成1个N2时转移3个电子 C.NH4CI被还原 D.化合价升高和化合价降低的元素是同一种元素 答案BD Be- 解析:在反应NaNO,+NH,C△NaC+N2+2H0中,NaNO2发生还原反应:生成1个 N2,转移3个e:NH4CI中氨元素的化合价升高,NH4CI被氧化;化合价升高和化合 价降低的元素均为N。 3.下列对氧化还原反应的分析中,合理的是()。 A.由Mg→MgO时,镁元素的化合价升高,Mg失去电子,因此Mg在该反应中被 还原 B.KMnO4受热分解,Mn元素的化合价一部分升高,一部分降低,因此KMnO4既被 氧化又被还原 C.反应CuSO4+2NaOH一Cu(OH2J+Na2SO4不属于氧化还原反应 D.反应2H0电解2H↑+02↑中,压0中H元素的化合价既有升高,又有降低 答案:C 解析:A中,镁失去电子,被氧化,而不是被还原:B中,高锰酸钾中锰元素的化合价只 有降低,没有升高:C中,没有元素化合价的变化,不是氧化还原反应D中,氧元素的 化合价升高,氢元素的化合价降低,D项错误。 4.NH4)2Cr2O7是一种受热易分解的盐。下列各组对NH4)2Cr2O7受热分解产物的 判断,符合实际的是(
C.甲烷燃烧产生使石灰水变浑浊的气体 D.铁在氧气中燃烧,剧烈反应,火星四射 答案:A 解析:A、B、C、D 四项中发生反应的化学方程式分别为: A 项,Na2CO3+CaCl2 CaCO3↓+2NaCl; B 项,CuSO4+Fe FeSO4+Cu; C 项,CH4+2O2 CO2+2H2O; D 项,3Fe+2O2 Fe3O4。 通过分析元素化合价可知,A 项中元素的化合价没有发生变化;B、C、D 项中均 有元素的化合价发生变化,均属于氧化还原反应。 2.(双选)实验室常利用反应 NaNO2+NH4Cl NaCl+N2↑+2H2O 制取少量的 N2,下 列关于该反应的说法正确的是( )。 A.NaNO2 发生氧化反应 B.生成 1 个 N2 时转移 3 个电子 C.NH4Cl 被还原 D.化合价升高和化合价降低的元素是同一种元素 答案:BD 解析:在反应 NaCl+N2↑+2H2O 中,NaNO2发生还原反应;生成 1 个 N2,转移 3 个 e - ;NH4Cl 中氮元素的化合价升高,NH4Cl 被氧化;化合价升高和化合 价降低的元素均为 N。 3.下列对氧化还原反应的分析中,合理的是( )。 A.由 Mg MgO 时,镁元素的化合价升高,Mg 失去电子,因此 Mg 在该反应中被 还原 B.KMnO4 受热分解,Mn 元素的化合价一部分升高,一部分降低,因此 KMnO4 既被 氧化又被还原 C.反应 CuSO4+2NaOH Cu(OH)2↓+Na2SO4不属于氧化还原反应 D.反应 2H2O 2H2↑+O2↑中,H2O 中 H 元素的化合价既有升高,又有降低 答案:C 解析:A 中,镁失去电子,被氧化,而不是被还原;B 中,高锰酸钾中锰元素的化合价只 有降低,没有升高;C 中,没有元素化合价的变化,不是氧化还原反应;D 中,氧元素的 化合价升高,氢元素的化合价降低,D 项错误。 4.(NH4)2Cr2O7是一种受热易分解的盐。下列各组对(NH4)2Cr2O7受热分解产物的 判断,符合实际的是( )

A.CrO3+NH3+H2O B.Cr2O3+NH3+H2O C.Cro3+N2+H20 D.Cr2O3+N2+H2O 答案D 5.(双选)亚氨基锂(L2NH是一种储氢容量高、安全性好的固体储氢材料,其储氢 原理可表示为LiNH+H:一LNH2+LH。下列有关说法正确的是()。 A.Li2NH中N的化合价是-3价 B.该反应中化合价升高和化合价降低的元素都是氢 C该反应是非氧化还原反应 D.该反应中化合价升高的元素是氮,化合价降低的元素是氢 答案:AB 解析L2NH中氮元素的化合价为-3价,A项正确。该反应中H2中氢元素化合价 一部分变为+1价、一部分变为-1价,B项正确,D项错误。反应前后有元素化合 价发生了变化,该反应是氧化还原反应,C项错误。 挑战创新 二氧化氯(CIO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与C2 相比不会产生对人体有潜在危害的有机氯代物。制备CO2有下列两种方法: 方法一:2 NaCIO3+4HC一2C1O2↑+Cl2↑+2NaC1+2H20: 方法二:2 NaCIO3+H202+H2SO一2C1O2↑+O2↑+Na2SO4+2H20. (1)方法一的离子方程式为 (2)方法二中被氧化的物质是 若反应生成10个C1O2气体分子,则有 个电子转移 (3)用单线桥法标出下列反应中电子转移的方向和数目。 2 NaCIO3+H2O2+HSO,2ClO2↑+O2↑+Na2S04+2H0 答案:(1)2C105+4H+2C一2C1O2↑+Cl2↑+2H20 (2)H20210 2e (3)2NaCI0+H,0+H,S0,一2C102t+02↑+Na2S04+2H20 解析(1)方法一中的反应只有钠离子和一半的氯离子实际不参加反应,则离子方 程式为2C103+4H+2C一2C1O2↑+C2↑+2H20。 (2)2 NaCIO3+HO2+HSO.一2C1O2↑+O2↑+Na2SO4+2HO中,氧元素的化合价升 高,则H02被氧化,氯元素的化合价由+5价降低为+4价,即转移1个电子,生成1 个C1O2气体分子,则生成10个C1O2气体分子转移10个电子
A.CrO3+NH3+H2O B.Cr2O3+NH3+H2O C.CrO3+N2+H2O D.Cr2O3+N2+H2O 答案:D 5.(双选)亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢 原理可表示为 Li2NH+H2 LiNH2+ LiH。下列有关说法正确的是( )。 A.Li2NH 中 N 的化合价是-3 价 B.该反应中化合价升高和化合价降低的元素都是氢 C.该反应是非氧化还原反应 D.该反应中化合价升高的元素是氮,化合价降低的元素是氢 答案:AB 解析:Li2NH 中氮元素的化合价为-3 价,A 项正确。该反应中 H2 中氢元素化合价 一部分变为+1 价、一部分变为-1 价,B 项正确,D 项错误。反应前后有元素化合 价发生了变化,该反应是氧化还原反应,C 项错误。 挑战创新 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与 Cl2 相比不会产生对人体有潜在危害的有机氯代物。制备 ClO2 有下列两种方法: 方法一:2NaClO3+4HCl 2ClO2↑+Cl2↑+2NaCl+2H2O; 方法二:2NaClO3+H2O2+H2SO4 2ClO2↑+O2↑+Na2SO4+2H2O。 (1)方法一的离子方程式为 。 (2)方法二中被氧化的物质是 ,若反应生成 10 个 ClO2 气体分子,则有 个电子转移。 (3)用单线桥法标出下列反应中电子转移的方向和数目。 2NaClO3+H2O2+H2SO4 2ClO2↑+O2↑+Na2SO4+2H2O 答案:(1)2ClO3 - +4H++2Cl- 2ClO2↑+Cl2↑+2H2O (2)H2O2 10 (3) 2ClO2↑+O2↑+Na2SO4+2H2O 解析:(1)方法一中的反应只有钠离子和一半的氯离子实际不参加反应,则离子方 程式为 2ClO3 - +4H++2Cl- 2ClO2↑+Cl2↑+2H2O。 (2)2NaClO3+H2O2+H2SO4 2ClO2↑+O2↑+Na2SO4+2H2O 中,氧元素的化合价升 高,则 H2O2 被氧化,氯元素的化合价由+5 价降低为+4 价,即转移 1 个电子,生成 1 个 ClO2 气体分子,则生成 10 个 ClO2 气体分子转移 10 个电子