
全程设计 章末核心素养整合
章末核心素养整合

知识体系构建 专题归纳突破
知识体系构建 专题归纳突破
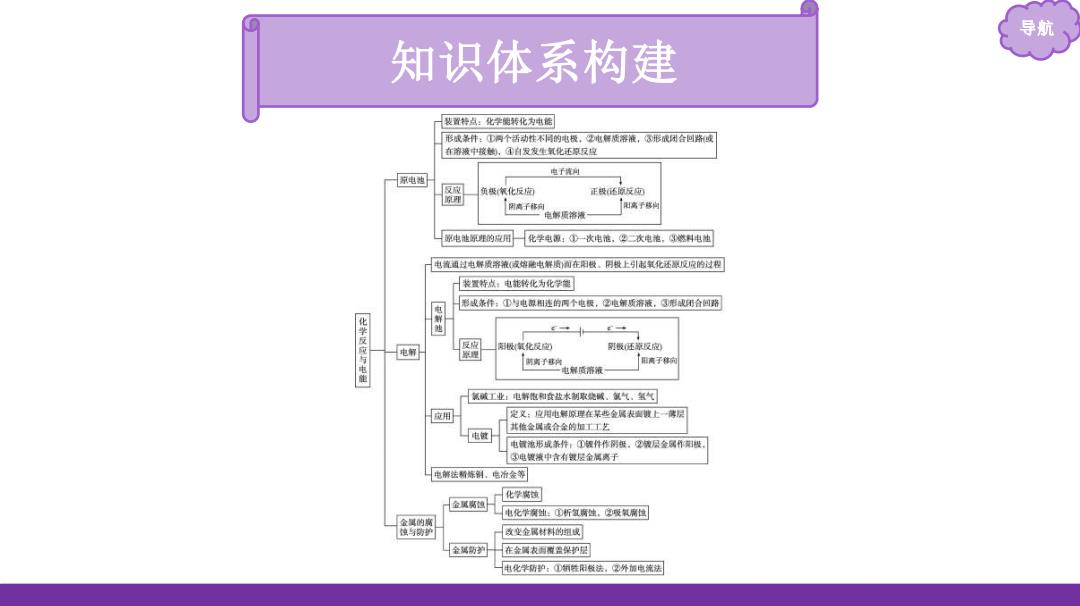
导航 知识体系构建 装置特点:化学衡转化为电能 形成教件:①网个话动性不同的电授,2电解被溶液,3形成闭合回路或 在游液中接的,①有发发生氧化还原反位 电子测 京电购 反议 负极氧化反面 正极还原反功 闲离千移向 阳离子球时 电解质溶液 家电非即炸的应用 化学电银:少一次电他,华二次电地,整料电迪 电瓷通过电解质溶液(发地他电解质南在阳做。阴做上引志氧化还原反成的过程 装置特点:电能转化为化学簧 彩或条作:①与电即相连的两个电极,2电第质溶液,③形成闭合回路 化学反应与电能 反应 电解 极氧化反包 射吸旺反应 理 时离子 电解质溶液 氟碱工业:电解胞和食盐术制取绕碱.复气。氢气 应用 定义:应用电解原理在某些金属表壶黄上薄层 其临金属成合金的加丁艺 电皱 电置池形城条件:①极件作阴报,2液层金属作樱 小电复被中含有银层金阔离于 电解法制,电金等 化学衡黄 金风喇恒 电化学询出:①新氢斯蚀,吸氧璃位 金属的 改变金风材料的组或 在金属表脚程盘保护归 电化学斯的:D箱性阳敏法,2外馆电流法
导航 知识体系构建

导航 专题归纳突破 专题一新型化学电源的试题分析 1.新型电池“放电“充电”时电极反应式的正误判断。 (1)新型电池放电。 ①若给出新型电池的装置图:先找出电池的正、负极,即找 出氧化剂和还原剂;再结合电解质确定出还原产物和氧化产 物:最后判断相应的电极反应式的正误
导航 专题一 新型化学电源的试题分析 1.新型电池“放电”“充电”时电极反应式的正误判断。 (1)新型电池放电。 ①若给出新型电池的装置图:先找出电池的正、负极,即找 出氧化剂和还原剂;再结合电解质确定出还原产物和氧化产 物;最后判断相应的电极反应式的正误。 专题归纳突破

②若给出新型电池的总反应式:分析总反应式中各元素化合 价的变化情况,找出氧化剂及其对应的还原产物,还原剂及其 对应的氧化产物,最后考虑电解质是否参加反应,判断电极反 应式的正误。 (2)新型电池充电。 ①充电时阴极的电极反应式是该电池放电时的负极反应式 的“逆反应”。 ②充电时阳极的电极反应式是该电池放电时的正极反应式 的“逆反应
导航 ②若给出新型电池的总反应式:分析总反应式中各元素化合 价的变化情况,找出氧化剂及其对应的还原产物,还原剂及其 对应的氧化产物,最后考虑电解质是否参加反应,判断电极反 应式的正误。 (2)新型电池充电。 ①充电时阴极的电极反应式是该电池放电时的负极反应式 的“逆反应” 。 ②充电时阳极的电极反应式是该电池放电时的正极反应式 的“逆反应”

导 2.有关计算的根本依据就是电子得失守恒。 上图中,装置甲是原电池,装置乙是电 解池,若电路中有0.2mol电子转移,测 Zn 石墨 Zn溶解6.5g,Cu电极上析出H22.24L (标准状况),Pt电极上析出Cl20.1mol, 稀硫酸 CuCl2 溶液 石墨电极上析出Cu6.4g。甲池中H中 被还原,产生H,负极Zn被氧化生成ZnSO4,溶液pH变大;乙池 中是电解CuCL,溶液,电解后再加入适量CuCL,固体可使溶液 复原
导航 2.有关计算的根本依据就是电子得失守恒。 上图中,装置甲是原电池,装置乙是电 解池,若电路中有0.2 mol电子转移,则 Zn溶解6.5 g,Cu电极上析出H2 2.24 L (标准状况),Pt电极上析出Cl2 0.1 mol, 石墨电极上析出Cu 6.4 g。甲池中H+ 被还原,产生H2 ,负极Zn被氧化生成ZnSO4 ,溶液pH变大;乙池 中是电解CuCl2溶液,电解后再加入适量CuCl2固体可使溶液 复原
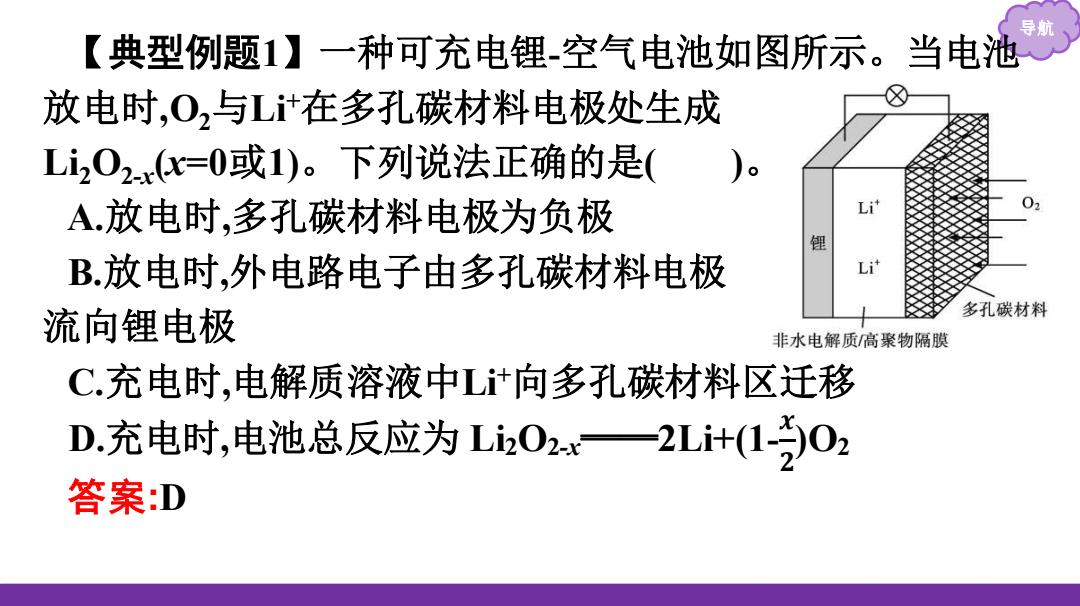
导 【典型例题1】一种可充电锂-空气电池如图所示。当电池 放电时,0,与L计在多孔碳材料电极处生成 L202.x(x=0或1)。下列说法正确的是( A.放电时,多孔碳材料电极为负极 L 锂 B.放电时,外电路电子由多孔碳材料电极 流向锂电极 多孔碳材料 非水电解质高聚物隔膜 C充电时,电解质溶液中L计向多孔碳材料区迁移 D.充电时,电池总反应为L02一2Li+(1-02 答案:D
导航 答案:D 【典型例题1】一种可充电锂-空气电池如图所示。当电池 放电时,O2与Li+在多孔碳材料电极处生成 Li2O2-x (x=0或1)。下列说法正确的是( )。 A.放电时,多孔碳材料电极为负极 B.放电时,外电路电子由多孔碳材料电极 流向锂电极 C.充电时,电解质溶液中Li+向多孔碳材料区迁移 D.充电时,电池总反应为 Li2O2-x ══2Li+(1- 𝒙 𝟐 )O2

导 解析:放电时,该电池中锂作负极,多孔碳材料作正极,A项错 误;放电时,外电路电子由负极流向正极,即由锂电极流向多孔 碳材料电极,B项错误;充电时,锂电极作阴极,多孔碳材料电极 作阳极,电解质溶液中L计应向锂电极区移动,C项错误;充电反 应与放电反应相反:Li202.x一2Li+(1-2)02,D项正确
导航 解析:放电时,该电池中锂作负极,多孔碳材料作正极,A项错 误;放电时,外电路电子由负极流向正极,即由锂电极流向多孔 碳材料电极,B项错误;充电时,锂电极作阴极,多孔碳材料电极 作阳极,电解质溶液中Li+应向锂电极区移动,C项错误;充电反 应与放电反应相反:Li2O2-x ══2Li+(1- )O2 ,D项正确。 𝒙 𝟐

专题二电解原理及其应用 1.电解池中电极反应式的书写规律。 电解池中电极反应式的书写关键是掌握离子的放电顺序。 (1)阴极与电源负极相连,得电子发生还原反应。其规律有 两个:一是电极本身不参加反应;二是电解质溶液中氧化性强 的阳离子先得电子,如 Ag>Fe3+>Cu2+>HH>Pb2+>Sn2+>Fe2+>Zn2+,要注意金属活动 性顺序中铝及铝前面的金属离子在水溶液中不放电
导航 专题二 电解原理及其应用 1.电解池中电极反应式的书写规律。 电解池中电极反应式的书写关键是掌握离子的放电顺序。 (1)阴极与电源负极相连,得电子发生还原反应。其规律有 两个:一是电极本身不参加反应;二是电解质溶液中氧化性强 的阳离子先得电子,如 Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+ ,要注意金属活动 性顺序中铝及铝前面的金属离子在水溶液中不放电

导 (2)阳极与电源正极相连,失去电子发生氧化反应。其规律 有两个:一是若阳极为非惰性电极(除铂、金之外的金属作电 极),电极本身失去电子被氧化,电解质溶液中的阴离子不参与 电极反应;二是若阳极为惰性电极(铂、金或非金属作电极), 电解质溶液中还原性强的阴离子失去电子被氧化,如$2-> >Br>C>OH>含氧酸根
导航 (2)阳极与电源正极相连,失去电子发生氧化反应。其规律 有两个:一是若阳极为非惰性电极(除铂、金之外的金属作电 极),电极本身失去电子被氧化,电解质溶液中的阴离子不参与 电极反应;二是若阳极为惰性电极(铂、金或非金属作电极), 电解质溶液中还原性强的阴离子失去电子被氧化,如S 2->I- >Br->Cl->OH->含氧酸根