
全程设计 第一节 电离平衡
第一节 电离平衡

素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练
素养·目标定位 课前·基础认知 课堂·重难突破 随堂训练

导航 素养·目标定位 目标素养 1.理解电解质、强电解质及弱电解质的概念。 2.认识弱电解质在水溶液中的电离平衡及其影响因素。 3.熟练书写强、弱电解质在水溶液中的电离方程式。 4.了解电离平衡常数的含义
导航 1.理解电解质、强电解质及弱电解质的概念。 2.认识弱电解质在水溶液中的电离平衡及其影响因素。 3.熟练书写强、弱电解质在水溶液中的电离方程式。 4.了解电离平衡常数的含义。 素养·目标定位 目 标 素 养
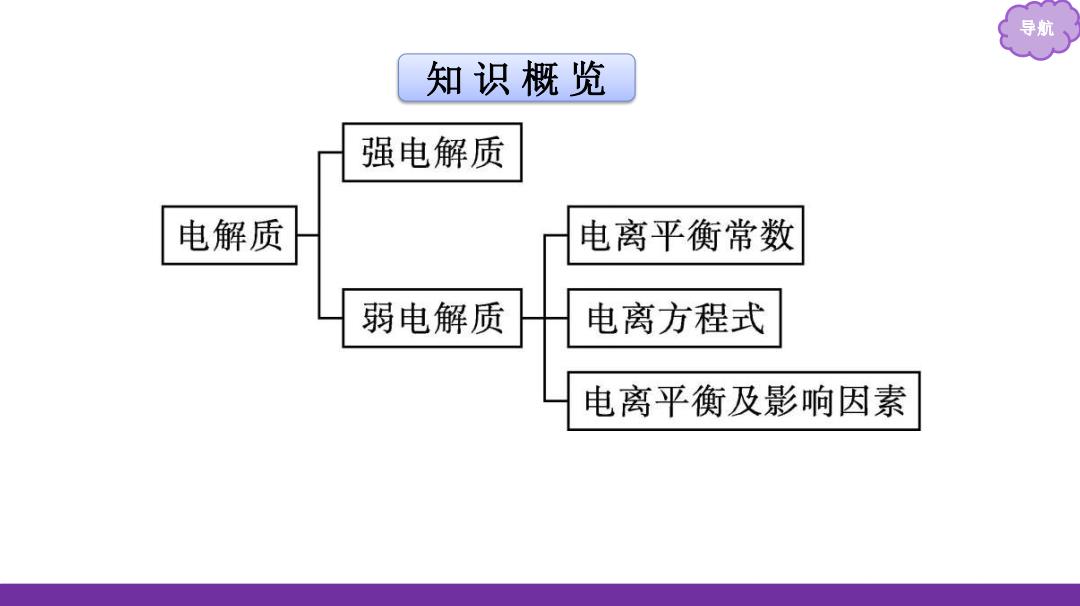
导航 知识概览 强电解质 电解质 电离平衡常数 弱电解质 电离方程式 电离平衡及影响因素
导航 知 识 概 览
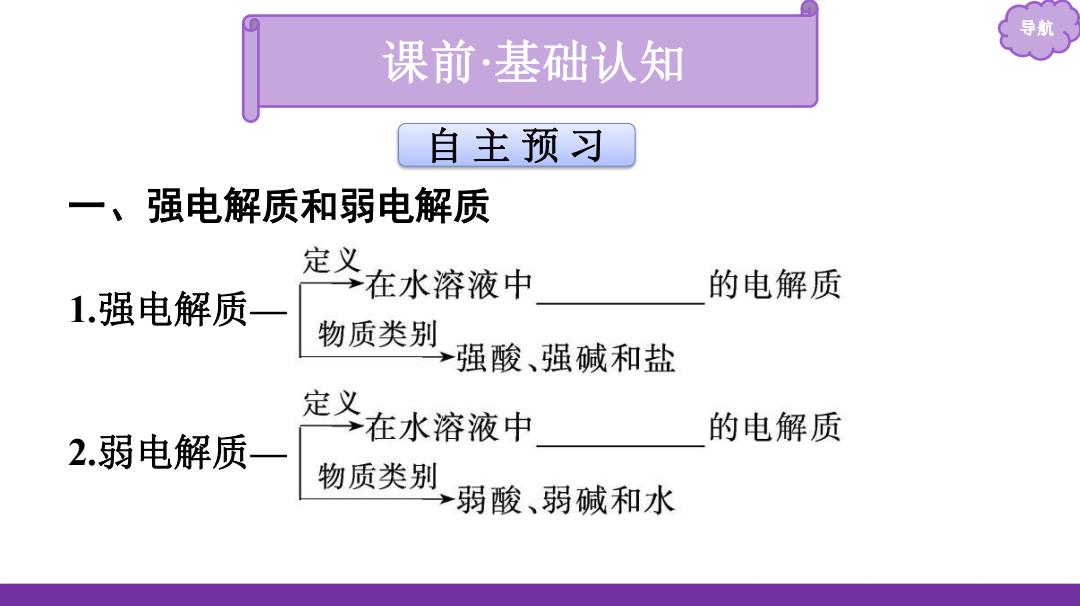
导航 课前·基础认知 自主预习 一、强电解质和弱电解质 定义 在水溶液中 的电解质 1.强电解质一 物质类别 强酸、强碱和盐 定义 在水溶液中 的电解质 2.弱电解质一 物质类别 弱酸、弱碱和水
导航 一、强电解质和弱电解质 1.强电解质— 2.弱电解质— 自 主 预 习 课前 ·基础认知

微思考1S02的水溶液能导电,S02是电解质吗? 提示:S02不是电解质,S02与H20反应生成电解质HS03,类 似的还有CO2、SO3、NH等。 微思考2CaCO3的水溶液比CH,COOH溶液的导电性 弱,CaCO3为弱电解质、CH3COOH为强电解质,对吗? 提示:不对,电解质强弱与电离程度有关,CC03为强电解 质,CH,COOH为弱电解质
导航 微思考1SO2的水溶液能导电,SO2是电解质吗? 提示:SO2不是电解质,SO2与H2O反应生成电解质H2SO3 ,类 似的还有CO2、SO3、NH3等。 微思考2CaCO3的水溶液比CH3COOH溶液的导电性 弱,CaCO3为弱电解质、CH3COOH为强电解质,对吗? 提示:不对,电解质强弱与电离程度有关,CaCO3为强电解 质,CH3COOH为弱电解质

二、弱电解质的电离平衡 导 1.弱电解质的电离平衡。 在一定条件下(如温度和浓度),弱电解质电离成离子的速率 和离子结合成分子的速率 时,电离过程达到电离平 衡状态。 速率 弱电解质分} 2.弱电解质电离平衡 子电离成离 子的速率 的建立。 两种速率相等, 处于电离平衡状态 →特征 逆等动定变 离子结合成 弱电解质分 子的速率 h 时间
二、弱电解质的电离平衡 导航 1.弱电解质的电离平衡。 在一定条件下(如温度和浓度),弱电解质电离成离子的速率 和离子结合成分子的速率 相等 时,电离过程达到电离平 衡状态。 2.弱电解质电离平衡 的建立
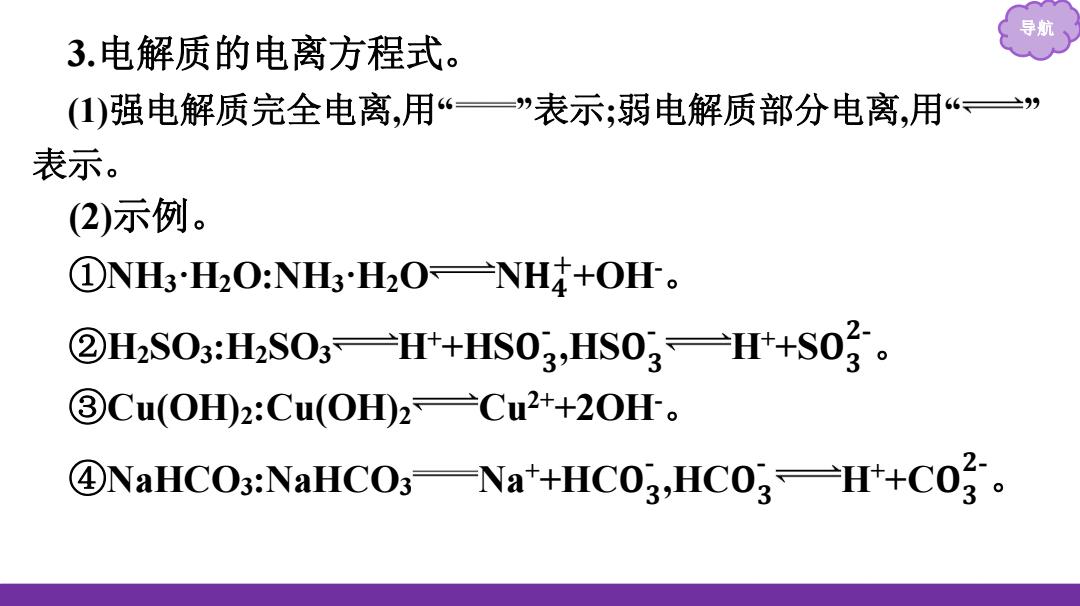
3.电解质的电离方程式。 (1)强电解质完全电离,用“一”表示;弱电解质部分电离,用“三 表示。 (2)示例。 ①NH3H2O:NH3H2O=NH4+OH。 ②H2S03:H2S03Ht+HS03,HS03=H+S03。 ③Cu(OHD2:Cu(OH2=Cu2++2OH。 ④NaHCO3:NaHCO3一Na*+HCO3,HCO3一Ht+Co?
导航 3.电解质的电离方程式 。 (1)强电解质完全电离,用 “ ”表示;弱电解质部分电离,用 “ ” 表示。 (2)示例。 ①NH3·H 2O:NH 3·H 2 O N 𝐇 𝟒+ +OH-。 ②H2SO3:H2SO3 H+ +HS 𝐎 𝟑- ,HS 𝐎 𝟑- H + +S 𝐎 𝟑𝟐-。 ③Cu(OH)2:Cu(OH)2 Cu2++2OH-。 ④NaHCO3:NaHCO3 Na+ +HC 𝐎 𝟑- ,HC 𝐎 𝟑- H + +C 𝐎 𝟑𝟐-

导航 4.电离平衡的影响因素。 影响因素 电离程度 原因 ① 决 内因 结构决定性质 定电解质的电离程度 温度(升温) ② 电离过程是吸热的 外 浓度减小,离子结合 因 浓度(减小) ③ 生成弱电解质分子 的速率小
导航 4.电离平衡的影响因素 。 影响因素 电离程度 原因 内因 ① 弱电解质的性质 决 定电解质的电离程度 结构决定性质 外因 温度(升温) ② 增大 电离过程是吸热的 浓度(减小) ③ 增大 浓度减小,离子结合 生成弱电解质分子 的速率小
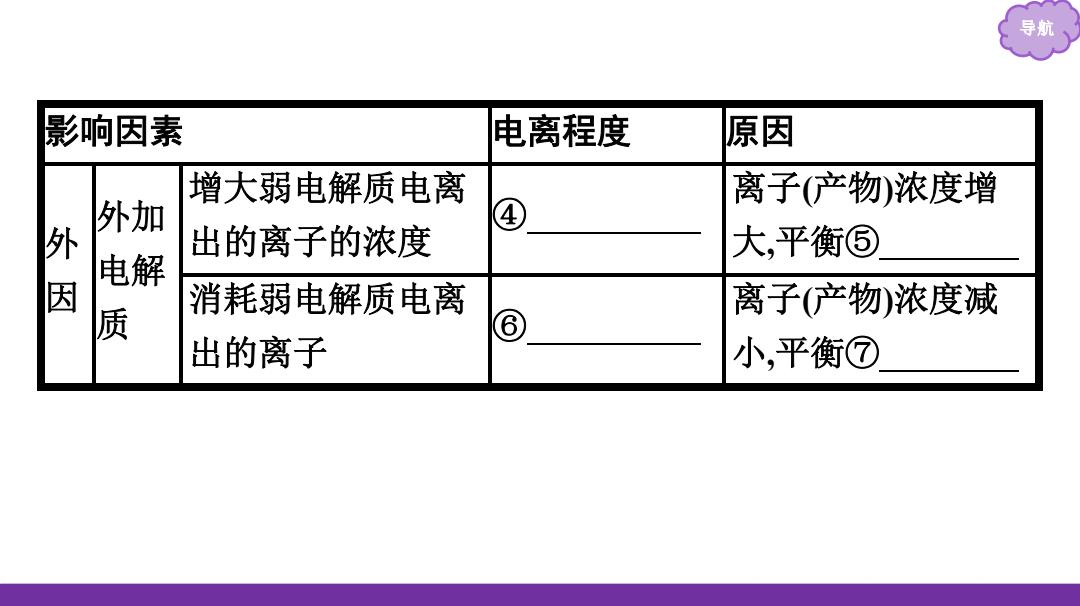
导航 影响因素 电离程度 原因 增大弱电解质电离 离子(产物浓度增 外加 ④ 外 出的离子的浓度 大,平衡⑤ 电解 因 消耗弱电解质电离 离子(产物浓度减 ⑧ 出的离子 小,平衡⑦
导航 影响因素 电离程度 原因 外 因 外加 电解 质 增大弱电解质电离 出的离子的浓度 ④ 减小 离子(产物)浓度增 大,平衡⑤ 左移 消耗弱电解质电离 出的离子 ⑥ 增大 离子(产物)浓度减 小,平衡⑦ 右移