
第十二章 食品中维生素的测定 【教学目标】: 1.掌握维生素的概念,各种维生素的性质及生理功能和相关知识; 2.了解各类维生素的检测方法,熟练地掌握分光光度计的操作技能。 维生素是人体必需的一类有机营养素。它们的化学组成相互之间差异很大,但对于其 他营养素在体内的正常代谢都起着不可缺少的催化作用。维生素一般不能在体内合成,而 必须从食物中摄取。根据其溶解性,习惯上将维生素分为两大类:一类为脂溶性维生素, 主要包括维生素 A、维生素 D 和维生素 E:一类为水溶性维生素,主要包括 B 族维生素 和维生素 C(即抗坏血酸)。 一、脂溶性维生素的标准测定方法 (一)胡萝卜素的纸层析法(GB12389-90) 本方法适用于植物性食物和含有植物性食物的混合食物中胡萝卜素的测定,其最小检 出限为 0.11μL。 1.原理 以丙酮和石油醚提取食物中的胡萝卜素及其他植物色素;以石油醚为展开剂进行纸层 析,胡萝卜素极性最小,移动速度最快,从而与其他色素分离;剪下含胡萝卜素的区带、 洗脱后于 450nm 波长下定量测定。 2、试剂 (1)石油醚(沸程 30~60℃):同时是展开剂。 (2)丙酮:分析纯。 (3)丙酮+石油醚(3:7)(v/v)。 (4)无水硫酸钠:分析纯。 (5)5% 硫酸钠溶液。 (6)1:1 氢氧化钾溶液:取 50g 氢氧化钾,溶于 50mL 水。 (7)无水乙醇:需经脱醛处理。 (8)β-胡萝卜素标准溶液:取 5mgβ-胡萝卜素标准品,溶于 10ml 三氯甲烷中,浓度约 为 500μg/mL,准确测其浓度。 取标准溶液 10.0μL,加正已烷 3.00ml,混匀,测吸光值,比色杯厚度 1cm,以正 已烷为空白,入射光波长 450nm,平行测定三分,取均值。 计算分式: .(3 21) 0.01 3.01 1000 1 1 = − E A X 式中: X1 -胡萝卜素标准溶液浓度,mg/mL; A-吸光值; E-β-胡萝卜素在正已烷溶液中,入射光波长 450nm,比色杯厚度为 1cm, 溶液浓度为 1μg/ml 的吸光系数,为 0.2638; 1000 1 -将μg/ml 换算成 mg/ml; 0.01 3.01 -测定过程中稀释倍数的换算; (1) β-胡萝卜素标准使用液;将已标定的标准液用石油醚准确稀释后,每毫升溶 液相当 50μg.避光保存于冰箱中。 3.仪器和设备 (1)实验室常用设备。 (2)玻璃层析缸。 (3)分光光度计
第十二章 食品中维生素的测定 【教学目标】: 1.掌握维生素的概念,各种维生素的性质及生理功能和相关知识; 2.了解各类维生素的检测方法,熟练地掌握分光光度计的操作技能。 维生素是人体必需的一类有机营养素。它们的化学组成相互之间差异很大,但对于其 他营养素在体内的正常代谢都起着不可缺少的催化作用。维生素一般不能在体内合成,而 必须从食物中摄取。根据其溶解性,习惯上将维生素分为两大类:一类为脂溶性维生素, 主要包括维生素 A、维生素 D 和维生素 E:一类为水溶性维生素,主要包括 B 族维生素 和维生素 C(即抗坏血酸)。 一、脂溶性维生素的标准测定方法 (一)胡萝卜素的纸层析法(GB12389-90) 本方法适用于植物性食物和含有植物性食物的混合食物中胡萝卜素的测定,其最小检 出限为 0.11μL。 1.原理 以丙酮和石油醚提取食物中的胡萝卜素及其他植物色素;以石油醚为展开剂进行纸层 析,胡萝卜素极性最小,移动速度最快,从而与其他色素分离;剪下含胡萝卜素的区带、 洗脱后于 450nm 波长下定量测定。 2、试剂 (1)石油醚(沸程 30~60℃):同时是展开剂。 (2)丙酮:分析纯。 (3)丙酮+石油醚(3:7)(v/v)。 (4)无水硫酸钠:分析纯。 (5)5% 硫酸钠溶液。 (6)1:1 氢氧化钾溶液:取 50g 氢氧化钾,溶于 50mL 水。 (7)无水乙醇:需经脱醛处理。 (8)β-胡萝卜素标准溶液:取 5mgβ-胡萝卜素标准品,溶于 10ml 三氯甲烷中,浓度约 为 500μg/mL,准确测其浓度。 取标准溶液 10.0μL,加正已烷 3.00ml,混匀,测吸光值,比色杯厚度 1cm,以正 已烷为空白,入射光波长 450nm,平行测定三分,取均值。 计算分式: .(3 21) 0.01 3.01 1000 1 1 = − E A X 式中: X1 -胡萝卜素标准溶液浓度,mg/mL; A-吸光值; E-β-胡萝卜素在正已烷溶液中,入射光波长 450nm,比色杯厚度为 1cm, 溶液浓度为 1μg/ml 的吸光系数,为 0.2638; 1000 1 -将μg/ml 换算成 mg/ml; 0.01 3.01 -测定过程中稀释倍数的换算; (1) β-胡萝卜素标准使用液;将已标定的标准液用石油醚准确稀释后,每毫升溶 液相当 50μg.避光保存于冰箱中。 3.仪器和设备 (1)实验室常用设备。 (2)玻璃层析缸。 (3)分光光度计

(4)旋转蒸发器,具 150mL 球形瓶。 (5)恒温水浴锅。 (6)皂化回馏装置。 (7)点样器或微量注射器。 (8)新华滤纸:定性,快速或中速,101 号。 4.样品的采集和处理 (1)粮食:样品用水洗三次,置 60℃烤箱中烤干,磨粉,贮于塑料瓶内,放一小包樟脑 精,盖紧瓶塞保存,备用。 (2)蔬菜与其他植物性食物:取可食部用水冲洗三次后,用纱布吸去水滴,切碎,用匀浆 器制成匀浆,贮于塑料瓶内,冰箱内保存备用。 5.测定步骤(以下步骤需在避光条件下进行) (1)样品提取 ①取适量样品,相当于原样 1-5g(含胡萝卜素约 20-80μg)的匀浆,粮食样品视其胡萝 卜素含量而定,置 100mL,带塞锥形瓶中,加入丙酮 20mL,石油醚 5mL,振摇 1min,静置 5min,将提取液转入盛有 100mL5% 硫酸钠溶液的分液漏斗中,再与锥形瓶中,加入 10mL, 丙酮+石油醚混合液,振摇 1min,静置 5min,将提取液并入分液漏斗中。如此提取 2-3 次,直至提取液无色为止。 ②植物油和高脂肪样品,需先皂化,取适量样品(小于 10g),加脱醛乙醇 30mL 再加 10mL1: 1,氢氧化钾溶液,回流加热 30min,然后用冰水使之迅速冷却,皂化后样品用石油醚提取, 直至提取液无色为止。 (2)洗涤 ①将提取液[5.(1)①] 静置分层,弃去下层水溶液,反复用 5% 硫酸钠溶液振摇洗涤, 每次约 15mL,直至下层水溶液清亮为止。 ②将皂化后样品提取液[5.(1)②]用水洗涤至中性。 ③将①或②的石油醚提取液通过盛有 10g 无水硫酸钠的小漏斗,漏入球形瓶,用少量石油 醚分数次洗净分液漏斗和无水硫酸钠层内的色素,洗涤液并入球形瓶内。 (3)浓缩与定容 将上述球形瓶内的提取液于旋转蒸发器上减压蒸发,水浴温度为 60℃,蒸发至约 1ml 时,取下球形瓶,用氮气吹干产即加入 2.00mL 石油醚定容,备层析用。 (4)纸层析 ①点样:在 18cm×30cm 滤纸下端距底边 4cm 处作一基线,在基线取 A、B、C、D 四点(如 图 3-8 所示),吸取 0.100-0.400mL 浓缩液[5.(3)] 在 AB 和 CD 间迅速点样. 图 3-8 ②展开:待纸上所点样液自然挥发干后,将滤纸卷为圆筒状,置于预先用石油醚饱和的层 析缸中,进行上行展开。 ③洗脱:待胡萝卜素与其他色素完全分开后,取出滤纸,自然挥发干石油醚,将位于展开 剂前沿的胡萝卜素层析带剪下,产即放入盛有 5mL 石油醚的具塞试管中,用力振摇,使胡 萝卜素完全溶于溶剂中。 (5)比色测定 用 1cm 比色杯,以石油醚调节零点,于 450nm 波长下测吸光度,以其值从标准曲线上
(4)旋转蒸发器,具 150mL 球形瓶。 (5)恒温水浴锅。 (6)皂化回馏装置。 (7)点样器或微量注射器。 (8)新华滤纸:定性,快速或中速,101 号。 4.样品的采集和处理 (1)粮食:样品用水洗三次,置 60℃烤箱中烤干,磨粉,贮于塑料瓶内,放一小包樟脑 精,盖紧瓶塞保存,备用。 (2)蔬菜与其他植物性食物:取可食部用水冲洗三次后,用纱布吸去水滴,切碎,用匀浆 器制成匀浆,贮于塑料瓶内,冰箱内保存备用。 5.测定步骤(以下步骤需在避光条件下进行) (1)样品提取 ①取适量样品,相当于原样 1-5g(含胡萝卜素约 20-80μg)的匀浆,粮食样品视其胡萝 卜素含量而定,置 100mL,带塞锥形瓶中,加入丙酮 20mL,石油醚 5mL,振摇 1min,静置 5min,将提取液转入盛有 100mL5% 硫酸钠溶液的分液漏斗中,再与锥形瓶中,加入 10mL, 丙酮+石油醚混合液,振摇 1min,静置 5min,将提取液并入分液漏斗中。如此提取 2-3 次,直至提取液无色为止。 ②植物油和高脂肪样品,需先皂化,取适量样品(小于 10g),加脱醛乙醇 30mL 再加 10mL1: 1,氢氧化钾溶液,回流加热 30min,然后用冰水使之迅速冷却,皂化后样品用石油醚提取, 直至提取液无色为止。 (2)洗涤 ①将提取液[5.(1)①] 静置分层,弃去下层水溶液,反复用 5% 硫酸钠溶液振摇洗涤, 每次约 15mL,直至下层水溶液清亮为止。 ②将皂化后样品提取液[5.(1)②]用水洗涤至中性。 ③将①或②的石油醚提取液通过盛有 10g 无水硫酸钠的小漏斗,漏入球形瓶,用少量石油 醚分数次洗净分液漏斗和无水硫酸钠层内的色素,洗涤液并入球形瓶内。 (3)浓缩与定容 将上述球形瓶内的提取液于旋转蒸发器上减压蒸发,水浴温度为 60℃,蒸发至约 1ml 时,取下球形瓶,用氮气吹干产即加入 2.00mL 石油醚定容,备层析用。 (4)纸层析 ①点样:在 18cm×30cm 滤纸下端距底边 4cm 处作一基线,在基线取 A、B、C、D 四点(如 图 3-8 所示),吸取 0.100-0.400mL 浓缩液[5.(3)] 在 AB 和 CD 间迅速点样. 图 3-8 ②展开:待纸上所点样液自然挥发干后,将滤纸卷为圆筒状,置于预先用石油醚饱和的层 析缸中,进行上行展开。 ③洗脱:待胡萝卜素与其他色素完全分开后,取出滤纸,自然挥发干石油醚,将位于展开 剂前沿的胡萝卜素层析带剪下,产即放入盛有 5mL 石油醚的具塞试管中,用力振摇,使胡 萝卜素完全溶于溶剂中。 (5)比色测定 用 1cm 比色杯,以石油醚调节零点,于 450nm 波长下测吸光度,以其值从标准曲线上
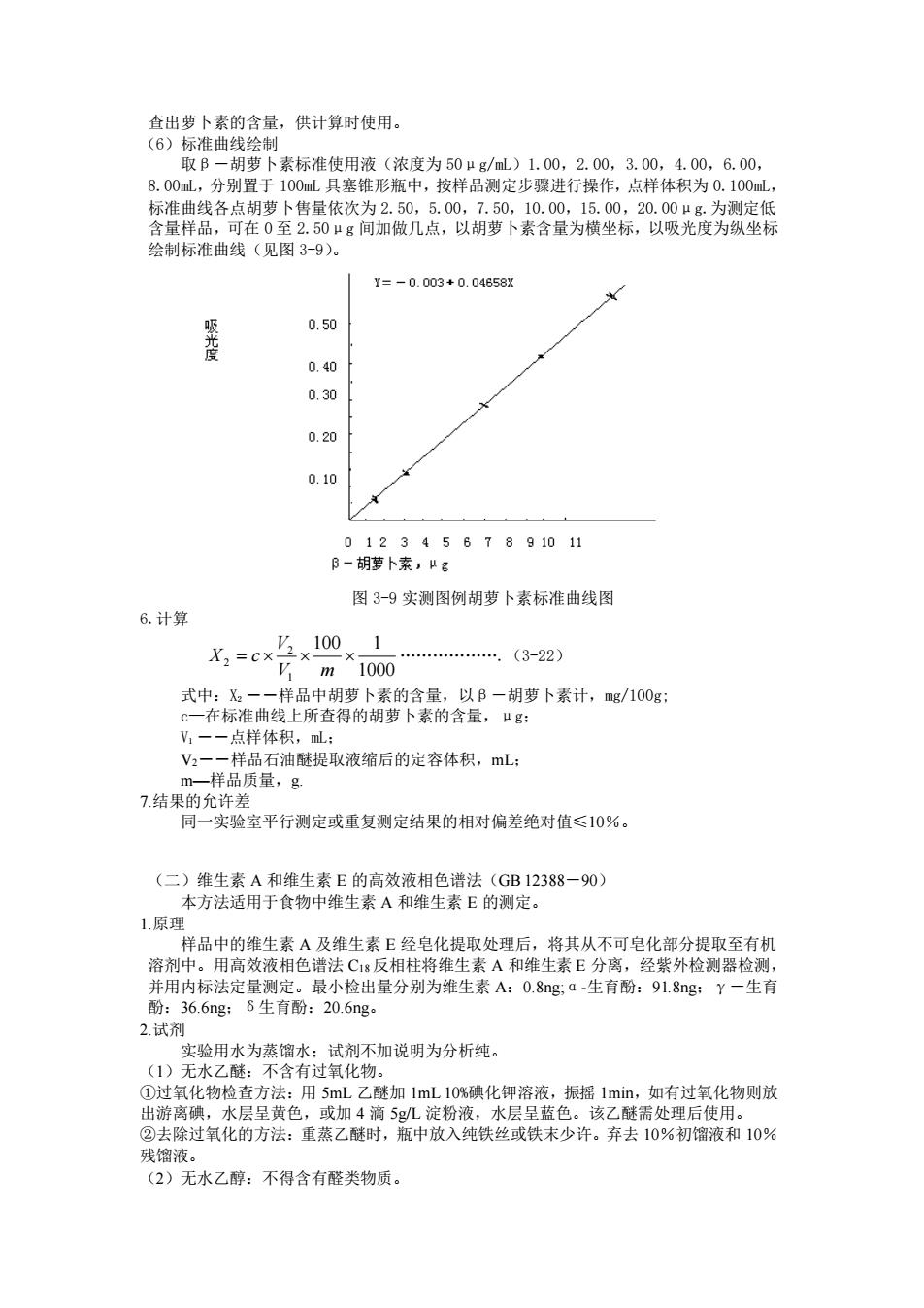
查出萝卜素的含量,供计算时使用。 (6)标准曲线绘制 取β-胡萝卜素标准使用液(浓度为 50μg/mL)1.00,2.00,3.00,4.00,6.00, 8.00mL,分别置于 100mL 具塞锥形瓶中,按样品测定步骤进行操作,点样体积为 0.100mL, 标准曲线各点胡萝卜售量依次为 2.50,5.00,7.50,10.00,15.00,20.00μg.为测定低 含量样品,可在 0 至 2.50μg 间加做几点,以胡萝卜素含量为横坐标,以吸光度为纵坐标 绘制标准曲线(见图 3-9)。 图 3-9 实测图例胡萝卜素标准曲线图 6.计算 1000 100 1 1 2 2 = V m V X c .(3-22) 式中:X2 ――样品中胡萝卜素的含量,以β-胡萝卜素计,mg/100g; c—在标准曲线上所查得的胡萝卜素的含量,μg; V1 ――点样体积,mL; V2――样品石油醚提取液缩后的定容体积,mL; m—样品质量,g. 7.结果的允许差 同一实验室平行测定或重复测定结果的相对偏差绝对值≤10%。 (二)维生素 A 和维生素 E 的高效液相色谱法(GB 12388-90) 本方法适用于食物中维生素 A 和维生素 E 的测定。 1.原理 样品中的维生素 A 及维生素 E 经皂化提取处理后,将其从不可皂化部分提取至有机 溶剂中。用高效液相色谱法 C18 反相柱将维生素 A 和维生素 E 分离,经紫外检测器检测, 并用内标法定量测定。最小检出量分别为维生素 A:0.8ng;α-生育酚:91.8ng;γ-生育 酚:36.6ng;δ生育酚:20.6ng。 2.试剂 实验用水为蒸馏水;试剂不加说明为分析纯。 (1)无水乙醚:不含有过氧化物。 ①过氧化物检查方法:用 5mL 乙醚加 1mL 10%碘化钾溶液,振摇 1min,如有过氧化物则放 出游离碘,水层呈黄色,或加 4 滴 5g/L 淀粉液,水层呈蓝色。该乙醚需处理后使用。 ②去除过氧化的方法:重蒸乙醚时,瓶中放入纯铁丝或铁末少许。弃去 10%初馏液和 10% 残馏液。 (2)无水乙醇:不得含有醛类物质
查出萝卜素的含量,供计算时使用。 (6)标准曲线绘制 取β-胡萝卜素标准使用液(浓度为 50μg/mL)1.00,2.00,3.00,4.00,6.00, 8.00mL,分别置于 100mL 具塞锥形瓶中,按样品测定步骤进行操作,点样体积为 0.100mL, 标准曲线各点胡萝卜售量依次为 2.50,5.00,7.50,10.00,15.00,20.00μg.为测定低 含量样品,可在 0 至 2.50μg 间加做几点,以胡萝卜素含量为横坐标,以吸光度为纵坐标 绘制标准曲线(见图 3-9)。 图 3-9 实测图例胡萝卜素标准曲线图 6.计算 1000 100 1 1 2 2 = V m V X c .(3-22) 式中:X2 ――样品中胡萝卜素的含量,以β-胡萝卜素计,mg/100g; c—在标准曲线上所查得的胡萝卜素的含量,μg; V1 ――点样体积,mL; V2――样品石油醚提取液缩后的定容体积,mL; m—样品质量,g. 7.结果的允许差 同一实验室平行测定或重复测定结果的相对偏差绝对值≤10%。 (二)维生素 A 和维生素 E 的高效液相色谱法(GB 12388-90) 本方法适用于食物中维生素 A 和维生素 E 的测定。 1.原理 样品中的维生素 A 及维生素 E 经皂化提取处理后,将其从不可皂化部分提取至有机 溶剂中。用高效液相色谱法 C18 反相柱将维生素 A 和维生素 E 分离,经紫外检测器检测, 并用内标法定量测定。最小检出量分别为维生素 A:0.8ng;α-生育酚:91.8ng;γ-生育 酚:36.6ng;δ生育酚:20.6ng。 2.试剂 实验用水为蒸馏水;试剂不加说明为分析纯。 (1)无水乙醚:不含有过氧化物。 ①过氧化物检查方法:用 5mL 乙醚加 1mL 10%碘化钾溶液,振摇 1min,如有过氧化物则放 出游离碘,水层呈黄色,或加 4 滴 5g/L 淀粉液,水层呈蓝色。该乙醚需处理后使用。 ②去除过氧化的方法:重蒸乙醚时,瓶中放入纯铁丝或铁末少许。弃去 10%初馏液和 10% 残馏液。 (2)无水乙醇:不得含有醛类物质

①检查方法:取 2mL 银铵溶液于试管中,加入少量乙醇,摇匀,再加入 10%氢氧化钠溶液, 加热。放置冷却后,若有银镜反应则表示乙醇中有醛。 ②脱醛方法:取 2g 硝酸银,溶于少量水中。取 4g 氢氧化钠溶于温乙醇中。将两者倾入 1L 乙醇中,振摇后,放置暗处 2 天(不时摇动,促进反应),经过滤,置蒸馏瓶中蒸馏,弃去 初蒸出的 50mL。当乙醇中含醛较多时,硝酸银用量适当增加。 (3)无水硫酸钠 (4) 甲醇:重蒸后使用。 (5) 重蒸水 水中加少量高猛酸钾,临用前蒸馏。 (6)抗坏血酸溶液(10%)(m/V):临用前进行配制。 (7)1:1 氢氧化钾溶液 氢氧化钠溶液(10%). (8)硝酸银溶液(5%)(m/V) (9)银氨溶液:加氨水至 5%硝酸银溶液中,直至生成的沉淀重新溶解为止,再加 10%氢氧化 钠溶液数滴,如发生沉淀,再加氨水直至溶解。 (10)维生素 A 标准液:视黄醇(纯度 85%)或视黄醇乙酸酯纯度 90%)经皂化处理后使用。 用脱醛乙醇溶解维生素 A 标准品,使其浓度大约为 1mL 相当于 1mg 视黄醇。临用前用紫 外分光光度法分别标定其准确浓度。 (11)维生素 E 标准液:α-生育酚(纯度 95%)γ-生育酚(纯度 95%)δ生育酚(纯度 95%)用脱醛乙醇分别溶解以上三种维生素 E 标准品,使其浓度大约为 1mL 相当于 1mg. 临用前用紫外分光光度法分别标定此三种维生素 E 的准确浓度。 (12)内标溶液:称取苯并[e]芘(纯度 98%),用脱醛乙醇配制成每毫升相当于 10μg 苯并[e] 芘的内标溶液。 (13)pH1-14 试纸 3.仪器和设备 (1)实验室常用设备。 (2)高压液相色谱仪带紫外分光检测器。 (3)旋转蒸发器。 (4)高速离心机。小离心管:具塑料盖 1.5-3.0mL 塑料离心管(与高速离心机配套)。 (5)高纯氮气。 (6)恒温水浴锅。 (7)紫外分光光度计。 4. 操作步骤 (1)样品处理 ①皂化 称取 1-10g 样品(含维生素 A 约 3μg,维生素 E 各异构体约为 40μg)于皂化瓶中, 加 30mL 无水乙醇,进行搅拌,直到颗粒物分散均匀为止。加 5mL100g/L 抗坏血酸,苯 并[e]芘标准液 2.00mL,混匀。加 10mL1:1 氢氧化钾溶液,混匀。于沸水浴上回流 30min 使皂化完全。皂化后立即放入冰水中冷却。 ②提取 将皂化后的样品移入分液漏斗中,用 50mL 水分 2-3 次洗皂化瓶,洗液并入分液漏 斗中。用约 100mL 乙醚分两次洗皂化瓶及其残渣,乙醚液并入分液漏斗中。如有残渣, 可将此液通过有少许脱脂棉的漏斗滤入分液漏斗。轻轻振摇分液漏斗 2min,静置分导, 弃去水层。 ③洗涤 用约 50mL 水洗分液漏斗中的乙醚层,用 pH 试纸检验水层不显碱性(最初水洗轻摇, 逐次振摇强度可增加)。 ④浓缩 将乙醚提取液经过无水硫酸钠(约 5g)滤入与旋转蒸发器配套的 250-300mL 球形 蒸发瓶内,用约 10mL 乙醚冲洗分液漏斗及无水硫酸钠 3 次,并入蒸发瓶内,并将其接至 旋转蒸发器上,于 55℃水浴中减压蒸馏并回收乙醚,待瓶中剩下约 2mL 乙醚时,取下蒸 发瓶,立即用氮气吹掉乙醚。产即加入 2.00mL 乙醇,充分混合,溶解提取物。 ⑤将乙醇液移入一小塑料离心管中[3.(4)],离心 5min(5000r/min).上清液供色谱分析
①检查方法:取 2mL 银铵溶液于试管中,加入少量乙醇,摇匀,再加入 10%氢氧化钠溶液, 加热。放置冷却后,若有银镜反应则表示乙醇中有醛。 ②脱醛方法:取 2g 硝酸银,溶于少量水中。取 4g 氢氧化钠溶于温乙醇中。将两者倾入 1L 乙醇中,振摇后,放置暗处 2 天(不时摇动,促进反应),经过滤,置蒸馏瓶中蒸馏,弃去 初蒸出的 50mL。当乙醇中含醛较多时,硝酸银用量适当增加。 (3)无水硫酸钠 (4) 甲醇:重蒸后使用。 (5) 重蒸水 水中加少量高猛酸钾,临用前蒸馏。 (6)抗坏血酸溶液(10%)(m/V):临用前进行配制。 (7)1:1 氢氧化钾溶液 氢氧化钠溶液(10%). (8)硝酸银溶液(5%)(m/V) (9)银氨溶液:加氨水至 5%硝酸银溶液中,直至生成的沉淀重新溶解为止,再加 10%氢氧化 钠溶液数滴,如发生沉淀,再加氨水直至溶解。 (10)维生素 A 标准液:视黄醇(纯度 85%)或视黄醇乙酸酯纯度 90%)经皂化处理后使用。 用脱醛乙醇溶解维生素 A 标准品,使其浓度大约为 1mL 相当于 1mg 视黄醇。临用前用紫 外分光光度法分别标定其准确浓度。 (11)维生素 E 标准液:α-生育酚(纯度 95%)γ-生育酚(纯度 95%)δ生育酚(纯度 95%)用脱醛乙醇分别溶解以上三种维生素 E 标准品,使其浓度大约为 1mL 相当于 1mg. 临用前用紫外分光光度法分别标定此三种维生素 E 的准确浓度。 (12)内标溶液:称取苯并[e]芘(纯度 98%),用脱醛乙醇配制成每毫升相当于 10μg 苯并[e] 芘的内标溶液。 (13)pH1-14 试纸 3.仪器和设备 (1)实验室常用设备。 (2)高压液相色谱仪带紫外分光检测器。 (3)旋转蒸发器。 (4)高速离心机。小离心管:具塑料盖 1.5-3.0mL 塑料离心管(与高速离心机配套)。 (5)高纯氮气。 (6)恒温水浴锅。 (7)紫外分光光度计。 4. 操作步骤 (1)样品处理 ①皂化 称取 1-10g 样品(含维生素 A 约 3μg,维生素 E 各异构体约为 40μg)于皂化瓶中, 加 30mL 无水乙醇,进行搅拌,直到颗粒物分散均匀为止。加 5mL100g/L 抗坏血酸,苯 并[e]芘标准液 2.00mL,混匀。加 10mL1:1 氢氧化钾溶液,混匀。于沸水浴上回流 30min 使皂化完全。皂化后立即放入冰水中冷却。 ②提取 将皂化后的样品移入分液漏斗中,用 50mL 水分 2-3 次洗皂化瓶,洗液并入分液漏 斗中。用约 100mL 乙醚分两次洗皂化瓶及其残渣,乙醚液并入分液漏斗中。如有残渣, 可将此液通过有少许脱脂棉的漏斗滤入分液漏斗。轻轻振摇分液漏斗 2min,静置分导, 弃去水层。 ③洗涤 用约 50mL 水洗分液漏斗中的乙醚层,用 pH 试纸检验水层不显碱性(最初水洗轻摇, 逐次振摇强度可增加)。 ④浓缩 将乙醚提取液经过无水硫酸钠(约 5g)滤入与旋转蒸发器配套的 250-300mL 球形 蒸发瓶内,用约 10mL 乙醚冲洗分液漏斗及无水硫酸钠 3 次,并入蒸发瓶内,并将其接至 旋转蒸发器上,于 55℃水浴中减压蒸馏并回收乙醚,待瓶中剩下约 2mL 乙醚时,取下蒸 发瓶,立即用氮气吹掉乙醚。产即加入 2.00mL 乙醇,充分混合,溶解提取物。 ⑤将乙醇液移入一小塑料离心管中[3.(4)],离心 5min(5000r/min).上清液供色谱分析

如果样品中维生素含量过少,可用氮气将乙醇液吹干后,再用乙醇重新定容。并记下体积 比。 (2)标准曲线的制备 ①维生素 A 和维生素 E 标准浓度的标定方法 取维生素 A 和各维生素 E 标准液若干微升,分别稀释至 3.00mL 乙醇中,并分别按给 定波长测定各维生素的吸光值。用比吸光系数计算出该维生素的浓度。测定条件如表 3-2 所示。 表 3-2 标准 加入标准的量 S,uL 比吸光系数 E 1% cm 波长 λ,nm 视黄醇 γ-生育酚 δ-生育酚 α-生育酚 10.00 100.0 100.0 100.0 1835 71 92.8 91.2 325 294 298 298 浓度计算: .(3 23) 10 3.00 100 1 3 − = − − E S A X 式中: X1 -某维生素浓度,g/mL; − A -维生素的平均紫外吸光值; S-加入标准的量,μL。 E-某种维生素 1%比吸光系数; 3 10 3.00 − S -标准液稀释倍数。 ②标准曲线的制备 本方法采用内标法定量。把一定量的维生素 A、γ-生育酚、α-生育酚、δ-生育 酚及内标苯并〔e〕芘液混合均匀。选择合适灵敏度,使上述物质的各峰高约为满量程 70%, 为高浓度点。高浓度的 2 1 为低浓度点(其内标苯并〔e〕芘的浓度值不变),用此二种浓 度的混合标准进行色谱分析,结果见色谱图。维生素标准曲线绘制是以维生素峰面积与内 标物峰面积之比为纵坐标,维生素浓度为横坐标绘制,或计算直线回归方程。如有微处理 机装置,则按仪器说明用二点内标法进行定量。 图 3-10 维生素 A 和维生素 E 色谱图 本方法不能将β-E 和γ-E 分开,故γ-E 峰中包含有β-E 峰
如果样品中维生素含量过少,可用氮气将乙醇液吹干后,再用乙醇重新定容。并记下体积 比。 (2)标准曲线的制备 ①维生素 A 和维生素 E 标准浓度的标定方法 取维生素 A 和各维生素 E 标准液若干微升,分别稀释至 3.00mL 乙醇中,并分别按给 定波长测定各维生素的吸光值。用比吸光系数计算出该维生素的浓度。测定条件如表 3-2 所示。 表 3-2 标准 加入标准的量 S,uL 比吸光系数 E 1% cm 波长 λ,nm 视黄醇 γ-生育酚 δ-生育酚 α-生育酚 10.00 100.0 100.0 100.0 1835 71 92.8 91.2 325 294 298 298 浓度计算: .(3 23) 10 3.00 100 1 3 − = − − E S A X 式中: X1 -某维生素浓度,g/mL; − A -维生素的平均紫外吸光值; S-加入标准的量,μL。 E-某种维生素 1%比吸光系数; 3 10 3.00 − S -标准液稀释倍数。 ②标准曲线的制备 本方法采用内标法定量。把一定量的维生素 A、γ-生育酚、α-生育酚、δ-生育 酚及内标苯并〔e〕芘液混合均匀。选择合适灵敏度,使上述物质的各峰高约为满量程 70%, 为高浓度点。高浓度的 2 1 为低浓度点(其内标苯并〔e〕芘的浓度值不变),用此二种浓 度的混合标准进行色谱分析,结果见色谱图。维生素标准曲线绘制是以维生素峰面积与内 标物峰面积之比为纵坐标,维生素浓度为横坐标绘制,或计算直线回归方程。如有微处理 机装置,则按仪器说明用二点内标法进行定量。 图 3-10 维生素 A 和维生素 E 色谱图 本方法不能将β-E 和γ-E 分开,故γ-E 峰中包含有β-E 峰

(3)高效液相色谱分析 色谱条件(推荐条件) 预柱:ultrasphere ODS 10µm,4mm×4.5cm。 分析柱:ultrasphere ODS5µm,4.6mm×25mm。 流动相:甲醇:水=98:2,混匀,于临用前脱气。 紫外检测器波长:300nm。量程 0.02。 进样量:20µL。 流速:1.7ml/min。 (4)样品分析 取样品浓缩液 20µl,待绘制出色谱图及色谱参数后,再进行定性和定量。 ①定性:用标准物色谱峰的保留时间定性。 ②定量:根据色谱图求出某种维生素峰面积与内标物峰面积的比值,以此值在标准曲线上 查到其含量。或用回归方程求出其含量。 5、计算 .(3 24) 1000 100 2 = V − m c X 式中: X2 -某种维生素的含量,mg/100g; c-由标准曲线上查到某种维生素含量,μg/mL; V-样品浓缩定容体积,ml; M-样品质量,g。 用微处理机二点内标法进行计算时,按其计算公式计算或由微机直接给出结果。 6、结果的允许差 同一实验室,同时测定或重复测定结果相对偏差绝对值≦10%。 (三)维生素 A 的比色法(GB12388-90) 本方法适用于食物中维生素 A 的测定。 1、原理 维生素 A 在三氯甲烷中与三氯化锑相互作用,产生蓝色物质,其深浅与溶液中所含维 生素 A 的含量成正比。该蓝色物质虽不稳定,但在一定时间内可用分光光度计于 620nm 波长处测定其吸光度。 2、试剂 本实验用水均为菡馏水。 (1)无水硫酸钠。 (2)乙酸酐。 (3)乙醚:同本章维生素 A 和维生素 E 的高效液相色谱法。 (4)无水乙醇:同维生素 A 和维生素 E 的高效液相色谱法。 (5)三氯甲烷:应不含分解物,否则会破坏维生素 A。 ①检查方法:三氯甲烷不稳定,放置后易受空气中氧的作用生成氯化氢和光气。检查时可 取少量三氯甲烷置试管中加水少许振摇,使氯化氢溶到水层。加入几滴硝酸银溶液,如有 白色沉淀即说明三氯甲烷中有分解产物。 ②处理方法:试剂应先检验是否含有分解产物,如有,则应于分液漏斗中加水洗数次,加 无水硫酸钠或氯化钙使之脱水,然后菡馏。 (6)25%三氯化锑-三氯甲烷溶液:用三氯甲烷配制 25%三氯化锑溶液,贮于棕色瓶中(注 意勿使吸收水分)。 (7)1:1 氢氧化钾溶液:取 50g 氢氧化钾,溶于 50g 水中,混匀。 (8)维生素 A 或视黄醇乙酸酯标准液:其配制及标定方法均同维生素 A 和维生素 E 的高效液 相色谱法。 (9)酚酞指示剂:用 95%乙醇配制 1%溶液。 3、仪器和设备 (1)实验室常用设备。 (2)分光光度计
(3)高效液相色谱分析 色谱条件(推荐条件) 预柱:ultrasphere ODS 10µm,4mm×4.5cm。 分析柱:ultrasphere ODS5µm,4.6mm×25mm。 流动相:甲醇:水=98:2,混匀,于临用前脱气。 紫外检测器波长:300nm。量程 0.02。 进样量:20µL。 流速:1.7ml/min。 (4)样品分析 取样品浓缩液 20µl,待绘制出色谱图及色谱参数后,再进行定性和定量。 ①定性:用标准物色谱峰的保留时间定性。 ②定量:根据色谱图求出某种维生素峰面积与内标物峰面积的比值,以此值在标准曲线上 查到其含量。或用回归方程求出其含量。 5、计算 .(3 24) 1000 100 2 = V − m c X 式中: X2 -某种维生素的含量,mg/100g; c-由标准曲线上查到某种维生素含量,μg/mL; V-样品浓缩定容体积,ml; M-样品质量,g。 用微处理机二点内标法进行计算时,按其计算公式计算或由微机直接给出结果。 6、结果的允许差 同一实验室,同时测定或重复测定结果相对偏差绝对值≦10%。 (三)维生素 A 的比色法(GB12388-90) 本方法适用于食物中维生素 A 的测定。 1、原理 维生素 A 在三氯甲烷中与三氯化锑相互作用,产生蓝色物质,其深浅与溶液中所含维 生素 A 的含量成正比。该蓝色物质虽不稳定,但在一定时间内可用分光光度计于 620nm 波长处测定其吸光度。 2、试剂 本实验用水均为菡馏水。 (1)无水硫酸钠。 (2)乙酸酐。 (3)乙醚:同本章维生素 A 和维生素 E 的高效液相色谱法。 (4)无水乙醇:同维生素 A 和维生素 E 的高效液相色谱法。 (5)三氯甲烷:应不含分解物,否则会破坏维生素 A。 ①检查方法:三氯甲烷不稳定,放置后易受空气中氧的作用生成氯化氢和光气。检查时可 取少量三氯甲烷置试管中加水少许振摇,使氯化氢溶到水层。加入几滴硝酸银溶液,如有 白色沉淀即说明三氯甲烷中有分解产物。 ②处理方法:试剂应先检验是否含有分解产物,如有,则应于分液漏斗中加水洗数次,加 无水硫酸钠或氯化钙使之脱水,然后菡馏。 (6)25%三氯化锑-三氯甲烷溶液:用三氯甲烷配制 25%三氯化锑溶液,贮于棕色瓶中(注 意勿使吸收水分)。 (7)1:1 氢氧化钾溶液:取 50g 氢氧化钾,溶于 50g 水中,混匀。 (8)维生素 A 或视黄醇乙酸酯标准液:其配制及标定方法均同维生素 A 和维生素 E 的高效液 相色谱法。 (9)酚酞指示剂:用 95%乙醇配制 1%溶液。 3、仪器和设备 (1)实验室常用设备。 (2)分光光度计

(3)回流冷凝装置。 4、操作步骤 维生素 A 极易被光破坏,实验操作应在微弱光线下进行,或用棕色玻璃仪器。 (1)样品处理:根据样品性质,可采用皂化法或研磨法。 ①皂化法:适用于维生素 A 含量不高的样品,可减少脂溶性物质的干扰,但全部试验过程 费时,且易导致维生素 A 损失。 皂化:根据样品中维生素 A 含量的不同,称取 0.5~5g 样品于三角瓶中,加入 10ml1: 1 氢氧化钾及 20~40ml 乙醇,于电热板上回流 30min 至皂化完全为止。 提取:将皂化瓶内混合物移至分液漏斗中,以 30ml 水洗皂化瓶,洗液并入分液漏斗。 如有残渣,可用脱脂棉漏斗滤入分液漏斗内。用 50ml 乙醚分二次洗皂化瓶,洗液并入分 液漏斗中。振摇并注意放气,静置分层后,水层放入第二个分液漏斗中内。皂化瓶再用约 30ml 乙醚分二次冲洗,洗液倾入第二个分液漏斗中。振摇后,静置分层,水层放入三角 瓶中,醚层与第一个分液漏斗合并。重复至水液中无维生素 A 为止。 洗涤:用约 30ml 水加入第一个分液漏斗中,轻轻振摇,静置片刻后,放去水层。加 15~20ml 0.5mol/L 氢氧化钾液于分液漏斗中,轻轻振摇后,弃去下层碱液,除去醚溶性 酸皂。继续用水洗涤,每次用水约 30ml,直至洗涤液与酚酞指示剂呈无色为止(大约 3 次)。醚层液静置 10~20min,小心放出析出的水。 浓缩:将醚层液经过无水硫酸钠滤入三角瓶中,再用约 25ml 乙醚冲洗分液漏斗和硫 酸钠两次,洗液并入三角瓶内。置水浴上蒸馏,收回乙醚。待瓶中剩约 5ml 乙醚时取下, 用减压抽气法至干,立即加入一定量的三氯甲烷使溶液中维生素 A 含量在适宜浓度范围 内。 ②研磨法:适用于每克样品维生素 A 含量大于 5~10μg 样品的测定,如肝的分析。步骤简 单,省时,结果准确。 研磨:精确称 2~5g 样品,放入盛有 3~5 倍样品质量的无水硫酸钠研钵中,研磨至 样品中水分完全被吸收,并均质化。 提取:小心地将全部均质化样品移入带盖的三角瓶内,准确加入 50~100ml 乙醚。紧 压盖子,用力振摇 2min,使样品中维生素 A 溶于乙醚中。使其自行澄清(大约需 1~2h), 或离心澄清(因乙醚易挥发,气温高时应在冷水溶中操作。装乙醚的试剂瓶也应事先放入 冷水浴中)。 浓缩:取澄清提取乙醚液 2~5ml,放入比色管中,在 70~80℃水浴上抽气蒸干。立 即加入 1ml 三氯甲烷溶解残渣。 5、测定步骤 (1)标准曲线的制备 准确取一定量的维生素 A 标准液于 4~5 个容量瓶中,以三氯甲烷配制标准系列。再 取相同数量比色管顺次取 1ml 三氯甲烷和标准系列使用液 1ml,各管加入乙酸酐 1 滴,制 成标准比色列。于 620nm 波长处,以三氯甲烷调节吸光度至零点,将其标准比色列按顺序 移入光路前,迅速加入 9ml 三氯化锑-三氯甲烷溶液。于 6s 内测定吸光度,将吸光度为 纵坐标,以维生素 A 含量为横坐标绘制曲线图。 (2)样品测定 于一比色管中加入 10ml 三氯甲烷,加入 1 滴乙酸酐为空白液。另一比色管中加入 1ml 三氯甲烷,其余比色管中分别加入 1ml 样品溶液及 1 滴乙酸酐。其余步骤同标准曲线 的制备。 6、计算 .(3 25) 1000 100 = V − m c X 式中:X――样品中含维生素 A 的量 mg/100g(如按国际音单位,每国际单位=0.3μ g 维生素 A); c――由标准曲线上查得样品中含维生素 A 的含量,μg/mL; m――样品质量,g; V――提取后加三氯甲烷定量的体积,mL;
(3)回流冷凝装置。 4、操作步骤 维生素 A 极易被光破坏,实验操作应在微弱光线下进行,或用棕色玻璃仪器。 (1)样品处理:根据样品性质,可采用皂化法或研磨法。 ①皂化法:适用于维生素 A 含量不高的样品,可减少脂溶性物质的干扰,但全部试验过程 费时,且易导致维生素 A 损失。 皂化:根据样品中维生素 A 含量的不同,称取 0.5~5g 样品于三角瓶中,加入 10ml1: 1 氢氧化钾及 20~40ml 乙醇,于电热板上回流 30min 至皂化完全为止。 提取:将皂化瓶内混合物移至分液漏斗中,以 30ml 水洗皂化瓶,洗液并入分液漏斗。 如有残渣,可用脱脂棉漏斗滤入分液漏斗内。用 50ml 乙醚分二次洗皂化瓶,洗液并入分 液漏斗中。振摇并注意放气,静置分层后,水层放入第二个分液漏斗中内。皂化瓶再用约 30ml 乙醚分二次冲洗,洗液倾入第二个分液漏斗中。振摇后,静置分层,水层放入三角 瓶中,醚层与第一个分液漏斗合并。重复至水液中无维生素 A 为止。 洗涤:用约 30ml 水加入第一个分液漏斗中,轻轻振摇,静置片刻后,放去水层。加 15~20ml 0.5mol/L 氢氧化钾液于分液漏斗中,轻轻振摇后,弃去下层碱液,除去醚溶性 酸皂。继续用水洗涤,每次用水约 30ml,直至洗涤液与酚酞指示剂呈无色为止(大约 3 次)。醚层液静置 10~20min,小心放出析出的水。 浓缩:将醚层液经过无水硫酸钠滤入三角瓶中,再用约 25ml 乙醚冲洗分液漏斗和硫 酸钠两次,洗液并入三角瓶内。置水浴上蒸馏,收回乙醚。待瓶中剩约 5ml 乙醚时取下, 用减压抽气法至干,立即加入一定量的三氯甲烷使溶液中维生素 A 含量在适宜浓度范围 内。 ②研磨法:适用于每克样品维生素 A 含量大于 5~10μg 样品的测定,如肝的分析。步骤简 单,省时,结果准确。 研磨:精确称 2~5g 样品,放入盛有 3~5 倍样品质量的无水硫酸钠研钵中,研磨至 样品中水分完全被吸收,并均质化。 提取:小心地将全部均质化样品移入带盖的三角瓶内,准确加入 50~100ml 乙醚。紧 压盖子,用力振摇 2min,使样品中维生素 A 溶于乙醚中。使其自行澄清(大约需 1~2h), 或离心澄清(因乙醚易挥发,气温高时应在冷水溶中操作。装乙醚的试剂瓶也应事先放入 冷水浴中)。 浓缩:取澄清提取乙醚液 2~5ml,放入比色管中,在 70~80℃水浴上抽气蒸干。立 即加入 1ml 三氯甲烷溶解残渣。 5、测定步骤 (1)标准曲线的制备 准确取一定量的维生素 A 标准液于 4~5 个容量瓶中,以三氯甲烷配制标准系列。再 取相同数量比色管顺次取 1ml 三氯甲烷和标准系列使用液 1ml,各管加入乙酸酐 1 滴,制 成标准比色列。于 620nm 波长处,以三氯甲烷调节吸光度至零点,将其标准比色列按顺序 移入光路前,迅速加入 9ml 三氯化锑-三氯甲烷溶液。于 6s 内测定吸光度,将吸光度为 纵坐标,以维生素 A 含量为横坐标绘制曲线图。 (2)样品测定 于一比色管中加入 10ml 三氯甲烷,加入 1 滴乙酸酐为空白液。另一比色管中加入 1ml 三氯甲烷,其余比色管中分别加入 1ml 样品溶液及 1 滴乙酸酐。其余步骤同标准曲线 的制备。 6、计算 .(3 25) 1000 100 = V − m c X 式中:X――样品中含维生素 A 的量 mg/100g(如按国际音单位,每国际单位=0.3μ g 维生素 A); c――由标准曲线上查得样品中含维生素 A 的含量,μg/mL; m――样品质量,g; V――提取后加三氯甲烷定量的体积,mL;

100――以每百克样品计。 二.水溶性维生素的标准测定方法 (一)硫胺素(维生素 B1)的荧光法(GB 12390-90) 本方法适用于各类食物中硫胺素的测定,但不适用于有吸附硫胺素能力的物质和含有 影响噻嘧色素荧光物质的样品。 本方法的最低检出限为 0.05μg 1.原理 硫胺素在碱性铁氰化钾溶液中被氧化成噻嘧色素,在紫外线下,噻嘧色素发出荧光。 在给定的条件下,以及没有其他荧光物质干扰时,此荧光的强度与噻嘧色素量成正比,即 与溶液中硫胺素的量成正比。 如样品中含杂质过多,应经过离子交换剂处理,使硫胺素与杂质分离,然后以所得溶 液作测定。 2.试剂 (1)正丁醇:优级纯或重蒸馏的分析纯。 (2)无水硫酸钠:分析纯。 (3)演粉梅。 (4)水:去离子水或蒸馏水。 (5)0.1mol/L 盐酸:8.5mL 浓盐酸用水稀释至 1000mL。 (6)0.3mol/l 盐酸:25.5mL 浓盐酸用水稀释至 1000mL。 (7)2mol/L 乙酸钠溶液:164g 无水乙酸钠或 272g 含水乙酸钠溶于水中稀释至 1000mL。 (8)25%氯化钾溶液:250g 氯化钾溶于水中稀释至 1000mL。 (9)25%酸性氯化钾溶液:8.5mL 浓盐酸用 25%氯化钾溶液稀释至 1000mL。 (10)15%氢氧化钠溶液:15g 氢氧化钠溶于水中稀释至 1000mL。 (11)1%铁氰化钾溶液:1g 铁氰化钾溶于水中稀释至 100mL。放于棕色瓶内保存。 (12)碱性铁氰化钾溶液:取 4mL 1%铁氰化钾溶液,用 15%氢氧化钠溶液稀释至 60mL。用时 现配,避光使用。 (13)3%乙酸溶液:30mL 冰乙酸用水稀释至 1000mL。 (14)活性人造浮石:称取 100g 经 40 目筛的人造浮石,以 10 倍于其容积的 3%热乙酸搅洗 2 次,每次 10min;再用 5 倍于其容积的 25%热氯化钾搅洗 15min;然后再用 3%热乙酸搅洗 10min;最后用热蒸馏水洗至没有氯离子。于蒸馏水中保存。 (15)硫胺素标准贮备液:准确称取 100mg 经氯化钙干燥 24h 的硫胺素,溶于 0.01mol/L 盐 酸中,并稀释至 1000mL。此溶液每毫升相当 0.1mg 硫胺素。于冰箱中避光可保存数月 (16)将硫胺素标准中间液:将硫胺素标准贮备液用 0.01mol/L 盐酸稀释 10 倍。此溶液每毫 升相当 10μg 硫胺素。于冰箱中避光可保存数月。 (17)硫胺素标准使用液:将硫胺素标准中间液用水稀释 100 倍,此溶液每毫升相当 0.1μg 硫胺素。用时现配。 (18)0.04%溴甲酚绿溶液:称取 0.1g 溴甲酚绿,置于小研钵中,加入 1.4mL0.1mol/L 氢氧 化钠溶液研磨片刻,再加入少许水继续研磨至完全溶解,用水稀释至 250 mL。 3.仪器、设备 (1)实验室常用仪器设备。 (2)荧光分光光度计。 (3)Maizel-Gerson 反应瓶:如图 3-11 所示。 (4)盐基交换管:如图 3-12 所示
100――以每百克样品计。 二.水溶性维生素的标准测定方法 (一)硫胺素(维生素 B1)的荧光法(GB 12390-90) 本方法适用于各类食物中硫胺素的测定,但不适用于有吸附硫胺素能力的物质和含有 影响噻嘧色素荧光物质的样品。 本方法的最低检出限为 0.05μg 1.原理 硫胺素在碱性铁氰化钾溶液中被氧化成噻嘧色素,在紫外线下,噻嘧色素发出荧光。 在给定的条件下,以及没有其他荧光物质干扰时,此荧光的强度与噻嘧色素量成正比,即 与溶液中硫胺素的量成正比。 如样品中含杂质过多,应经过离子交换剂处理,使硫胺素与杂质分离,然后以所得溶 液作测定。 2.试剂 (1)正丁醇:优级纯或重蒸馏的分析纯。 (2)无水硫酸钠:分析纯。 (3)演粉梅。 (4)水:去离子水或蒸馏水。 (5)0.1mol/L 盐酸:8.5mL 浓盐酸用水稀释至 1000mL。 (6)0.3mol/l 盐酸:25.5mL 浓盐酸用水稀释至 1000mL。 (7)2mol/L 乙酸钠溶液:164g 无水乙酸钠或 272g 含水乙酸钠溶于水中稀释至 1000mL。 (8)25%氯化钾溶液:250g 氯化钾溶于水中稀释至 1000mL。 (9)25%酸性氯化钾溶液:8.5mL 浓盐酸用 25%氯化钾溶液稀释至 1000mL。 (10)15%氢氧化钠溶液:15g 氢氧化钠溶于水中稀释至 1000mL。 (11)1%铁氰化钾溶液:1g 铁氰化钾溶于水中稀释至 100mL。放于棕色瓶内保存。 (12)碱性铁氰化钾溶液:取 4mL 1%铁氰化钾溶液,用 15%氢氧化钠溶液稀释至 60mL。用时 现配,避光使用。 (13)3%乙酸溶液:30mL 冰乙酸用水稀释至 1000mL。 (14)活性人造浮石:称取 100g 经 40 目筛的人造浮石,以 10 倍于其容积的 3%热乙酸搅洗 2 次,每次 10min;再用 5 倍于其容积的 25%热氯化钾搅洗 15min;然后再用 3%热乙酸搅洗 10min;最后用热蒸馏水洗至没有氯离子。于蒸馏水中保存。 (15)硫胺素标准贮备液:准确称取 100mg 经氯化钙干燥 24h 的硫胺素,溶于 0.01mol/L 盐 酸中,并稀释至 1000mL。此溶液每毫升相当 0.1mg 硫胺素。于冰箱中避光可保存数月 (16)将硫胺素标准中间液:将硫胺素标准贮备液用 0.01mol/L 盐酸稀释 10 倍。此溶液每毫 升相当 10μg 硫胺素。于冰箱中避光可保存数月。 (17)硫胺素标准使用液:将硫胺素标准中间液用水稀释 100 倍,此溶液每毫升相当 0.1μg 硫胺素。用时现配。 (18)0.04%溴甲酚绿溶液:称取 0.1g 溴甲酚绿,置于小研钵中,加入 1.4mL0.1mol/L 氢氧 化钠溶液研磨片刻,再加入少许水继续研磨至完全溶解,用水稀释至 250 mL。 3.仪器、设备 (1)实验室常用仪器设备。 (2)荧光分光光度计。 (3)Maizel-Gerson 反应瓶:如图 3-11 所示。 (4)盐基交换管:如图 3-12 所示

图 3-11Maizcl-Gerson 反应瓶 图 3-12 盐基交换管 4.操作步骤 (1)试样处理 样品采集后匀浆机打成匀浆(或者将样品尽量粉碎),于低温冰箱中冷冻保存,用时 将其解冻后使用。 (2)提取 ①精确称取一定量试样(估计其硫胺素含量约为 10—30 微克一般称取 5—20 克试样)置于 150ml 三角瓶中,加入 50—75ml0.1mol/l 或 0.3mol/l 盐酸使其溶解瓶口加盖小烧杯后放 入高压锅中加热水解 151b/in2 30min 然后取出。 ②用 2mol/L 乙酸钠调其 pH 值为 4.5(以 0.04%溴甲酚绿为外指示剂)。 ③按每克试样加入 20mg 淀粉酶的比例加入淀粉酶。于 45~50℃温箱过夜保温(约 16h)。 ④冷至室温,定容至 100ml,然后混匀过滤,即为提取液。 (3)净化 ①少许脱脂棉铺于盐基交换管的交换柱底部,加水将棉纤维中气泡排出,再加约 1g 活性人 造浮石使之达到交换柱的三分之一高度。保持盐基交换管中液面始终高于活性人造浮石。 ②用移液管加入提取液 20~80ml(使通过活性人造浮石的硫胺素总量约为 2~5μg)。 ③加入约 10ml 热水冲洗交换柱,弃去废液。如此重复三次。 ④加入 25%酸性氯化钾(温度为 90℃左右)20ml,收集此液于 25ml 刻度试管内,冷至室温, 用 25%酸性氯化钾定容至 25ml,即为试样净化液。 ⑤重复①~④,将 20ml 硫胺素标准使用液加入盐基交换管以代替样品提取液,即得到标准 净化液。 (3)氧化 ①将 5ml 试样净化液分别加入 A.B 两个 Maizel-Gerson 反应瓶。 ②在避光暗环境中将 3ml 15%氢氧化钠加入反应瓶 A,振摇约 15s,然后加入 10ml 正丁醇; 将 3ml 碱性铁氰化钾溶液加入反应瓶 B,振摇约 15s,然后加入 10ml 正丁醇;将 A.B 两个 反应瓶同时用力振摇,准确计时 1.5min。 ③重复①、②,用标准净化液代替试样净化液。 ④用黑布遮盖 A、B 反应瓶,静置分层后弃去下层碱性溶液,加入 2~3g 无水硫酸钠使溶液 脱水。 (5)荧光强度的测定。 ①荧光测定条件:激发波长 365nm;发射波长 435nm;激发波狭缝 5nm;发射波狭缝 5nm。 ②依次测定下列荧光强度。 a.试样空白荧光强度(试样反应瓶 A); b.标准空白荧光强度(标准反应瓶 A); c.试样荧光强度(试样反应瓶 B); d.标准荧光强度(标准反应瓶 B)。 5、计算 .(3 25) 1000 1 100 ( ) ) 2 1 − − = − V m V S S c V X U U b b 式中:X—样品中硫胺素含量,mg/100g;
图 3-11Maizcl-Gerson 反应瓶 图 3-12 盐基交换管 4.操作步骤 (1)试样处理 样品采集后匀浆机打成匀浆(或者将样品尽量粉碎),于低温冰箱中冷冻保存,用时 将其解冻后使用。 (2)提取 ①精确称取一定量试样(估计其硫胺素含量约为 10—30 微克一般称取 5—20 克试样)置于 150ml 三角瓶中,加入 50—75ml0.1mol/l 或 0.3mol/l 盐酸使其溶解瓶口加盖小烧杯后放 入高压锅中加热水解 151b/in2 30min 然后取出。 ②用 2mol/L 乙酸钠调其 pH 值为 4.5(以 0.04%溴甲酚绿为外指示剂)。 ③按每克试样加入 20mg 淀粉酶的比例加入淀粉酶。于 45~50℃温箱过夜保温(约 16h)。 ④冷至室温,定容至 100ml,然后混匀过滤,即为提取液。 (3)净化 ①少许脱脂棉铺于盐基交换管的交换柱底部,加水将棉纤维中气泡排出,再加约 1g 活性人 造浮石使之达到交换柱的三分之一高度。保持盐基交换管中液面始终高于活性人造浮石。 ②用移液管加入提取液 20~80ml(使通过活性人造浮石的硫胺素总量约为 2~5μg)。 ③加入约 10ml 热水冲洗交换柱,弃去废液。如此重复三次。 ④加入 25%酸性氯化钾(温度为 90℃左右)20ml,收集此液于 25ml 刻度试管内,冷至室温, 用 25%酸性氯化钾定容至 25ml,即为试样净化液。 ⑤重复①~④,将 20ml 硫胺素标准使用液加入盐基交换管以代替样品提取液,即得到标准 净化液。 (3)氧化 ①将 5ml 试样净化液分别加入 A.B 两个 Maizel-Gerson 反应瓶。 ②在避光暗环境中将 3ml 15%氢氧化钠加入反应瓶 A,振摇约 15s,然后加入 10ml 正丁醇; 将 3ml 碱性铁氰化钾溶液加入反应瓶 B,振摇约 15s,然后加入 10ml 正丁醇;将 A.B 两个 反应瓶同时用力振摇,准确计时 1.5min。 ③重复①、②,用标准净化液代替试样净化液。 ④用黑布遮盖 A、B 反应瓶,静置分层后弃去下层碱性溶液,加入 2~3g 无水硫酸钠使溶液 脱水。 (5)荧光强度的测定。 ①荧光测定条件:激发波长 365nm;发射波长 435nm;激发波狭缝 5nm;发射波狭缝 5nm。 ②依次测定下列荧光强度。 a.试样空白荧光强度(试样反应瓶 A); b.标准空白荧光强度(标准反应瓶 A); c.试样荧光强度(试样反应瓶 B); d.标准荧光强度(标准反应瓶 B)。 5、计算 .(3 25) 1000 1 100 ( ) ) 2 1 − − = − V m V S S c V X U U b b 式中:X—样品中硫胺素含量,mg/100g;

U—试样荧光强度 Ub—试样空白荧光强度; S—标准荧光强度; Sb—标准空白荧光强度; c—硫胺素标准使用液浓度,μg/mL; V—用于净化的硫胺素标准使用液体积,mL; V1—试样水解后定容之体积,mL; V2—试样用于净化的提取液体积,mL; m—试样质量,g; 1000 100 -样品含量由μg/g 换算成 mg/100g 的系数。 6.结果的允许误差 同一实验室同时或重复两次测定结果的相对偏差绝对值≤10%。 (二)核黄素(维生素 B2)的荧光法(GB 12391-90) 本方法适用于各类食物中黄素的测定。 1.原理 核黄素在 440-500nm 波长光照射下发生黄绿色荧光。在稀溶液中其荧光强度与核黄素 的浓度成正比。在波长 525nm 下测定其荧光强度。试液再加入低亚硫酸钠(Na2S2O4,也叫 连二亚硫酸钠),将核黄素还原为无荧光的物质,然后再测定试液中残余荧光杂质的荧光 强度,两者之差即为食品中核黄素所产生的荧光强度。 2.试剂 试验用水为蒸馏水。试剂不说明为分析纯。 (1)硅镁吸附剂:60-100 目。 (2)2.5mol/l 无水乙酸钠溶液。 (3)10%木瓜蛋白酶:用 2.5mol/L 乙酸钠溶液配制。使用时现配制。 (3)10%淀粉酶:用 2.5mol/L 乙酸钠溶液配制。使用时现配制。 (4)0.1mol/L 盐酸。 (5)1mol/L 氢氧化钠。 (6)0.1mol/L 氢氧化钠。 (7)20%低亚硫酸钠溶液:用时现配。保存在冰水浴中,4h 内有效。 (8)洗脱液:丙酮:冰乙酸:水(5:2:9)。 (9)0.04%溴甲酚绿指示剂:称取 0.1g 溴甲酚绿于小研钵中。加 1.4mL0.1mol/L 氢氧化钠溶 液研磨,加少许水,继续研磨,直到完全溶解。用水稀释至 250mL。 (10)3%高锰酸钾溶液。 (11)3%过氧化氢溶液。 (12)核黄素标准液的配制(纯度 98%)。 ①核黄素标准贮备液(25μg/mL):将标准品核黄素粉状结晶置于真空干燥器或盛有硫酸的 干燥器中。经过 24h 后,准确称取 50mg。置于 2L 容量瓶中,加入 2.4mL 冰乙酸和 1.5L 水。 将容量瓶置于温水中摇动,待其溶解,冷至室温,稀释至 2L,移至棕色瓶内,加少许甲苯 盖于溶液表面,于冰箱中保存。 ②核黄素标准使用液:吸取 2.00mL 核黄素标准贮备液,置于 50mL 棕色容量瓶中,用水稀 释至刻度。避光,贮于 4℃冰箱,或保存一周。此溶液每毫升相当于 1.00μg 核黄素。 3.仪器与设备 (1)实验室常用设备。 (2)高压消毒锅。 (3)电热恒温培养箱。 (4)核黄素吸附柱:见图 3-13. (5)荧光分光光度计。 4.操作步骤 整个操作过程需避光进行
U—试样荧光强度 Ub—试样空白荧光强度; S—标准荧光强度; Sb—标准空白荧光强度; c—硫胺素标准使用液浓度,μg/mL; V—用于净化的硫胺素标准使用液体积,mL; V1—试样水解后定容之体积,mL; V2—试样用于净化的提取液体积,mL; m—试样质量,g; 1000 100 -样品含量由μg/g 换算成 mg/100g 的系数。 6.结果的允许误差 同一实验室同时或重复两次测定结果的相对偏差绝对值≤10%。 (二)核黄素(维生素 B2)的荧光法(GB 12391-90) 本方法适用于各类食物中黄素的测定。 1.原理 核黄素在 440-500nm 波长光照射下发生黄绿色荧光。在稀溶液中其荧光强度与核黄素 的浓度成正比。在波长 525nm 下测定其荧光强度。试液再加入低亚硫酸钠(Na2S2O4,也叫 连二亚硫酸钠),将核黄素还原为无荧光的物质,然后再测定试液中残余荧光杂质的荧光 强度,两者之差即为食品中核黄素所产生的荧光强度。 2.试剂 试验用水为蒸馏水。试剂不说明为分析纯。 (1)硅镁吸附剂:60-100 目。 (2)2.5mol/l 无水乙酸钠溶液。 (3)10%木瓜蛋白酶:用 2.5mol/L 乙酸钠溶液配制。使用时现配制。 (3)10%淀粉酶:用 2.5mol/L 乙酸钠溶液配制。使用时现配制。 (4)0.1mol/L 盐酸。 (5)1mol/L 氢氧化钠。 (6)0.1mol/L 氢氧化钠。 (7)20%低亚硫酸钠溶液:用时现配。保存在冰水浴中,4h 内有效。 (8)洗脱液:丙酮:冰乙酸:水(5:2:9)。 (9)0.04%溴甲酚绿指示剂:称取 0.1g 溴甲酚绿于小研钵中。加 1.4mL0.1mol/L 氢氧化钠溶 液研磨,加少许水,继续研磨,直到完全溶解。用水稀释至 250mL。 (10)3%高锰酸钾溶液。 (11)3%过氧化氢溶液。 (12)核黄素标准液的配制(纯度 98%)。 ①核黄素标准贮备液(25μg/mL):将标准品核黄素粉状结晶置于真空干燥器或盛有硫酸的 干燥器中。经过 24h 后,准确称取 50mg。置于 2L 容量瓶中,加入 2.4mL 冰乙酸和 1.5L 水。 将容量瓶置于温水中摇动,待其溶解,冷至室温,稀释至 2L,移至棕色瓶内,加少许甲苯 盖于溶液表面,于冰箱中保存。 ②核黄素标准使用液:吸取 2.00mL 核黄素标准贮备液,置于 50mL 棕色容量瓶中,用水稀 释至刻度。避光,贮于 4℃冰箱,或保存一周。此溶液每毫升相当于 1.00μg 核黄素。 3.仪器与设备 (1)实验室常用设备。 (2)高压消毒锅。 (3)电热恒温培养箱。 (4)核黄素吸附柱:见图 3-13. (5)荧光分光光度计。 4.操作步骤 整个操作过程需避光进行