
第十章蛋白质和氨基酸的测定 第一节概述 蛋白质品生命的物质基础,是构成牛物体细胞组织的重要成分,总牛物体发有及修补细 织的原料 切有生命的活体都含有不同类型的蛋白质。人体内的酸、碱及水分平衡, 信息的传递,物质代谢及转运都与蛋白质有关。人及动物只能从食物中得到蛋白质及其分解 产物,来构成自身的蛋白质,故蛋白质是人体重要的营养物质,也是食品中重要的营养成分。 蛋白质在食品中含量的变化范围很宽。动物来源和豆类食品是优良的蛋白质资源。部分 种类食品的蛋白质含量见表10-1 表10-1部分食品的蛋白质含量 蛋白质的质量 蛋白质的质 食品种类 分数(以湿基 食品种类 量分数(以湿 计)% 基计)% 谷类和面食 土豆(整粒、肉和皮) 2.1 大米(糙米、长粒、生) 7.9 大米(白米、长粒、生、 大豆(成熟的种子、生) 36.5 强化) 71 豆(腰子状、所有品种 23.6 小老船(整粒】 13.7 成熟的种子、生) 玉米粉(整粒、黄色 69 豆腐(生、坚硬〉 15.6 意大利面条(干、强化) 12.8 豆腐(生、普通) 8.1 玉米淀粉 0.3 肉、家禽、鱼 乳制品 牛肉(颈肉、烤前腿) 18.5 牛乳(全脂、液体) 33 牛肉(膝制、干生牛肉) 29.1 牛乳(脱脂、干) 鸡(可供煎炸的鸡胸肉、 23.1 切达干酪 24 酸奶(普通的、低脂) 5.3 火腿(切片、普通的】 17.6 水果和蔬菜 鸡蛋(生、全蛋) 12.5 苹果(生、带皮) 0.2 角(太平洋钙鱼、生) 17.9 芦算(牛) 23 角(金拾角、白伍、带 26.5 草莓(生) 0.6 装、油浸、滴干的固体】 莴苣(冰、生) 1.0 蛋白质是复杂的含氮有机化合物, 摩尔质量大, 大部分高达数万~数百万,分子的长轴 则长达lnm~100nm,它们由20种氨基酸通过酰胺健以一定的方式结合起来,并具有一定 的空间结构,所含的主要化学元素为C、H、O、N,在某些蛋白质中还含有微量的P、Cu、 F、I等元素,但含氨则是蛋白质区别于其它有机化合物的主要标志。 不同的蛋白质其氨基酸构成比例及方式不同,故各种不同的蛋白质其含氢量也不同」 般蛋白质含氨量为16%,即1份氨相当于6.25份蛋白质,此数值(6.25)称为蛋白质系
第十章 蛋白质和氨基酸的测定 第一节 概述 蛋白质是生命的物质基础,是构成生物体细胞组织的重要成分,是生物体发育及修补组 织的原料。一切有生命的活体都含有不同类型的蛋白质。人体内的酸、碱及水分平衡,遗传 信息的传递,物质代谢及转运都与蛋白质有关。人及动物只能从食物中得到蛋白质及其分解 产物,来构成自身的蛋白质,故蛋白质是人体重要的营养物质,也是食品中重要的营养成分。 蛋白质在食品中含量的变化范围很宽。动物来源和豆类食品是优良的蛋白质资源。部分 种类食品的蛋白质含量见表 10-1 表 10-1 部分食品的蛋白质含量 蛋白质是复杂的含氮有机化合物,摩尔质量大,大部分高达数万~数百万,分子的长轴 则长达 1nm~100nm,它们由 20 种氨基酸通过酰胺键以一定的方式结合起来,并具有一定 的空间结构,所含的主要化学元素为 C、H、O、N,在某些蛋白质中还含有微量的 P、Cu、 Fe、I 等元素,但含氮则是蛋白质区别于其它有机化合物的主要标志。 不同的蛋白质其氨基酸构成比例及方式不同,故各种不同的蛋白质其含氮量也不同。 一般蛋白质含氮量为 16%,即 1 份氮相当于 6.25 份蛋白质,此数值(6.25)称为蛋白质系 食 品 种 类 蛋白质的质量 分数(以湿基 计)/% 食 品 种 类 蛋白质的质 量分数(以湿 基计)/% 谷类和面食 大米(糙米、长粒、生) 7.9 大米(白米、长粒、生、 强化) 7.1 小麦粉(整粒) 13.7 玉米粉(整粒、黄色) 6.9 意大利面条(干、强化) 12.8 玉米淀粉 0.3 乳制品 牛乳(全脂、液体) 3.3 牛乳(脱脂、干) 36.2 切达干酪 24.9 酸奶(普通的、低脂) 5.3 水果和蔬菜 苹果(生、带皮) 0.2 芦笋(生) 2.3 草莓(生) 0.6 莴苣(冰、生) 1.0 土豆(整粒、肉和皮) 2.1 豆类 大豆(成熟的种子、生) 36.5 豆(腰子状、所有品种、 23.6 成熟的种子、生) 豆腐(生、坚硬) 15.6 豆腐(生、普通) 8.1 肉、家禽、鱼 牛肉(颈肉、烤前腿) 18.5 牛肉(腌制、干牛肉) 29.1 鸡(可供煎炸的鸡胸肉、 23.1 生) 火腿(切片、普通的) 17.6 鸡蛋(生、全蛋) 12.5 鱼(太平洋鳕鱼、生) 17.9 鱼(金枪鱼、白色、罐 26.5 装、油浸、滴干的固体)

数。不同种类食品的蛋白质系数有所不同,如玉米、荞麦、青豆、鸡蛋等为625,花生为 546,大米为595,大目及其制品为571,小麦粉为570、生穷及其制品为638。 、酸或碱水解,其水解的中间产物为际、 、肚。终产物为日 质的最基 物质 虽名 各种天然物 分离得到的氨基酸已达 种以上,但是构成蛋白质的氨基酸主要是其中的20种,而在构成蛋白质的氨基酸中,亮氨 酸、异亮氨酸、赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、色氨酸和缬氨酸等8种氨基酸在人体 中不能合成,必须依靠食物供给,故被称为必需氨基酸,它们对人体有若极其重要的生理功 能,常会因其在体内缺乏而导致忠病或通过补充而增强了新陈代谢作用。随者食品科学的发 展和营养知识的普及,食物蛋白质中必需氨基酸含量的高低及氨基酸的构成, 愈来愈得到人 们的重视。为提高蛋白质的生理效价而进行食品的开发及合理配膳等工作都具有极其重要的 意义。 测定蛋白质的方法可分为两大类:一类是利用蛋白质的共性,即含氨量、肽键和折射 率等测定蛋白质含最:另一类是利用蛋白质中特定氨基酸残基、酸性和威性因以及芳香基 团等测定蛋白质含量。但因食品种类繁多,食品中蛋白质含量各异,特别是其它成分,如碳 水化合物、脂和维生素等干扰成分很多,因此蛋白质含量测定最常用的方法是凯氏定氨法 它是测定总有机氨的最准确和操作较简使的方法之一,在国内外应用普遍。该法是通过测出 样品中的总含氮量再乘以相应的蛋白质系数而求出蛋白质含量的,由于样品中常含有少量非 蛋白质含氨化合物,放此法的结果称为相蛋白质含量。此外,双缩脲法、染料结合法、酚试式 剂法等也常用于蛋白质含量测定,由于方法简便快速,故多用于生产单位质量控制分析。 近年来。 凯氏 不断 研究政进 使其在应用范围 分析结果的准确度 器 装置及分析操作速度等方面均取得了新的进步。另外,国外采用红外分析仪,利用波长在 0.75~3μm范围内的近红外线具有被食品中蛋白质组分吸收及反射的特性,依据红外线的 反射强度与食品中蛋白质含量之间存在的函数关系而建立了近红外光谱快速定量方法。 整干食品中氨基酸成分的复杂性,在一般的常检验中多定样品中的氨基酸总量 通常采用酸碱滴定法来完成。色谱技术的发展为各种氨基酸的分 离 鉴定及定最提供了有力 的工具,近年来世界上已出现了多种氨基酸分析仪,这使得快速鉴定和定量氨基酸的理想成 为现实。另外利用近红外反射分析仪,输入各类氨基酸的软件,通过电脑控制进行自动检测 和计算,也可以快速、准确地测出各类氨基酸含量。下面分别介绍常用的蛋白质和氨基酸测 定方法。 第二节蛋白质的定性测定 一、蛋白质的一般显色反应 1.氨其里法 H CoH-N _N=NCeH-NO HO3S 、S0h 氨基黑10B是酸性染料,其磺基与蛋白质反应构成复合盐,是最常用的蛋白质染料
数。不同种类食品的蛋白质系数有所不同,如玉米、荞麦、青豆、鸡蛋等为 6.25,花生为 5.46,大米为 5.95,大豆及其制品为 5.71,小麦粉为 5.70、牛乳及其制品为 6.38。 蛋白质可以被酶、酸或碱水解,其水解的中间产物为月示、胨、肽等,最终产物为氨基 酸。氨基酸是构成蛋白质的最基本物质,虽然从各种天然物中分离得到的氨基酸已达 175 种以上,但是构成蛋白质的氨基酸主要是其中的 20 种,而在构成蛋白质的氨基酸中,亮氨 酸、异亮氨酸、赖氨酸、苯丙氨酸、蛋氨酸、苏氨酸、色氨酸和缬氨酸等 8 种氨基酸在人体 中不能合成,必须依靠食物供给,故被称为必需氨基酸,它们对人体有着极其重要的生理功 能,常会因其在体内缺乏而导致患病或通过补充而增强了新陈代谢作用。随着食品科学的发 展和营养知识的普及,食物蛋白质中必需氨基酸含量的高低及氨基酸的构成,愈来愈得到人 们的重视。为提高蛋白质的生理效价而进行食品的开发及合理配膳等工作都具有极其重要的 意义。 测定蛋白质的方法可分为两大类:一类是利用蛋白质的共性,即含氮量、肽键和折射 率等测定蛋白质含量;另一类是利用蛋白质中特定氨基酸残基、酸性和碱性基因以及芳香基 团等测定蛋白质含量。但因食品种类繁多,食品中蛋白质含量各异,特别是其它成分,如碳 水化合物、脂肪和维生素等干扰成分很多,因此蛋白质含量测定最常用的方法是凯氏定氮法, 它是测定总有机氮的最准确和操作较简便的方法之一,在国内外应用普遍。该法是通过测出 样品中的总含氮量再乘以相应的蛋白质系数而求出蛋白质含量的,由于样品中常含有少量非 蛋白质含氮化合物,故此法的结果称为粗蛋白质含量。此外,双缩脲法、染料结合法、酚试 剂法等也常用于蛋白质含量测定,由于方法简便快速,故多用于生产单位质量控制分析。 近年来,凯氏定氮法经不断的研究改进,使其在应用范围、分析结果的准确度、仪器 装置及分析操作速度等方面均取得了新的进步。另外,国外采用红外分析仪,利用波长在 0.75~3μm 范围内的近红外线具有被食品中蛋白质组分吸收及反射的特性,依据红外线的 反射强度与食品中蛋白质含量之间存在的函数关系而建立了近红外光谱快速定量方法。 鉴于食品中氨基酸成分的复杂性,在一般的常规检验中多测定样品中的氨基酸总量, 通常采用酸碱滴定法来完成。色谱技术的发展为各种氨基酸的分离、鉴定及定量提供了有力 的工具,近年来世界上已出现了多种氨基酸分析仪,这使得快速鉴定和定量氨基酸的理想成 为现实。另外利用近红外反射分析仪,输入各类氨基酸的软件,通过电脑控制进行自动检测 和计算,也可以快速、准确地测出各类氨基酸含量。下面分别介绍常用的蛋白质和氨基酸测 定方法。 第二节 蛋白质的定性测定 一、蛋白质的一般显色反应 1.氨基黑法 C6H5N HO3S H NH2 N=NC6H4NO SO3H 氨基黑 10B 是酸性染料,其磺基与蛋白质反应构成复合盐,是最常用的蛋白质染料

(1)经点样后的层析纸经电泳或层析后,浸入氨基黑10B酷酸甲醇溶液(13g氨基黑 10B溶解于100mL冰醋酸和900mL甲醇中,充分摇匀,放置过夜,过滤后可反复使用几次) 染色后 用10%醋酸甲醇溶液洗涤约5一7次 待背景变成浅蓝色后干燥 若欲进行洗脱,用0.1mol/L氢氧化钠浸泡30min,于595nm比色测定。 (2)聚丙稀酰胺凝胶电泳后染色:用甲醇固定后,在含1%氨基黑10B0.1mol/L氢氧化 钠溶液中染色5mi(室温),用5%乙醇洗脱背景底色。或用7%醋酸固定后,于96℃水浴中 用7%醋酸(含0.5%1%氨基里10B)染色10min.7%醋酸洗脱背景底色。用氨其里10B染 SDS-蛋白质时效果不好。如果凝胶中含有兼性离子载体,先用10%三氯酷酸浸泡,每隔2h 换液一次,约10次,再进行染色。 (3)凝胶薄层的直接染色:将凝胶薄层放在一定湿度的烘箱内逐步干燥(50℃),没有 调温调湿箱时用一张滤纸放于烘箱内,以保持一定的湿度。将干燥的薄层板于漂洗液(750 mL甲醇,200mL水,50mL冰醋酸)中预处理10min,然后在染色液(750mL甲醇,200m 水,50ml冰醋酸,在此溶液中加氨基黑10B饱和)中染色5h,再在漂洗液内洗涤。 本法优点是灵敏度较高 缺点是花费时间长 不同蛋白质染色强度不同。 2.溴酚蓝法 经电泳或层析后滤纸或凝胶于0.1%溴酚蓝固定染色液(1g溴酚蓝,100g氯化汞溶于 50%乙醇水溶液中,用50%乙醇稀释至1000mL)中浸泡15~20min,在30%乙醇:5%醋酸 水溶液中漂洗过夜。如欲洗脱, 可用0.1 mol/LNaOH, SO.H 此法缺点是灵敏度低,某些摩尔质量低的蛋白质可能染不上颜色。 3.考马斯亮蓝法 考马斯亮蓝R250 该垫料和蛋白质是通过带德华力结合的。老马断高蓝令有梦多值水基团,和蛋白质的请 水区有较大的亲和力,而和凝胶基质的亲和力不如氨基黑,所以用考马斯亮蓝染色时漂洗要 容易得多。 (1)经电泳后滤纸或醋酸纤维膜在200gL磺基水杨酸溶液中浸1mn,取出后放入 2.5gL考马斯亮蓝R250染色液(配制用的蒸馏水内不含有重金属离子)浸5min,在蒸馏水
(1)经点样后的层析纸经电泳或层析后,浸入氨基黑 10B 醋酸甲醇溶液(13g 氨基黑 10B 溶解于 100mL 冰醋酸和 900mL 甲醇中,充分摇匀,放置过夜,过滤后可反复使用几次) 中,染色 10min,染色后,用 10%醋酸甲醇溶液洗涤约 5~7 次,待背景变成浅蓝色后干燥。 若欲进行洗脱,用 0.1mol/L 氢氧化钠浸泡 30min,于 595nm 比色测定。 (2)聚丙烯酰胺凝胶电泳后染色:用甲醇固定后,在含 1%氨基黑 10B 0.1mol/L 氢氧化 钠溶液中染色 5min(室温),用 5%乙醇洗脱背景底色。或用 7%醋酸固定后,于 96℃水浴中 用 7%醋酸(含 0.5%~1%氨基黑 10B)染色 10min,7%醋酸洗脱背景底色。用氨基黑 10B 染 SDS-蛋白质时效果不好。如果凝胶中含有兼性离子载体,先用 10%三氯醋酸浸泡,每隔 2h 换液一次,约 10 次,再进行染色。 (3)凝胶薄层的直接染色:将凝胶薄层放在一定湿度的烘箱内逐步干燥(50℃),没有 调温调湿箱时用一张滤纸放于烘箱内,以保持一定的湿度。将干燥的薄层板于漂洗液(750 mL 甲醇,200mL 水,50mL 冰醋酸)中预处理 10min,然后在染色液(750mL 甲醇,200mL 水,50mL 冰醋酸,在此溶液中加氨基黑 10B 饱和)中染色 5h,再在漂洗液内洗涤。 本法优点是灵敏度较高,缺点是花费时间长,不同蛋白质染色强度不同。 2.溴酚蓝法 经电泳或层析后滤纸或凝胶于 0.1%溴酚蓝固定染色液(1g 溴酚蓝,100g 氯化汞溶于 50%乙醇水溶液中,用 50%乙醇稀释至 1000mL)中浸泡 15~20min,在 30%乙醇:5%醋酸 水溶液中漂洗过夜。如欲洗脱,可用 0.1mol/LNaOH。 Br HO Br C C6H4SO3H O Br Br 此法缺点是灵敏度低,某些摩尔质量低的蛋白质可能染不上颜色。 3.考马斯亮蓝法 考马斯亮蓝 R250 CH2 N C N CH2 C2H5 C2H5 NH OC2H5 SO3Na SO3 - 该染料和蛋白质是通过范德华力结合的。考马斯亮蓝含有较多疏水基团,和蛋白质的疏 水区有较大的亲和力,而和凝胶基质的亲和力不如氨基黑,所以用考马斯亮蓝染色时漂洗要 容易得多。 (1)经电泳后滤纸或醋酸纤维膜在 200g/L 磺基水杨酸溶液中浸 1min,取出后放入 2.5g/L 考马斯亮蓝 R250 染色液(配制用的蒸馏水内不含有重金属离子)浸 5min,在蒸馏水

或7%醋酸中洗四次,每次5min,于90℃放置15min。 (2)聚丙烯酰胺凝胶也可同上处理。在酸性醇溶液中,考马斯亮蓝兼性离子载体络合 物溶解度显著增大,因此能免去清除兼性离子载体的步骤。可运用下列方法之 凝胶用10 氯醋酸固定,在10%三氯醋酸-1%考马斯亮蓝R250(19+1)中室温染色 0.5h,用10%三氯醋酸脱底色。 凝胶浸入预热至60℃的0.1%考马斯亮蓝固定染色液(150g三氯醋酸,45g磺基水杨酸 溶于375mL甲醇和930mL蒸馏水的混合液。每1g考马斯亮蓝R250溶于此混合液1000mL 中)中约30m,用酸性乙应画洗液(乙位+水+冰酷酸=25+25+8)洗尽背是颜色。垫色后 凝胶保存于酸性乙醇漂洗液中。本法灵敏度:卵清蛋白0.03g,血清清蛋白0.02μg,血 蛋白0.01μg。 凝胶浸入考马斯亮蓝固定染色液(2g考马斯亮蓝R250,溶于100mL蒸馏水中,加2mo/1 硫酸1OOmL,过滤除去沉淀,向清液中滴加10 mol/LKOH至颜色从绿变蓝为止。量体积, 每100mL加入三怎酷酸12g)中1h,然后用蒸榴水洗净背量颜色或在02%H,S0.溶液中污 泡片刻脱除背景颜色。染色后的凝胶保存于蒸馏水中。本法机制未明 ,起染色作用的可能不 是考马斯亮蓝本身 灵敏度不如上法 考马撕斯亮蓝法灵敏度比氨基黑高五倍,尤其适用于SDS电泳的微最蛋白质的染色。在 549nm有最大吸收值,蛋白质在1~10μg呈线性关系。 4.酸性品红法 经电泳后滤纸置于0.2%酸性品红溶液中(2g酸性品红溶解于500mL甲醇,400mL蒸 馏水和100mL冰醋酸中)加热染色15min:取出后浸入醋酸甲醇溶液(500mL甲醇,加400ml 蒸馏水和100mL冰醋酸)15min:然后浸入10%醋酸溶液,每次20min,至背景无色为止。 若欲进行比色,可用0.1 mol/L NaOH溶液浸泡2,在波长为570nm处比色。 5.氨基萘酚磺酸法 聚丙烯酰胺凝胶电泳后,把凝胶暴露于空气中几分钟,或在2mo/LHC1中浸一下使表 层蛋白变性,再在0.003%氨基萘酚磺酸的0.1molL磷酸盐缓冲液(pH6.8)中染3min,在 紫外光下可显黄绿色荧光。这样的染色可保留凝胶内部的酶和抗体的活性。如不需保留活性 时,可先在3mol1HC1中浸2min以上使蛋白质充分变性,再染色。 二、复合蛋白质的显色反应 1.糖蛋白的显色 (1)过碘酸.Schiff氏试剂显色法 试剂 过碘酸液:1.2g过碘酸溶解于30mL蒸馏水中,加15mL0.2molL醋酸钠溶液及100ml 乙醇。临用前配制,或保存在棕色瓶中,可用数日。 还原液:5g碘化钾,5g硫代硫酸钠溶于100mL蒸馏水中,加150mL95%乙醇及2.5mL 2 mol/LHC1。现配现用. 亚流移品红液.2。减性品红溶解于400mL沸水中,冷知至50℃过滤。在滤液中加入 10mL2mo0L盐酸和4g偏亚硫酸钾(KS,0s),将 塞紧放在冰箱中过夜, 加g活性炭 过滤,再逐渐加入2molL盐酸,直至此溶液在玻片上干后不变红色为止,保存在棕色瓶中, 冰箱贮存,当溶液变红时不可以再用
或 7%醋酸中洗四次,每次 5min,于 90℃放置 15min。 (2)聚丙烯酰胺凝胶也可同上处理。在酸性醇溶液中,考马斯亮蓝-兼性离子载体络合 物溶解度显著增大,因此能免去清除兼性离子载体的步骤。可运用下列方法之一: 凝胶用 10%三氯醋酸固定,在 10%三氯醋酸-1%考马斯亮蓝 R250(19+1)中室温染色 0.5h,用 10%三氯醋酸脱底色。 凝胶浸入预热至 60℃的 0.1%考马斯亮蓝固定染色液(150g 三氯醋酸,45g 磺基水杨酸 溶于 375mL 甲醇和 930mL 蒸馏水的混合液。每 1g 考马斯亮蓝 R250 溶于此混合液 1000mL 中)中约 30min,用酸性乙醇漂洗液(乙醇+水+冰醋酸=25+25+8)洗尽背景颜色。染色后 凝胶保存于酸性乙醇漂洗液中。本法灵敏度:卵清蛋白 0.03μg,血清清蛋白 0.02μg,血红 蛋白 0.01μg。 凝胶浸入考马斯亮蓝固定染色液(2g 考马斯亮蓝 R250,溶于 100mL 蒸馏水中,加 2mol/L 硫酸 100mL,过滤除去沉淀,向清液中滴加 10mol/L KOH 至颜色从绿变蓝为止。量体积, 每 100mL 加入三氯醋酸 12g)中 1h,然后用蒸馏水洗净背景颜色或在 0.2%H2SO4 溶液中浸 泡片刻脱除背景颜色。染色后的凝胶保存于蒸馏水中。本法机制未明,起染色作用的可能不 是考马斯亮蓝本身,灵敏度不如上法。 考马斯亮蓝法灵敏度比氨基黑高五倍,尤其适用于 SDS 电泳的微量蛋白质的染色。在 549nm 有最大吸收值,蛋白质在 1~10μg 呈线性关系。 4.酸性品红法 经电泳后滤纸置于 0.2%酸性品红溶液中(2g 酸性品红溶解于 500mL 甲醇,400mL 蒸 馏水和 100mL 冰醋酸中)加热染色 15min;取出后浸入醋酸甲醇溶液(500mL 甲醇,加 400mL 蒸馏水和 100mL 冰醋酸)15min;然后浸入 10%醋酸溶液,每次 20min,至背景无色为止。 若欲进行比色,可用 0.1 mol/L NaOH 溶液浸泡 2h,在波长为 570nm 处比色。 5.氨基萘酚磺酸法 聚丙烯酰胺凝胶电泳后,把凝胶暴露于空气中几分钟,或在 2mol/L HCl 中浸一下使表 层蛋白变性,再在 0.003%氨基萘酚磺酸的 0.1mol/L 磷酸盐缓冲液(pH6.8)中染 3min,在 紫外光下可显黄绿色荧光。这样的染色可保留凝胶内部的酶和抗体的活性。如不需保留活性 时,可先在 3mol/L HCl 中浸 2min 以上使蛋白质充分变性,再染色。 二、复合蛋白质的显色反应 1.糖蛋白的显色 (1)过碘酸-Schiff 氏试剂显色法: 试剂 过碘酸液:1.2g 过碘酸溶解于 30mL 蒸馏水中,加 15mL 0.2mol/L 醋酸钠溶液及 100mL 乙醇。临用前配制,或保存在棕色瓶中,可用数日。 还原液:5g 碘化钾,5g 硫代硫酸钠溶于 100mL 蒸馏水中,加 150mL95%乙醇及 2.5mL 2mol/LHCl。现配现用。 亚硫酸品红液:2g 碱性品红溶解于 400mL 沸水中,冷却至 50℃过滤。在滤液中加入 10mL 2mol/L 盐酸和 4g 偏亚硫酸钾(K2S2O5),将瓶塞紧放在冰箱中过夜,加 1g 活性炭, 过滤,再逐渐加入 2mol/L 盐酸,直至此溶液在玻片上干后不变红色为止,保存在棕色瓶中, 冰箱贮存,当溶液变红时不可以再用

亚硫酸盐冲洗液:1mL浓硫酸,0.4g偏亚硫酸钾加入到100mL水中, 显色北魔 将含有样品的滤纸浸在70%乙醇中,片刻后吹干,在高碘酸液中浸5min,用70%乙醇 洗一次,在还原液中浸5~8min,再用70%乙醇洗一次,在亚硫酸品红液 浸2425min 用亚硫酸盐冲洗液洗三次,并用乙醇脱水后,放在玻璃板上吹干。显色结果:在黑灰色的底 板上呈现紫红色。 (2)甲苯胺蓝(Toluidine blue)显色法: 试刻 试剂甲:1.2g过碘酸溶解在30mL蒸馏水中,加15mL0.5mol/L醋酸钠和100mL96%乙 醇。现配现用。试剂乙:100mL甲醇加20ml冰醋酸及80mL蒸馏水。试剂丙:溴水。试剂 丁:10gL甲苯胺蓝水溶液。试剂戊:40gL钼酸铵溶液。 显色步骤 将点有样品的滤纸依次在试剂甲中浸15mim,试剂丙中浸15mi ,用自来水漂洗,再在 试剂丁中浸30min 来水中漂洗至没有蓝色染料渗出(约30 再依次在试剂 戊中浸3min,试剂乙中浸l5min,丙酮中浸2min后在空气中干燥。显色结果:糖蛋白部分 染成蓝色,背景带有红紫色。 (3)阿尔新蓝(Alcian blue)显色法: 聚丙烯酰胺凝胶在12.5%三氯醋酸中固定30min后,再用蒸馏水轻轻漂洗。放入1%过 镇酸液(在3%酸中)中氧化50min.用蒸馏水反复洗涤去除多余 的过碘酸盐。再放入0.59 偏重亚硫酸钾中还原剩余的过碘酸盐30min,再用蒸馏水洗涤。浸在0.5%阿尔新蓝(在3% 醋酸中)溶液中染4h。 2,酯蛋白的显色 (I)苏丹黑(Sudan black显色法 将0.1g苏丹黑B溶解于煮涕的100mL60%的乙醇溶液中,制备成饱和溶液,冷却后过 滤两次,备用。 显色时将点有样品的滤纸浸于上述溶液中,3h后取出,用50%乙醇溶液洗涤两次,每 次l5min,空气中干燥。 聚丙烯酰胺凝胶申泳中预染法:加苏丹黑B到无水乙醇中成饱和液,并震摇使乙酰化 用前过滤。按样品液的110量加入样品液中染色1h或4℃过夜。染色后的样品再进行电泳 (2)油红-0(O0i1redO)显色法: 0.04g油红溶解于100ml.60%的乙醇中,30℃放置过夜(16h)使充分饱和后,在30℃ 下滤去多余的染料,澄清液即可用于染色。 将滤纸浸入染料液中,在30℃下染色18h后,用水冲洗,使背景变浅,在空气中干燥。 脂蛋白为红色,背景为桃红色。本法在30℃以下显色时,会引起染料沉淀 第三节蛋白质的定量测定 “、凯氏定氮法 新鲜食品中含氮化合物大都以蛋白质为主体,所以检验食品中蛋白质时,往往只限于 测定总氮量,然后乘以蛋白质换算系数,即可得到蛋白质含量。凯氏定氮法可用于所有动
亚硫酸盐冲洗液: 1mL 浓硫酸,0.4g 偏亚硫酸钾加入到 100mL 水中。 显色步骤 将含有样品的滤纸浸在 70%乙醇中,片刻后吹干,在高碘酸液中浸 5min,用 70%乙醇 洗一次,在还原液中浸 5~8min,再用 70%乙醇洗一次,在亚硫酸品红液中浸 24~25min, 用亚硫酸盐冲洗液洗三次,并用乙醇脱水后,放在玻璃板上吹干。显色结果:在黑灰色的底 板上呈现紫红色。 (2)甲苯胺蓝(Toluidine blue)显色法: 试剂 试剂甲:1.2g 过碘酸溶解在 30mL 蒸馏水中,加 15mL 0.5mol/L 醋酸钠和 100mL 96%乙 醇。现配现用。试剂乙:100mL 甲醇加 20mL 冰醋酸及 80mL 蒸馏水。试剂丙:溴水。试剂 丁:10g/L 甲苯胺蓝水溶液。试剂戊:40g/L 钼酸铵溶液。 显色步骤 将点有样品的滤纸依次在试剂甲中浸 15min,试剂丙中浸 15min,用自来水漂洗,再在 试剂丁中浸 30min,自来水中漂洗至没有蓝色染料渗出(约 30~40min)后,再依次在试剂 戊中浸 3min,试剂乙中浸 15min,丙酮中浸 2min 后在空气中干燥。显色结果:糖蛋白部分 染成蓝色,背景带有红紫色。 (3)阿尔新蓝(Alcian blue )显色法: 聚丙烯酰胺凝胶在 12.5%三氯醋酸中固定 30min 后,再用蒸馏水轻轻漂洗。放入 1%过 碘酸液(在 3%醋酸中)中氧化 50min。用蒸馏水反复洗涤去除多余的过碘酸盐。再放入 0.5% 偏重亚硫酸钾中还原剩余的过碘酸盐 30min,再用蒸馏水洗涤。浸在 0.5%阿尔新蓝(在 3% 醋酸中)溶液中染 4h。 2.脂蛋白的显色 (1)苏丹黑(Sudan black)显色法: 将 0.1g 苏丹黑 B 溶解于煮沸的 100mL 60%的乙醇溶液中,制备成饱和溶液,冷却后过 滤两次,备用。 显色时将点有样品的滤纸浸于上述溶液中,3h 后取出,用 50%乙醇溶液洗涤两次,每 次 15min,空气中干燥。 聚丙烯酰胺凝胶电泳中预染法:加苏丹黑 B 到无水乙醇中成饱和液,并震摇使乙酰化。 用前过滤。按样品液的 1/10 量加入样品液中染色 1h 或 4℃过夜。染色后的样品再进行电泳。 (2)油红-O(Oil red O)显色法: 0.04g 油红溶解于 100mL60%的乙醇中,30℃放置过夜(16h)使充分饱和后,在 30℃ 下滤去多余的染料,澄清液即可用于染色。 将滤纸浸入染料液中,在 30℃下染色 18h 后,用水冲洗,使背景变浅,在空气中干燥。 脂蛋白为红色,背景为桃红色。本法在 30℃以下显色时,会引起染料沉淀。 第三节 蛋白质的定量测定 一、凯氏定氮法 新鲜食品中含氮化合物大都以蛋白质为主体,所以检验食品中蛋白质时,往往只限于 测定总氮量,然后乘以蛋白质换算系数,即可得到蛋白质含量。凯氏定氮法可用于所有动

植物食品的蛋白质含量测定,但因样品中常含有核酸、生物碱、含氮类脂、卟啉以及含氮氨色 素等非蛋白质的含氨化合物,故结果称为相蛋白质含量 量法、自动定氯仪 对前三种方法予以介绍。 1.常量凯氏定氨法 (1)原理 样品与浓硫酸和催化剂一同加热消化,使蛋白质分解,其中碳和氢被氧化成二氧化碳 和水逸出,而样品中的有机氮转化为氨与硫酸结合成硫酸铵。然后加碱蒸馏,使氨蒸出,用 硼酸吸收后再以标准盐酸或硫酸溶液滴定。根据标准酸消耗量可计算出蛋白质的含量。 ①样品消化:消化反应方程式如下 2NH (CH)COOH+13HSO =(NH),S01+6C02+12S0.+16H0 浓硫酸具有脱水性,使有机物脱水后被炭化为碳、氢、氮。 浓酸又有氧化性,将有机物炭化后的碳成为二氧化碳,硫酸则被还原成二氧化硫: 2H2S04+C= =2S02+2H,0+C021 二氧化硫使氨还原为氨,本身侧被氧化为三氧化硫,氨随之与硫酸作用生成硫酸铵留在 酸性溶液中: =(NH4)2S0 在消化反应中,为了加速蛋白质的分解,缩短消化时间,常加入下列物质: 1)硫酸钾加入硫酸钾可以提高溶液的沸点而加快有机物分解。它与硫酸作用生成 硫酸氢钾可提高反应温度,一般纯硫酸的沸点在340℃左右,而添加硫酸钾后,可使温度提 高至400℃以上,原因主要在于随者消化过程中硫酸不新地被分解,水分不断逸出而使硫酸 钾浓度增大,故沸点升高, 其反应式如下 K2S04+H2S04== =2KHSO4 2KHSO= =KS04+H,0↑+S03 但硫酸钾加入最不能太大,否则消化体系温度过高,又会引起己生成的铵盐发生热分解放出 氨而造成损失: (NH)2SO4- NH3↑+(NH)HSO △ (NH)HSO →NH↑+S01+H,0 除硫酸钾外,也可以加入硫酸钠、氯化钾等盐类来提高沸点,但效果不如硫酸钾 2)硫酸铜CuSO4 硫酸铜起催化剂的作用。凯氏定氮法中可用的催化剂种类很多 除硫酸铜外,还有氧化汞、汞、硒粉、二氧化钛等,但考虑到效果、价格及环境污染等多种 因素,应用最广泛的是硫酸铜、使用时常加入少量过氧化氢、次氯酸钾等作为氧化剂以加速 有机物氧化,硫酸铜的作用机理如下所示: 20s0,4 3CuS04+S02↑+02
植物食品的蛋白质含量测定,但因样品中常含有核酸、生物碱、含氮类脂、卟啉以及含氮色 素等非蛋白质的含氮化合物,故结果称为粗蛋白质含量。 凯氏定氮法由 Kieldahl 于 1833 年首先提出,经过长期改进,迄今已演变成常量法、微 量法、自动定氮仪法、半微量法及改良凯氏法等多种,至今仍被作为标准检验方法。下面仅 对前三种方法予以介绍。 1.常量凯氏定氮法 (1)原理 样品与浓硫酸和催化剂一同加热消化,使蛋白质分解,其中碳和氢被氧化成二氧化碳 和水逸出,而样品中的有机氮转化为氨与硫酸结合成硫酸铵。然后加碱蒸馏,使氨蒸出,用 硼酸吸收后再以标准盐酸或硫酸溶液滴定。根据标准酸消耗量可计算出蛋白质的含量。 ①样品消化:消化反应方程式如下 2NH3(CH2)2COOH + 13H2SO4 =====(NH4)2SO4 + 6CO2 + 12SO2 + 16H2O 浓硫酸具有脱水性,使有机物脱水后被炭化为碳、氢、氮。 浓硫酸又有氧化性,将有机物炭化后的碳成为二氧化碳,硫酸则被还原成二氧化硫: 2H2SO4 + C ===== 2SO2 + 2H2O + CO2↑ 二氧化硫使氮还原为氨,本身则被氧化为三氧化硫,氨随之与硫酸作用生成硫酸铵留在 酸性溶液中: H2SO4 + 2NH3 =====(NH4)2SO4 在消化反应中,为了加速蛋白质的分解,缩短消化时间,常加入下列物质: 1)硫酸钾 加入硫酸钾可以提高溶液的沸点而加快有机物分解。它与硫酸作用生成 硫酸氢钾可提高反应温度,一般纯硫酸的沸点在 340℃左右,而添加硫酸钾后,可使温度提 高至 400℃以上,原因主要在于随着消化过程中硫酸不断地被分解,水分不断逸出而使硫酸 钾浓度增大,故沸点升高,其反应式如下: K2SO4 + H2SO4 ===== 2KHSO4 2KHSO4 ===== K2SO4 + H2O↑+ SO3 但硫酸钾加入量不能太大,否则消化体系温度过高,又会引起已生成的铵盐发生热分解放出 氨而造成损失: (NH4)2SO4 NH3↑+(NH4)HSO4 (NH4)HSO4 NH3↑+ SO3↑+ H2O 除硫酸钾外,也可以加入硫酸钠、氯化钾等盐类来提高沸点,但效果不如硫酸钾。 2)硫酸铜 CuSO4 硫酸铜起催化剂的作用。凯氏定氮法中可用的催化剂种类很多, 除硫酸铜外,还有氧化汞、汞、硒粉、二氧化钛等,但考虑到效果、价格及环境污染等多种 因素,应用最广泛的是硫酸铜、使用时常加入少量过氧化氢、次氯酸钾等作为氧化剂以加速 有机物氧化,硫酸铜的作用机理如下所示: 2CuSO4 Cu2SO4 + SO2↑+ O2
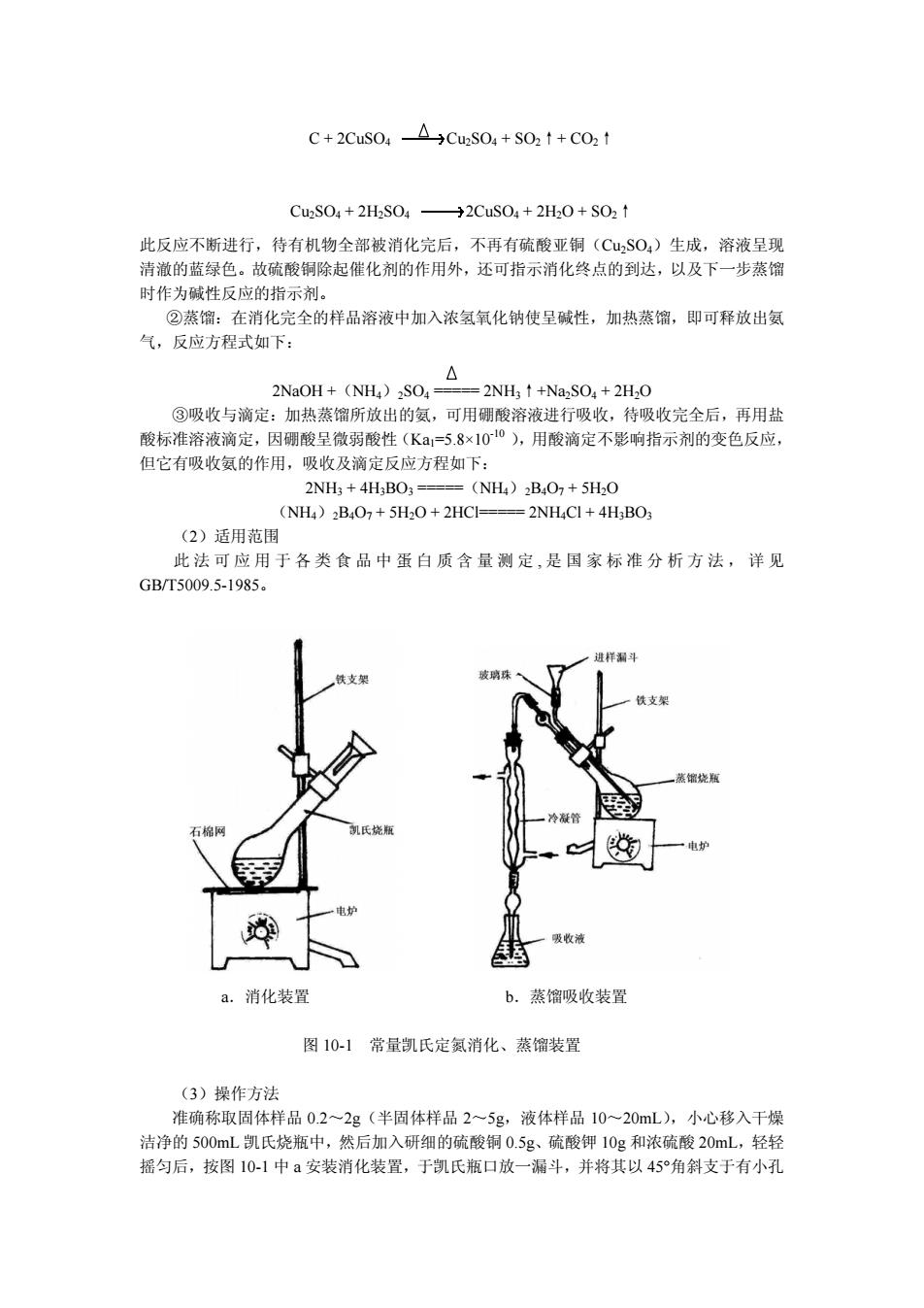
C+2CuSO-ACu:SO+SO:1+CO:t C2S04+2H2S04→2CuS04+2H20+S021 此反应不断进行,待有机物全部被消化完后,不再有硫酸亚铜(CuSO)生成,溶液呈现 清澈的蓝绿色。故硫酸铜除起催化剂的作用外,还可指示消化终点的到达,以及下一步蒸馏 时作为碱性反应的指示剂。 ②燕馏:在消化完全的样品溶液中加入浓氧氧化钠使呈碱性,加热蒸馏,即可释放出氨 气,反应方程式如下: △ 2NaOH+(NH)SO. =2NH2↑+NaSO+2H,0 ③吸收与滴定:加热蒸馏所放出的氨,可用硼酸溶液进行吸收,待吸收完全后,再用盐 酸标准溶液滴定 因硼酸呈微弱酸性(Ka1=5.8×100),用酸滴定不影响指示剂的变色反应 但它有吸收氨的作用,吸收及滴定反应方程如下: 2NH3 +4H3BO3 ==(NH)2B4O7+5H2O (NHA)BO+5HO+2HCI-2NHCI+4HBO (2)话用范围 此法可应用于各类食品中蛋白质含量测定,是国家标准分析方法,详见 GB/T5009.5-1985 a.消化装置 b.蒸馏吸收装置 图10-1常量凯氏定氮消化、蒸馏装置 (3)操作方法 准确称取固体样品0.2~2g(半固体样品2~5g,液体样品10~20mL),小心移入干燥 洁净的500mL凯氏烧瓶中,然后加入研细的硫酸铜0.5g、硫酸钾10g和浓硫酸20mL,轻轻 摇匀后,按图10-1中a安装消化装置,于凯氏瓶口放一漏斗,并将其以45°角斜支于有小孔
C + 2CuSO4 Cu2SO4 + SO2↑+ CO2↑ Cu2SO4 + 2H2SO4 2CuSO4 + 2H2O + SO2↑ 此反应不断进行,待有机物全部被消化完后,不再有硫酸亚铜(Cu2SO4)生成,溶液呈现 清澈的蓝绿色。故硫酸铜除起催化剂的作用外,还可指示消化终点的到达,以及下一步蒸馏 时作为碱性反应的指示剂。 ②蒸馏:在消化完全的样品溶液中加入浓氢氧化钠使呈碱性,加热蒸馏,即可释放出氨 气,反应方程式如下: 2NaOH +(NH4)2SO4 ===== 2NH3↑+Na2SO4 + 2H2O ③吸收与滴定:加热蒸馏所放出的氨,可用硼酸溶液进行吸收,待吸收完全后,再用盐 酸标准溶液滴定,因硼酸呈微弱酸性(Ka1=5.8×10-10 ),用酸滴定不影响指示剂的变色反应, 但它有吸收氨的作用,吸收及滴定反应方程如下: 2NH3 + 4H3BO3 =====(NH4)2B4O7 + 5H2O (NH4)2B4O7 + 5H2O + 2HCl===== 2NH4Cl + 4H3BO3 (2)适用范围 此法可应用于各类食品中蛋白质含量测定 , 是国家标准分析方法,详见 GB/T5009.5-1985。 a.消化装置 b.蒸馏吸收装置 图 10-1 常量凯氏定氮消化、蒸馏装置 (3)操作方法 准确称取固体样品 0.2~2g(半固体样品 2~5g,液体样品 10~20mL),小心移入干燥 洁净的 500mL 凯氏烧瓶中,然后加入研细的硫酸铜 0.5g、硫酸钾 10g 和浓硫酸 20mL,轻轻 摇匀后,按图 10-1 中 a 安装消化装置,于凯氏瓶口放一漏斗,并将其以 45°角斜支于有小孔

的石棉网上。用电炉以小火加热,待内容物全部炭化,泡沫停止产生后,加大火力,保持瓶 内液体微沸,至液体变蓝绿色透明后,再继续加热微沸30min。冷却,小心加入200mL蒸 馏水 ,加入玻璃珠数粒以防蒸馏时暴沸」 将凯氏烧瓶按图10-13 式连好 塞紧瓶口,冷凝管下端插入吸收瓶液面下(瓶 内预先装入50mL40gL硼酸溶液及混合指示剂2~3滴).放松夹子,通过漏斗加入70~80ml 4O0gL氢氧化钠溶液,并摇动凯氏瓶,至瓶内溶液变为深蓝色,或产生黑色沉淀,再加入 100mL蒸馏水(从漏斗中加入),夹紧夹子,加热蒸馏,至氨全部蒸出(馏液约250mL即可), 将冷凝管下端提离液面,用蒸馏水冲洗管口,继续蒸馏lmi,用表面皿接几滴馏出液,以 奈氏试剂检查,如无红棕色物生成, 表示蒸馏完毕, 即可停 上加热 将上述吸收液用0.1000molL盐酸标准溶液直接滴定至由蓝色变为微红色即为终点,记 录盐酸溶液用量,同时作一试剂空白(除不加样品外,从消化开始操作完全相同),记录空 白试验消耗盐酸标准溶液的体积。 (4)结果计算 蛋白质(g100g)= x(-W画 x星x100 式中: -盐酸标准溶液的浓度,moL: 滴定样品吸收液时消耗盐酸标准溶液体积,mL: V E 空白吸收液时消耗盐酸标准溶液体积,mL 样品质量,g M -氨的摩尔质量,14.01gmoL: 下一一氨换算为蛋白质的系数。 (S)说明及注意事项 ①所用试剂溶液应用无氨蒸馏水配制 ②消化时不要用强火,应保持和缓沸腾,以免粘附在凯氏瓶内壁上的含氮化合物在无硫 酸存在的情况下未消化完全而造成氮损失。 ③消化过程中应注意不时转动凯氏烧瓶,以便利用冷凝酸液将附在瓶壁上的固体残渣洗 下并促进其消化完全。 ④样品中若含脂肪或糖较多时,消化过程中易产生大量泡沫,为防止泡沫溢出瓶外,在 开始消化时应用小火加热,并不停地摇动:或者加入少量辛醇或液体石蜡或硅油消泡剂,并 同时注意控制热源强度。 ⑤当样品消化液不易澄清透明时,可将凯氏烧瓶冷却,加入30%过氧化氢2~3mL后再 继续加热消化。 ⑧若取样量较大,如干试样超5,可按每点试样SmL的比例增加硫酸用量 一般消化至呈透明后 ,继续消化30min即可, 但对于含有特别难以氨化的氨化合物 的样品,如含赖氨酸、组氨酸、色氨酸、酪氨酸或脯氨酸等时,需适当延长消化时间。有机 物如分解完全,消化液呈蓝色或浅绿色,但含铁量多时,呈较深绿色。 ⑧蒸馏装置不能漏气。 ©蒸馏前若加诚量不足,消化液呈蓝色不生成氨氧化铜沉淀,此时需再增加氨氧化钠用 最。 ⑩硼酸吸收液的温度不应超过40℃,否则对氨的吸收作用减弱而造成损失,此时可置 于冷水浴中使用。 ①蒸馏完毕后,应先将冷凝管下端提离液面清洗管口,再蒸1mi后关掉热源,否则可
的石棉网上。用电炉以小火加热,待内容物全部炭化,泡沫停止产生后,加大火力,保持瓶 内液体微沸,至液体变蓝绿色透明后,再继续加热微沸 30min。冷却,小心加入 200mL 蒸 馏水,再放冷,加入玻璃珠数粒以防蒸馏时暴沸。 将凯氏烧瓶按图 10-1 蒸馏装置方式连好,塞紧瓶口,冷凝管下端插入吸收瓶液面下(瓶 内预先装入50mL 40g/L硼酸溶液及混合指示剂2~3滴)。放松夹子,通过漏斗加入70~80mL 400g/L 氢氧化钠溶液,并摇动凯氏瓶,至瓶内溶液变为深蓝色,或产生黑色沉淀,再加入 100mL 蒸馏水(从漏斗中加入),夹紧夹子,加热蒸馏,至氨全部蒸出(馏液约 250mL 即可), 将冷凝管下端提离液面,用蒸馏水冲洗管口,继续蒸馏 1min,用表面皿接几滴馏出液,以 奈氏试剂检查,如无红棕色物生成,表示蒸馏完毕,即可停止加热。 将上述吸收液用 0.1000mol/L 盐酸标准溶液直接滴定至由蓝色变为微红色即为终点,记 录盐酸溶液用量,同时作一试剂空白(除不加样品外,从消化开始操作完全相同),记录空 白试验消耗盐酸标准溶液的体积。 (4)结果计算 蛋白质(g/100g)= 式中:c——盐酸标准溶液的浓度,mol/L; V1——滴定样品吸收液时消耗盐酸标准溶液体积,mL; V2——滴定空白吸收液时消耗盐酸标准溶液体积,mL; m——样品质量,g; M 氮——氮的摩尔质量,14.01g/moL; F——氮换算为蛋白质的系数。 (5)说明及注意事项 ①所用试剂溶液应用无氨蒸馏水配制。 ②消化时不要用强火,应保持和缓沸腾,以免粘附在凯氏瓶内壁上的含氮化合物在无硫 酸存在的情况下未消化完全而造成氮损失。 ③消化过程中应注意不时转动凯氏烧瓶,以便利用冷凝酸液将附在瓶壁上的固体残渣洗 下并促进其消化完全。 ④样品中若含脂肪或糖较多时,消化过程中易产生大量泡沫,为防止泡沫溢出瓶外,在 开始消化时应用小火加热,并不停地摇动;或者加入少量辛醇或液体石蜡或硅油消泡剂,并 同时注意控制热源强度。 ⑤当样品消化液不易澄清透明时,可将凯氏烧瓶冷却,加入 30%过氧化氢 2~3mL 后再 继续加热消化。 ⑥若取样量较大,如干试样超过 5g,可按每克试样 5mL 的比例增加硫酸用量。 ⑦一般消化至呈透明后,继续消化 30min 即可,但对于含有特别难以氨化的氮化合物 的样品,如含赖氨酸、组氨酸、色氨酸、酪氨酸或脯氨酸等时,需适当延长消化时间。有机 物如分解完全,消化液呈蓝色或浅绿色,但含铁量多时,呈较深绿色。 ⑧蒸馏装置不能漏气。 ⑨蒸馏前若加碱量不足,消化液呈蓝色不生成氢氧化铜沉淀,此时需再增加氢氧化钠用 量。 ⑩硼酸吸收液的温度不应超过 40℃,否则对氨的吸收作用减弱而造成损失,此时可置 于冷水浴中使用。 ○11 蒸馏完毕后,应先将冷凝管下端提离液面清洗管口,再蒸 1min 后关掉热源,否则可
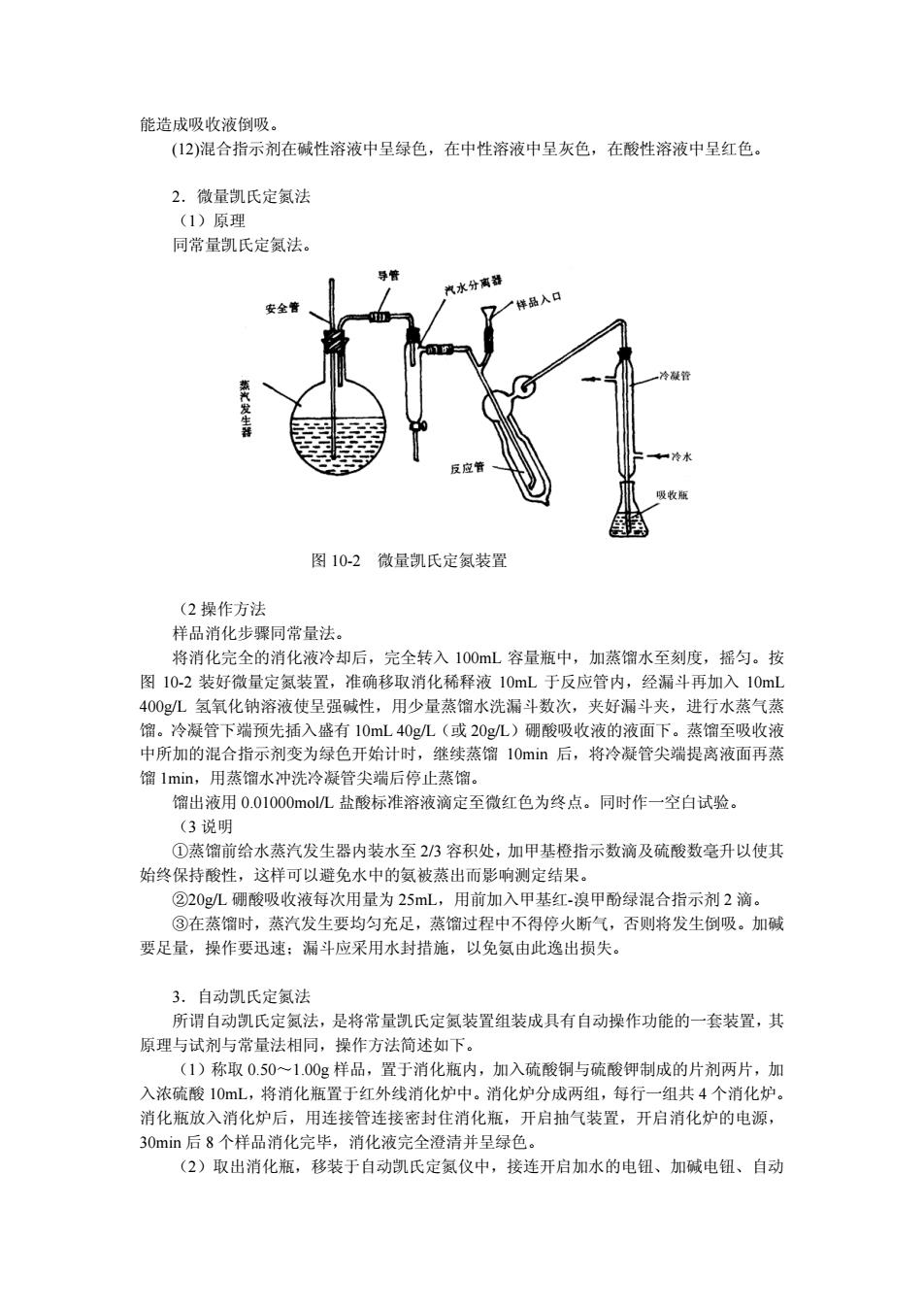
能造成吸收液倒吸 (2)混合指示剂在碱性溶液中呈绿色,在中性溶液中呈灰色,在酸性溶液中呈红色。 2.微量凯氏定氮法 (1)原理 同常量凯氏定氨法。 汽水分离 要全1 图10-2微量凯氏定氨装省 (2操作方法 样品消化步骤同常量法, 将消化完全的消化液冷却后,完全转入100L容量瓶中,加蒸榴水至刻度,摇匀。按 图10,2装好微量定氨装置,准确移取消化稀释液10mL于反应管内,经漏斗再加入10m 400gL氢氧化钠溶液使呈强碱性,用少量蒸馏水洗漏斗数次,夹好漏斗夹,进行水蒸气 馏。冷凝管下端预先插入盛有10mL40eL(或20g/L)硼酸吸收液的液面下。蒸馏至吸收液 中所加的混合指示剂变为绿色开始计时,继续蒸馏10min后,将冷凝管尖端提离液面再蒸 馏lmin,用蒸馏水冲洗冷凝管尖端后停止蒸馏。 榴出液用001000m01盐酸标准溶液滴定至微红伍为终点。同时作一空白试哈 说明 ①蒸馏前给水蒸汽发生器内装水至23容积处,加甲基橙指示数滴及硫酸数毫升以使其 始终保持酸性,这样可以避免水中的氨被蒸出而影响测定结果。 ②20gL硼酸吸收液每次用量为25mL,用前加入甲基红-溴甲酚绿混合指示剂2滴。 ③在蒸馏时,蒸汽发生要均匀充足,蒸馆过程中不得停火断气,否则将发生倒吸。加碱 要足量,操作要迅速:漏斗应采用水封措施,以免氨由此逸出损失 3,自动凯氏定氨法 所谓自动凯氏定氨法,是将常最凯氏定氨装置组装成具有自动操作功能的一套装置,其 原理与试剂与常量法相同,操作方法简述如下。 (1)称取0.50一1.00g样品,置于消化瓶内,加入硫酸铜与硫酸钾制成的片剂两片,加 入浓硫酸10mL,将消化瓶置于红乡 消化 消化炉分成两组 ,每行 一组共 个消化炉 消化瓶放入消化炉后,用连接管连接密封住消化瓶,开启抽气装置,开启消化炉的电源, 30min后8个样品消化完毕,消化液完全澄清并呈绿色。 (2)取出消化瓶,移装于自动凯氏定氨仪中,接连开启加水的电钮、加碱电钮、自动
能造成吸收液倒吸。 (12)混合指示剂在碱性溶液中呈绿色,在中性溶液中呈灰色,在酸性溶液中呈红色。 2.微量凯氏定氮法 (1)原理 同常量凯氏定氮法。 图 10-2 微量凯氏定氮装置 (2 操作方法 样品消化步骤同常量法。 将消化完全的消化液冷却后,完全转入 100mL 容量瓶中,加蒸馏水至刻度,摇匀。按 图 10-2 装好微量定氮装置,准确移取消化稀释液 10mL 于反应管内,经漏斗再加入 10mL 400g/L 氢氧化钠溶液使呈强碱性,用少量蒸馏水洗漏斗数次,夹好漏斗夹,进行水蒸气蒸 馏。冷凝管下端预先插入盛有 10mL 40g/L(或 20g/L)硼酸吸收液的液面下。蒸馏至吸收液 中所加的混合指示剂变为绿色开始计时,继续蒸馏 10min 后,将冷凝管尖端提离液面再蒸 馏 1min,用蒸馏水冲洗冷凝管尖端后停止蒸馏。 馏出液用 0.01000mol/L 盐酸标准溶液滴定至微红色为终点。同时作一空白试验。 (3 说明 ①蒸馏前给水蒸汽发生器内装水至 2/3 容积处,加甲基橙指示数滴及硫酸数毫升以使其 始终保持酸性,这样可以避免水中的氨被蒸出而影响测定结果。 ②20g/L 硼酸吸收液每次用量为 25mL,用前加入甲基红-溴甲酚绿混合指示剂 2 滴。 ③在蒸馏时,蒸汽发生要均匀充足,蒸馏过程中不得停火断气,否则将发生倒吸。加碱 要足量,操作要迅速;漏斗应采用水封措施,以免氨由此逸出损失。 3.自动凯氏定氮法 所谓自动凯氏定氮法,是将常量凯氏定氮装置组装成具有自动操作功能的一套装置,其 原理与试剂与常量法相同,操作方法简述如下。 (1)称取 0.50~1.00g 样品,置于消化瓶内,加入硫酸铜与硫酸钾制成的片剂两片,加 入浓硫酸 10mL,将消化瓶置于红外线消化炉中。消化炉分成两组,每行一组共 4 个消化炉。 消化瓶放入消化炉后,用连接管连接密封住消化瓶,开启抽气装置,开启消化炉的电源, 30min 后 8 个样品消化完毕,消化液完全澄清并呈绿色。 (2)取出消化瓶,移装于自动凯氏定氮仪中,接连开启加水的电钮、加碱电钮、自动

蒸馏滴定电钮,开启电源,大约经12m后由数显装置即可给出样品总氮百分含量,并记 录样品总氨百分比。根据样品的种类选择相应的蛋白质换算系数F,即可得出样品中蛋白质 含量 (3)开启排废液电钮及加水电钮,排出废液并对消化瓶清洗一次 大约在2h左右时间内可完成8个样品的蛋白质含量测定工作。该法具有灵敏、准确、 快速及样品用量少等优点。 二、双缩脲法 1.原理 当脲被小心地加热至150~160℃时,可由两个分子间脱去一个氨分子而生成二缩脲(也 叫双缩眠),反应如下: +H-N(H)-CO-NH2>H2NCONHCONH2+NH, 双缩脲与碱及少量硫酸铜溶液作用生成紫红色的配合物,此反应称为双缩脲反应 OH OH 2 NH-CΓHN NH CuSO 0- C=0 NH 0=C NaoH 0=C C=0 NH: NH-Na NaHaN OH OH (红色配合物 由于蛋白质分子中含有肽键 (-CO-NH-) 与双缩脲结构相似,故也能呈现此反应而生 成紫红色配合物,在一定条件下其颜色深浅与蛋白质含最成正比,据此可用吸收光度法来测 定蛋白质含量,该配合物的最大吸收波长为560nm。 2.方法特点及应用范围 本法灵敏度较低,但操作简单快速,故在生物化学领域中测定蛋白质含量时常用此法 本法亦适用于豆类、油料、米谷等作物种子及肉类等样品测定】 3.操作方法 ①标准曲线的绘制:以采用凯氏定氨法测出蛋白质含量的样品作为标准蛋白质样。按蛋 白质含量40mg、50mg、60mg、70mg、80mg、90mg、100mg、110mg分别称取混合均匀的 标准蛋白质样于8支50mL纳氏比色管中,然后客加入1mL四氯化碳,再用碱性硫酸铜蓉 液准确稀释至50mL,振摇10m ,静置1h,取上层清液离心5min 取离心分离后的透明液 于比色皿中,在560m波长下以蒸馏水作参比液调节仪器零点并测定各溶液的吸光度A 以蛋白质的含量为横坐标,吸光度A为纵坐标绘制标准曲线。 ②样品的测定。准确称取样品适量(即使得蛋白质含量在40~110mg之间)于50mL 纳氏比色管中,加1mL四氯化碳,按上述步骤显色后,在相同条件下测其吸光度A。用测 得的A值在标准曲线上即可查得蛋白质毫克数,进而由此求得样品中的蛋白质含量。 4.结果计算 蛋白质(mg1o0g)=Y1c
蒸馏滴定电钮,开启电源,大约经 12min 后由数显装置即可给出样品总氮百分含量,并记 录样品总氮百分比。根据样品的种类选择相应的蛋白质换算系数 F,即可得出样品中蛋白质 含量。 (3)开启排废液电钮及加水电钮,排出废液并对消化瓶清洗一次。 大约在 2h 左右时间内可完成 8 个样品的蛋白质含量测定工作。该法具有灵敏、准确、 快速及样品用量少等优点。 二、双缩脲法 1.原理 当脲被小心地加热至 150~160℃时,可由两个分子间脱去一个氨分子而生成二缩脲(也 叫双缩脲),反应如下: H2NCONH2 + H-N(H)-CO-NH2 H2NCONHCONH2 + NH3 双缩脲与碱及少量硫酸铜溶液作用生成紫红色的配合物,此反应称为双缩脲反应: O=C NH2 NH O=C NH2 2 CuSO4 NaOH O=C NH2 NH O=C NH2Na OH OH HN C=O C=O NaH2N OH H2N OH Cu (双缩脲) (紫红色配合物) 由于蛋白质分子中含有肽键(-CO-NH-),与双缩脲结构相似,故也能呈现此反应而生 成紫红色配合物,在一定条件下其颜色深浅与蛋白质含量成正比,据此可用吸收光度法来测 定蛋白质含量,该配合物的最大吸收波长为 560nm。 2.方法特点及应用范围 本法灵敏度较低,但操作简单快速,故在生物化学领域中测定蛋白质含量时常用此法。 本法亦适用于豆类、油料、米谷等作物种子及肉类等样品测定。 3.操作方法 ①标准曲线的绘制:以采用凯氏定氮法测出蛋白质含量的样品作为标准蛋白质样。按蛋 白质含量 40mg、50mg、60mg、70mg、80mg、90mg、100mg、110mg 分别称取混合均匀的 标准蛋白质样于 8 支 50mL 纳氏比色管中,然后各加入 1mL 四氯化碳,再用碱性硫酸铜溶 液准确稀释至 50mL,振摇 10min,静置 1h,取上层清液离心 5min,取离心分离后的透明液 于比色皿中,在 560nm 波长下以蒸馏水作参比液调节仪器零点并测定各溶液的吸光度 A, 以蛋白质的含量为横坐标,吸光度 A 为纵坐标绘制标准曲线。 ②样品的测定。准确称取样品适量(即使得蛋白质含量在 40~110mg 之间)于 50mL 纳氏比色管中,加 1mL 四氯化碳,按上述步骤显色后,在相同条件下测其吸光度 A。用测 得的 A 值在标准曲线上即可查得蛋白质毫克数,进而由此求得样品中的蛋白质含量。 4.结果计算 蛋白质(mg/100g)=