
微丝染色及形态观察 [目的要求] 1.掌握微丝的染色方法 2.了解光镜下微丝的基本形态结构。 3.了解细胞松弛素B对微丝的作用及原理
[目的要求] 1. 掌握微丝的染色方法。 2. 了解光镜下微丝的基本形态结构。 3. 了解细胞松弛素B对微丝的作用及原理。 微丝染色及形态观察

[实验原理] 真核细胞质中纵横交错的纤维网称为细胞骨架, 在维持细胞形状和运动方面具有重要作用。根据组成 成分和组装结构的不同,可将细胞骨架分为微管、微 丝和中间纤维。微丝普遍存在于多种细胞,对细胞的 形状和运动有一定作用。微丝由蛋白单体聚合形成 细胞松驰素B可与微丝的亚单位肌动蛋白结合,从而 破坏微丝,改变细胞的形状。细胞松弛素B对微丝的 作用具有可逆性
[实验原理] 真核细胞质中纵横交错的纤维网称为细胞骨架, 在维持细胞形状和运动方面具有重要作用。根据组成 成分和组装结构的不同,可将细胞骨架分为微管、微 丝和中间纤维。微丝普遍存在于多种细胞,对细胞的 形状和运动有一定作用。微丝由蛋白单体聚合形成, 细胞松驰素B可与微丝的亚单位肌动蛋白结合,从而 破坏微丝,改变细胞的形状。细胞松弛素B对微丝的 作用具有可逆性

当细胞用TritonX-100溶液处理,能够溶解质 膜结构中及细胞内许多蛋白质,而细胞骨架中的 蛋白质却不被破坏,经固定和考马斯亮蓝(非特 异性蛋白质染料)染色后,胞质背景着色弱,微 管等蛋白结构在光镜下无法分辨,在光镜下观察 到主要是由微丝组成的应力纤维 。 应力纤维由平行排列的微丝组成,体外培养的 贴壁细胞应力纤维尤为发达,形态长而直,常与 细胞长轴平行并贯穿细胞全长
当细胞用TritonX-100溶液处理,能够溶解质 膜结构中及细胞内许多蛋白质,而细胞骨架中的 蛋白质却不被破坏,经固定和考马斯亮蓝(非特 异性蛋白质染料)染色后,胞质背景着色弱,微 管等蛋白结构在光镜下无法分辨,在光镜下观察 到主要是由微丝组成的应力纤维。 应力纤维由平行排列的微丝组成,体外培养的 贴壁细胞应力纤维尤为发达,形态长而直,常与 细胞长轴平行并贯穿细胞全长
Key to Cytoskeletal Functions (1Structure and Support 2) Intracellular Transport (3)Contrac面y and Motility y(4)Spatial Organization Actin filaments Actin faments 2 31 Motorroten Intermediate Microtubdle flament Intermediate flaments Nerve cell 时 Motor proten Actin fiaments Microtubule 2 2 Microtubule Motor proten 3 a Epithelial cell d Dividing cell

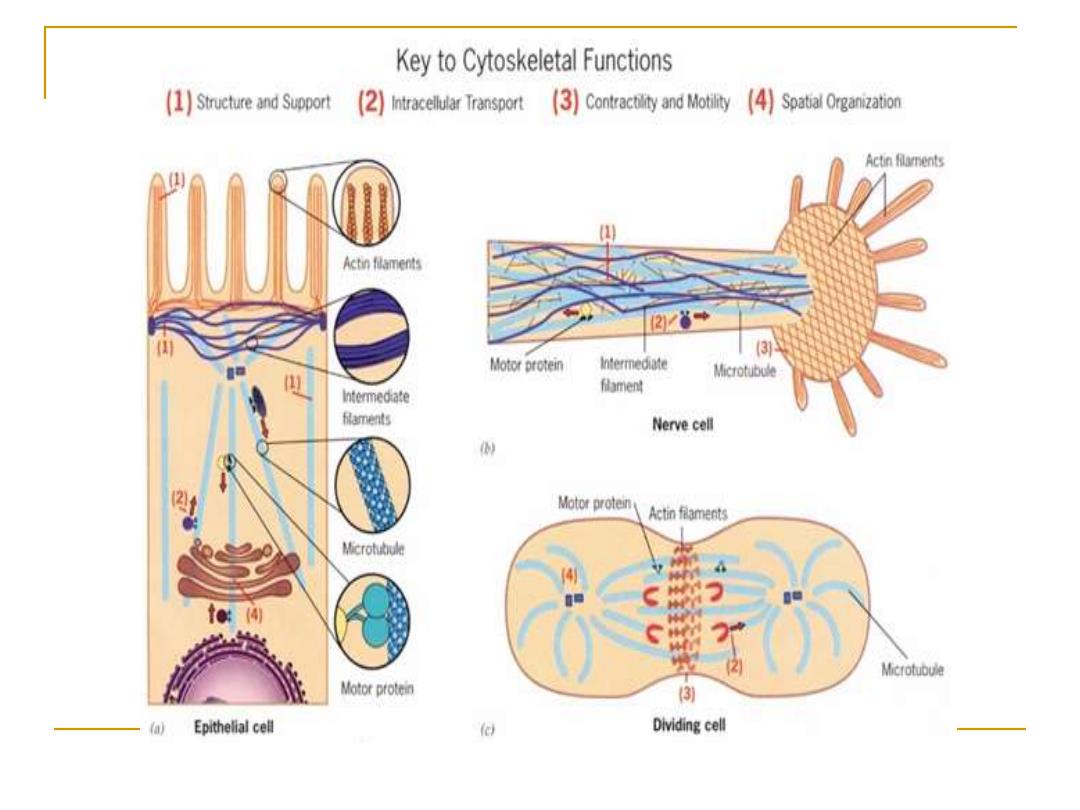
微丝在细胞内的分布特征
微丝在细胞内的分布特征

实验用品] 器具:CO,恒温培养箱、倒置显微镜、超净工作台、 低速离心机、普通光学显微镜、移液器、恒温箱、 镊子、培养皿、载玻片、盖玻片、吸水纸。 ■材料:盖玻片培养的成纤维细胞 试剂:6mmol/LPBS(pH6.5)、1%TritonX-100 溶液、M-缓冲液、3%戊二醛固定液、0.2%考马斯 亮蓝染液、100μg/ml的细胞松弛素B、DMEM培养 液
[实验用品] ◼ 器具:CO2恒温培养箱、倒置显微镜、超净工作台、 低速离心机、普通光学显微镜、移液器、恒温箱、 镊子、培养皿、载玻片、盖玻片、吸水纸。 ◼ 材料:盖玻片培养的成纤维细胞 ◼ 试剂:6 mmol/L PBS(pH 6.5)、1%TritonX-100 溶液、M-缓冲液、3%戊二醛固定液、0.2%考马斯 亮蓝染液、100μg /ml的细胞松弛素B、DMEM培养 液

实验步骤! 1.培养在成纤维细胞进行传代培养时,将已消毒的盖 玻片涂上多聚赖氨酸,放入培养皿中,于37℃、 5%C02的温箱中生长24h~48h。 (设正常生长组和细胞松弛素B处理组) 2.染色处理 (1)取材取出铺有细胞的盖玻片,放入小培养皿中 (正面向上),用PBS洗3次(从盖玻片一角轻轻滴 加3~4滴),洗去表面的培养液。 (2)抽提吸弃PBS,加入1%Triton X-100液4-5滴 ( 刚好覆盖盖玻片表面),室温处理25~30min (或置3718min)
[实验步骤] 1. 培养 在成纤维细胞进行传代培养时,将已消毒的盖 玻片涂上多聚赖氨酸,放入培养皿中,于37℃、 5%CO2的温箱中生长24h~48h。 (设正常生长组和细胞松弛素B处理组) 2. 染色处理 (1)取材 取出铺有细胞的盖玻片,放入小培养皿中 (正面向上),用PBS洗3次(从盖玻片一角轻轻滴 加3 4滴),洗去表面的培养液。 (2)抽提 吸弃PBS,加入1% Triton X-100液4-5滴 (刚好覆盖盖玻片表面),室温处理25 ~30min (或置37℃18min)

(3)稳定吸弃Triton X-100,立即用M-缓冲液轻 轻地洗涤3次,每次3min。 (4)固定略晾干,在3%戊二醛液中固定10min, 再以PBS液洗3次,洗去固定液。 (5)染色滴加3-5滴0.2%考马斯亮兰染液染色20~ 30min,然后小心的用自来水漂洗。 (6)观察留取少量水分封片于载玻片,吸水 纸吸去多余的水。光镜下观察临时装片
(3)稳定 吸弃Triton X-100,立即用M-缓冲液轻 轻地洗涤3次,每次3min。 (4)固定 略晾干,在3%戊二醛液中固定10min, 再以PBS液洗3次,洗去固定液。 (5)染色 滴加3-5滴0.2%考马斯亮兰染液染色20 30min,然后小心的用自来水漂洗。 (6)观察 留取少量水分封片于载玻片,吸水 纸吸去多余的水。光镜下观察临时装片

实验结果] 光镜观察,微丝聚集成的应力纤维束被染成蓝色 在没用药的标本上,成纤维细胞多数有突起,微 丝沿突起规则排列;用细胞松弛素B处理的标本 由于微丝被破坏、突起缩回。多数细胞形状变圆; 用药处理后又洗去药的标本,由于解除了药的作 用,肌动蛋白重新聚合成微丝,细胞形状恢复正 常
[实验结果] ◼ 光镜观察,微丝聚集成的应力纤维束被染成蓝色, 在没用药的标本上,成纤维细胞多数有突起,微 丝沿突起规则排列;用细胞松弛素B处理的标本, 由于微丝被破坏、突起缩回。多数细胞形状变圆; 用药处理后又洗去药的标本,由于解除了药的作 用,肌动蛋白重新聚合成微丝,细胞形状恢复正 常

■1·光镜下观察被染成蓝色的微丝聚集成的应力纤 维束(注意成纤维细胞中微丝分布的特点)。 ·2.注意观察正常对照片与用药处理后的标本成纤 维细胞形状的区别。 3.观察用药处理后又洗去药的标本中细胞形态是 否恢复正常
◼ 1.光镜下观察被染成蓝色的微丝聚集成的应力纤 维束(注意成纤维细胞中微丝分布的特点)。 ◼ 2.注意观察正常对照片与用药处理后的标本成纤 维细胞形状的区别。 ◼ 3.观察用药处理后又洗去药的标本中细胞形态是 否恢复正常