
细胞器的分级分离 [目的要求] 1.掌握差速离心法和密度梯度离心法的原理 2.熟悉哺乳动物细胞的细胞核、线粒体分离和纯 化的实验方法
[目的要求] ◼ 1.掌握差速离心法和密度梯度离心法的原理。 ◼ 2.熟悉哺乳动物细胞的细胞核、线粒体分离和纯 化的实验方法。 细胞器的分级分离

实验原理] 球形颗粒的沉降速率取决于其密度、半径、介质 黏度和离心力。 差速离心法(differential centrifugation)是将细 胞匀浆在密度均一的介质中从低速到高速离心,较大 颗粒先在低速离心时沉淀,再用高速离心沉淀上清液 中的小颗粒物质,从而达到逐级分离细胞器的目的。 密度梯度离心法(density gradient centrifugation)是一定介质形成一连续或不连续的密 度梯度,顶部的细胞匀浆在重力或离心力场的作用下 分层、分离。一般先通过差速离心法将细胞器初步分 离,再进一步通过密度梯度离心法分离纯化细胞器
[实验原理] 球形颗粒的沉降速率取决于其密度、半径、介质 黏度和离心力。 差速离心法(differential centrifugation)是将细 胞匀浆在密度均一的介质中从低速到高速离心,较大 颗粒先在低速离心时沉淀,再用高速离心沉淀上清液 中的小颗粒物质,从而达到逐级分离细胞器的目的。 密度梯度离心法(density gradient centrifugation)是一定介质形成一连续或不连续的密 度梯度,顶部的细胞匀浆在重力或离心力场的作用下 分层、分离。一般先通过差速离心法将细胞器初步分 离,再进一步通过密度梯度离心法分离纯化细胞器

细胞器的分离常通过组织细胞匀浆、分级分 离和分析三个步骤完成。 分级分离方法有两种,即:差速离心法和密 度梯度离心法
细胞器的分离常通过组织细胞匀浆、分级分 离和分析三个步骤完成。 分级分离方法有两种,即:差速离心法和密 度梯度离心法

[实验用品] 1. 器具:玻璃匀浆器、低速离心机、高速冷冻离心 机、天平、普通光学显微镜、1.5mlEp管、载玻片 10ml滴管、冰盒、冰块、滤网、染缸、20ml烧杯 2.材料:大白鼠。 3.试剂:生理盐水、PBS、0.25mo/L的蔗糖溶液、 0.34mo/L蔗糖-0.5mmo/LMg(Ac)2溶液、0.88 mol/L蔗糖-0.5 mmol/L Mg(Ac)2溶液、95%乙醇、 甲基绿-派洛宁染液、丙酮、02%的詹纳斯绿B
[实验用品] 1.器具:玻璃匀浆器、低速离心机、高速冷冻离心 机、天平、普通光学显微镜、1.5 ml Ep管、载玻片、 10 ml滴管、冰盒、冰块、滤网、染缸、20 ml烧杯。 2.材料:大白鼠。 3. 试剂:生理盐水、PBS、0.25 mol/L的蔗糖溶液、 0.34 mol/L蔗糖-0.5 mmol/L Mg(Ac)2溶液、0.88 mol/L蔗糖-0.5 mmol/L Mg(Ac)2溶液、95%乙醇、 甲基绿-派洛宁染液、丙酮、0.2%的詹纳斯绿B

[实验步骤] 1.组织匀浆制备 (1)取材将空腹12~24h的大鼠处死。剖开腹部 迅速取出肝脏,用预冷的生理盐水洗净血污,用 滤纸吸干。 (2)制备匀浆称取约1~2g左右的肝组织,用预冷 的0.25mol/儿的蔗糖溶液冲洗数次,剪碎。以预 冷的0.25mol/儿的蔗糖溶液悬浮剪碎的组织,移 入匀浆器内,在冰浴条件下匀浆。匀浆完成后 用滤网过滤,即制得肝细胞匀浆,备用
[实验步骤] 1.组织匀浆制备 (1)取材 将空腹12~24 h的大鼠处死。剖开腹部, 迅速取出肝脏,用预冷的生理盐水洗净血污,用 滤纸吸干。 (2)制备匀浆 称取约1~2 g左右的肝组织,用预冷 的0.25 mol/L的蔗糖溶液冲洗数次,剪碎。以预 冷的0.25 mol/L的蔗糖溶液悬浮剪碎的组织,移 入匀浆器内,在冰浴条件下匀浆。匀浆完成后, 用滤网过滤,即制得肝细胞匀浆,备用
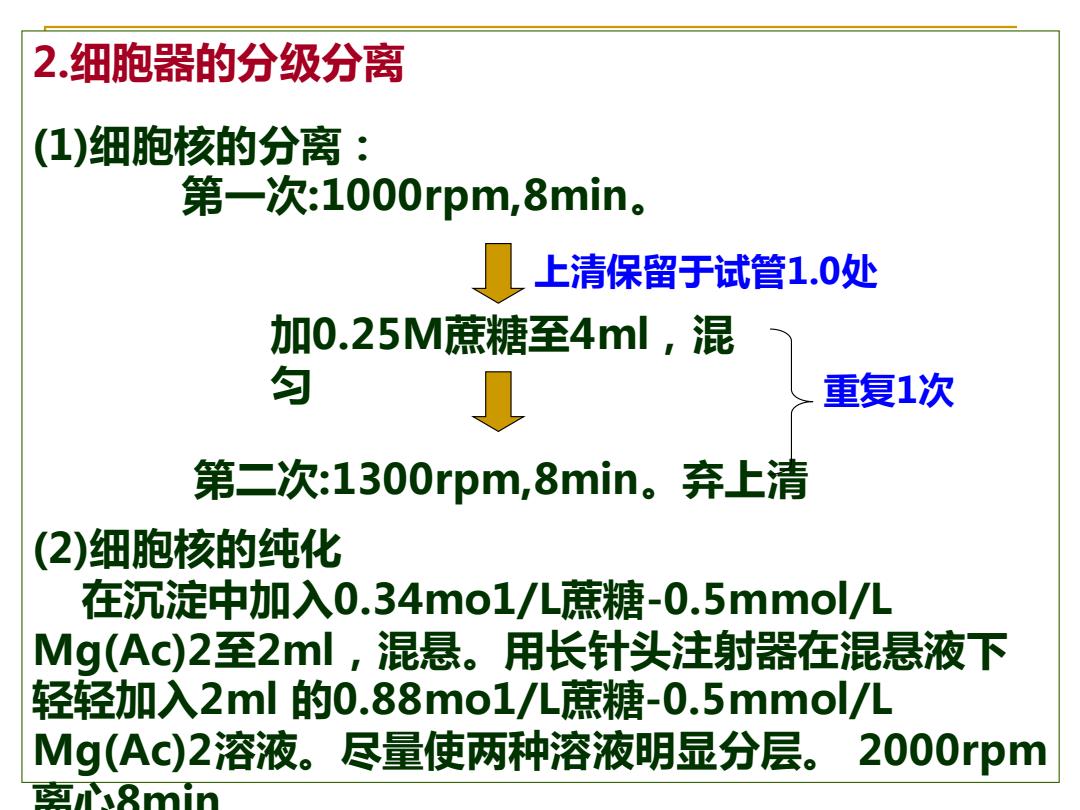
2.细胞器的分级分离 (1)细胞核的分离: 第一次:1000rpm,8min。 上清保留于试管1.0处 加0.25M蔗糖至4ml,混 匀 重复1次 第二次:1300rpm,8min。弃上清 (2)细胞核的纯化 在沉淀中加入0.34mo1/L蔗糖-0.5mmol/L Mg(Ac)2至2ml,混悬。用长针头注射器在混悬液下 轻轻加入2ml的0.88mo1/儿蔗糖-0.5mmol/儿 Mg(Ac)2溶液。尽量使两种溶液明显分层。2000rpm 匈8min
2.细胞器的分级分离 (1)细胞核的分离: 第一次:1000rpm,8min。 (2)细胞核的纯化 在沉淀中加入0.34mo1/L蔗糖-0.5mmol/L Mg(Ac)2至2ml,混悬。用长针头注射器在混悬液下 轻轻加入2ml 的0.88mo1/L蔗糖-0.5mmol/L Mg(Ac)2溶液。尽量使两种溶液明显分层。 2000rpm 离心8min。 加0.25M蔗糖至4ml,混 匀 第二次:1300rpm,8min。弃上清 上清保留于试管1.0处 重复1次
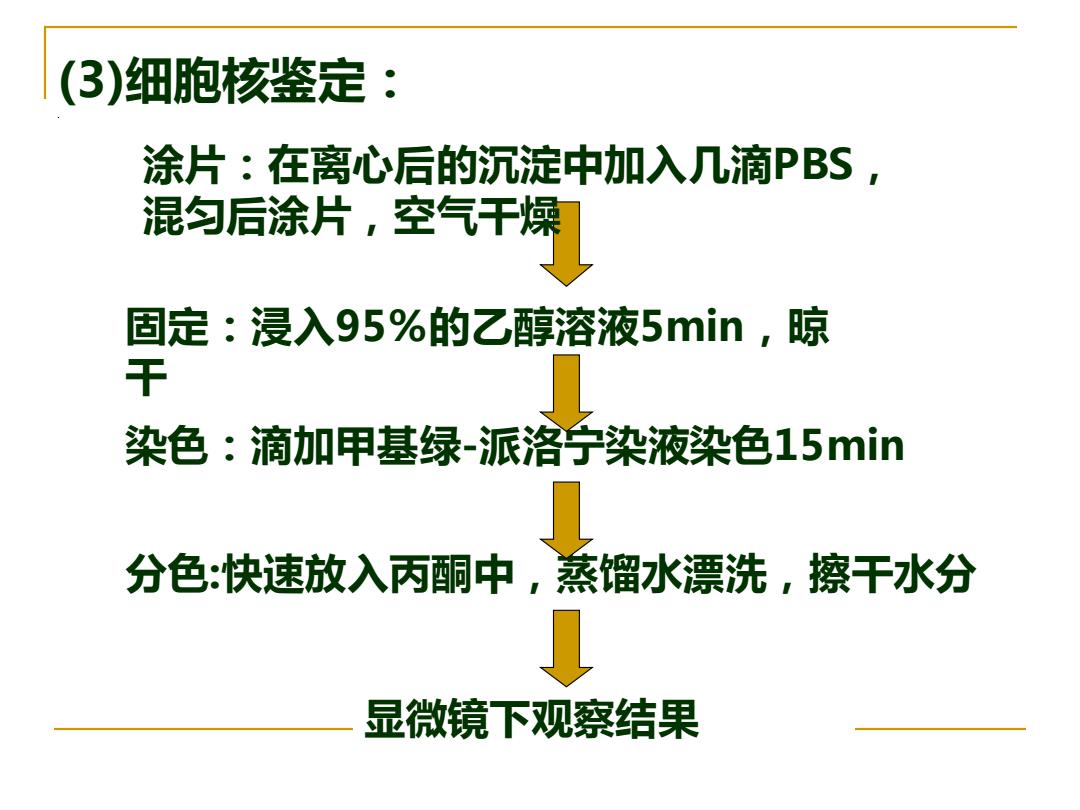
(3)细胞核鉴定: 涂片:在离心后的沉淀中加入几滴PBS, 混匀后涂片,空气干燥 固定:浸入95%的乙醇溶液5min,晾 干 染色:滴加甲基绿-派洛宁染液染色15min 分色:快速放入丙酮中,蒸馏水漂洗,擦干水分 显微镜下观察结果
显微镜下观察结果 (3) 。 细胞核鉴定: 分色:快速放入丙酮中,蒸馏水漂洗,擦干水分 固定:浸入95%的乙醇溶液5min,晾 干 染色:滴加甲基绿-派洛宁染液染色15min 涂片:在离心后的沉淀中加入几滴PBS, 混匀后涂片,空气干燥

(4)线粒体的分离 将分离细胞核时收集的上清以10000g离心10min,, 将上清移入1.5mlEp管内并置冰上或4C冰箱待用。 沉淀用0.25mol/L的蔗糖溶液重悬后 10000g离心10min,重复1次,取沉淀。 (2)线粒体的鉴定 于洁净载玻片上滴1滴0.02%~1%的詹纳斯绿B染 液,用牙签挑取线粒体沉淀均匀涂于染液中,染色5~ 10min,盖上盖玻片,镜检
(4)线粒体的分离 将分离细胞核时收集的上清以10000 g 离心10 min, 将上清移入1.5 ml Ep管内并置冰上或4℃冰箱待用。 沉淀用0.25 mol/L的蔗糖溶液重悬后, 10000 g离心10 min,重复1次,取沉淀。 (2)线粒体的鉴定 于洁净载玻片上滴1滴0.02%~1%的詹纳斯绿B染 液,用牙签挑取线粒体沉淀均匀涂于染液中,染色5~ 10 min,盖上盖玻片,镜检

[结果与分析] 光学显微镜下观察,细胞核经甲基绿-派洛宁染 色,DNA呈蓝绿色,核仁和胞质RNA呈红色。 观察分析完整细胞核的数量及其比例。线粒体经 詹纳斯绿B染色呈亮绿色。溶酶体可用酸性磷酸 酶显示法鉴定。光镜下看不到溶酶体的形态特征 但可看到代表溶酶体的棕黑色颗粒或团块。如果 分离到的细胞组分符合其形态学及酶学特征,而 且没有其他组分的污染,则证明分离操作成功, 反之则为失败
[结果与分析] 光学显微镜下观察,细胞核经甲基绿-派洛宁染 色,DNA呈蓝绿色,核仁和胞质RNA呈红色。 观察分析完整细胞核的数量及其比例。线粒体经 詹纳斯绿B染色呈亮绿色。溶酶体可用酸性磷酸 酶显示法鉴定。光镜下看不到溶酶体的形态特征, 但可看到代表溶酶体的棕黑色颗粒或团块。如果 分离到的细胞组分符合其形态学及酶学特征,而 且没有其他组分的污染,则证明分离操作成功, 反之则为失败

[注意事项] ■1.组织匀浆时,既要尽可能使细胞完全破碎,又 要尽量快速。 ·2.在细胞器分离过程中,所有操作应尽可能在 1~4C下进行。 3.实验过程应注意保持细胞器的完整性,避免操 作过于剧烈。另线粒体进行的是活体染色, 要求样品制备好后尽快染色
[注意事项] ◼ 1.组织匀浆时,既要尽可能使细胞完全破碎,又 要尽量快速。 ◼ 2.在细胞器分离过程中,所有操作应尽可能在 1~4℃下进行。 ◼ 3.实验过程应注意保持细胞器的完整性,避免操 作过于剧烈。另线粒体进行的是活体染色, 要求样品制备好后尽快染色