
第二章紫外一可见分光光度法 研究物质在紫外、可见光区的分子吸收光谱 的分析方法称为紫外可见分光光度法。紫外一可 见分光光度法是利用某些物质的分子吸收200~ 800nm光谱区的辐射来进行分析测定的方法。这 种分子吸收光谱产生于价电子和分子轨道上的电 子在电子能级间的跃迁,广泛用于无机和有机物 质的定性和定量测定。 1
1 第二章 紫外—可见分光光度法 研究物质在 紫外、可见光区 的分子吸收光谱 的分析方法称为紫外-可见分光光度法。紫外—可 见分光光度法是利用某些物质的分子吸收200 ~ 800 nm光谱区的辐射来进行分析测定的方法。这 种分子吸收光谱产生于价电子和分子轨道上的电 子 在电子能级间的跃迁,广泛用于无机和有机物 质的定性和定量测定
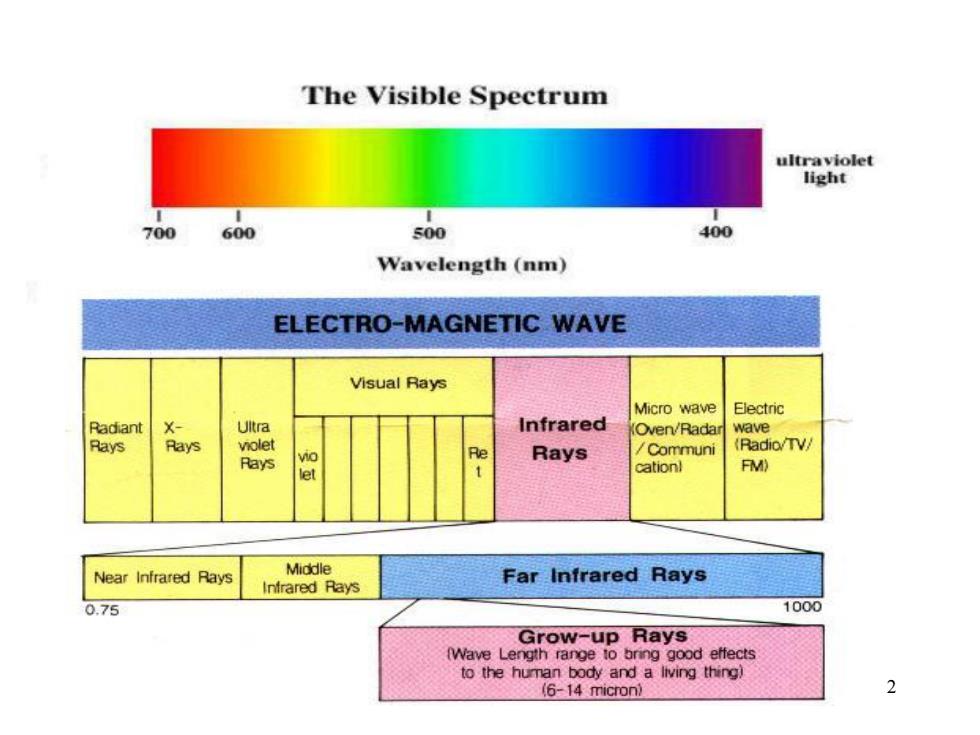
The Visible Spectrum ultraviolet light 700 600 500 400 Wavelength(nm) ELECTRO-MAGNETIC WAVE Visual Rays Micro wave Electric Radiant X Uitra Infrared Oven/Radar wave Rays Rays violet (Radio/TV/ Rays vo Re Rays /Communi cationl FM) Near Infrared Rays Middle Far Infrared Rays Infrared Rays 0.75 1000 Grow-up Rays (Wave Length range to bring good effects to the human body and a living thing) (6-14 micron) 2
2
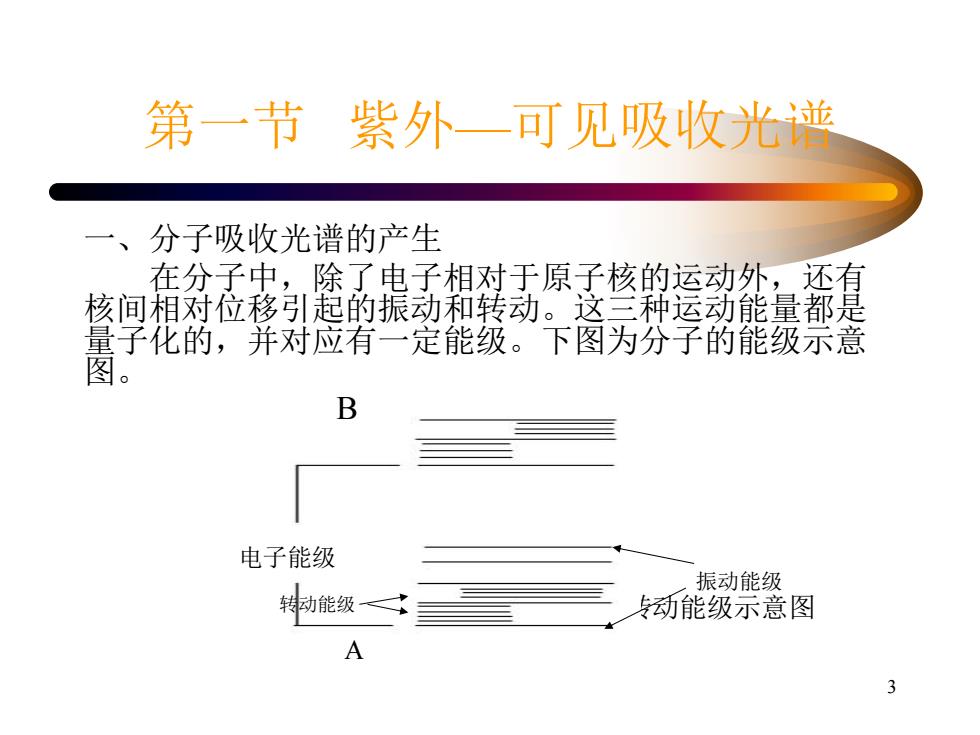
第一节紫外一可见吸收光谱 一、分子吸收光谱的产生 在分子中, 除了电子相对于原子核的运动外,还有 核间相对位移引起的振动和转动。这三种运动能量都是 量子化的,并对应有一定能级。下图为分子的能级示意 图。 B 电子能级 振动能级 勑能级 动能级示意图 3
3 第一节 紫外—可见吸收光谱 一、分子吸收光谱的产生 在分子中,除了电子相对于原子核的运动外,还有 核间相对位移引起的振动和转动。这三种运动能量都是 量子化的,并对应有一定能级。下图为分子的能级示意 图。 分子中电子能级、振动能级和转动能级示意图 电子能级 振动能级 转动能级 B A

第一节紫外一可见吸收光谱 图中A和B表示不同能量的电子能级。在每 电子能级上有许多间距较小的振动能级,在每 振动能级上又有许多更小的转动能级 若用△E电子、△E振动、,△E转动分别表示电 子能级、振动能级转动能级差即有A电之会 会能室不处若酿能级匪 卫振动入△】 可能 当分子处在同一电子能级和同一振动能级时,它 的能量还会因转动能量不同,而处在不同的转动 能级上。所以分子的总能量可以认为是这三种能 量的总和: E分子=E电子十E振动十E转动 4
4 第一节 紫外—可见吸收光谱 图中A和B表示不同能量的电子能级。在每 一电子能级上有许多间距较小的振动能级,在每 一振动能级上又有许多更小的转动能级。 若用△E电子、 △ E振动、 △ E转动分别表示电 子能级、振动能级转动能级差,即有△ E电子 △ E振动 △ E转动。处在同一电子能级的分子,可能 因其振动能量不同,而处在不同的振动能级上。 当分子处在同一电子能级和同一振动能级时,它 的能量还会因转动能量不同,而处在不同的转动 能级上。所以分子的总能量可以认为是这三种能 量的总和: E分子 = E电子 + E振动 + E转动
第一节紫外一可见吸收光谱 A6Jeu Rotational Vibrational electronic levels electronic levels 5
5 第一节 紫外—可见吸收光谱

第一节紫外—可见吸收光谱 当用频率为的电磁波照射分子,而该分子的较高能 级与较低能级之差△E恰好等于该电磁波的能量hv时, 即有 △E=hv(h为普朗克常数) 此时,在微观上出现分子由较低的能级跃迁到较高的 能级;在宏观上则透射光的强度变小。若用一连续辐射 的电磁波照射分子,将照射前后光强度的变化转变为电 信号,并记录下来,然后以波长为横坐标,以电信号 (吸光度A)为纵坐标,就可以得到一张光强度变化对 波长的关系曲线图—分子吸收光谱图。 6
6 第一节 紫外—可见吸收光谱 当用频率为的电磁波照射分子,而该分子的较高能 级与较低能级之差△ E恰好等于该电磁波的能量 h时, 即有 △ E = h ( h为普朗克常数) 此时,在微观上出现分子由较低的能级跃迁到较高的 能级;在宏观上则透射光的强度变小。若用一连续辐射 的电磁波照射分子,将照射前后光强度的变化转变为电 信号,并记录下来,然后以波长为横坐标,以电信号 (吸光度 A)为纵坐标,就可以得到一张光强度变化对 波长的关系曲线图——分子吸收光谱图

第一节紫外一—可见吸收光谱 二、分子吸收光谱类型 根据吸收电磁波的范围不同,可将分子吸收光谱分 为远红外光谱、红外光谱及紫外、可见光谱三类。 分子的转动能级差一般在0.005~0.05eV。产生此能 级的跃迁,需吸收波长约为250~25um的远红外光,因此, 形成的光谱称为转动光谱或远红外光谱。 分子的振动能级差一般在0.05~1eV,需吸收波长约 为25~1.25μm的红外光才能产生跃迁。在分子振动时同 时有分子的转动运动。这样,分子振动产生的吸收光谱 中,包括转动光谱,故常称为振-转光谱。由于它吸收的 7
7 第一节 紫外—可见吸收光谱 二、分子吸收光谱类型 根据吸收电磁波的范围不同,可将分子吸收光谱分 为远红外光谱、红外光谱及紫外、可见光谱三类。 分子的转动能级差一般在0.005 ~ 0.05eV。产生此能 级的跃迁,需吸收波长约为250 ~ 25m的远红外光,因此, 形成的光谱称为转动光谱或远红外光谱。 分子的振动能级差一般在0.05 ~ 1 eV,需吸收波长约 为25 ~ 1.25m的红外光才能产生跃迁。在分子振动时同 时有分子的转动运动。这样,分子振动产生的吸收光谱 中,包括转动光谱,故常称为振-转光谱。由于它吸收的

第一节紫外—可见吸收光谱 能量处于红外光区,故又称红外光谱。 电子的跃迁能差约为1~20eV,比分子振动能级差 要大几十倍,所吸收光的波长约为12.5~0.06μm, 主要在 真空紫外到可见光区,对应形成的光谱,称为电子光谱 或紫外、可见吸收光谱。 通常,分子是处在基态振动能级上。当用紫外、可 见光照射分子时,电子可以从基态激发到激发态的任 振动(或不同的转动)能级上。因此,电子能级跃迁产 生的吸收光谱,包括了大量谱线,并由于这些谱线的重 叠而成为连续的吸收带,这就是为什么分子的紫外、可 见光谱不是线状光谱,而是带状光谱的原因。又因为绝
8 第一节 紫外—可见吸收光谱 能量处于红外光区,故又称红外光谱。 电子的跃迁能差约为1 ~ 20 eV,比分子振动能级差 要大几十倍,所吸收光的波长约为12.5 ~ 0.06m,主要在 真空紫外到可见光区,对应形成的光谱,称为电子光谱 或紫外、可见吸收光谱。 通常,分子是处在基态振动能级上。当用紫外、可 见光照射分子时,电子可以从基态激发到激发态的任一 振动(或不同的转动)能级上。因此,电子能级跃迁产 生的吸收光谱,包括了大量谱线,并由于这些谱线的重 叠而成为连续的吸收带,这就是为什么分子的紫外、可 见光谱不是线状光谱,而是带状光谱的原因。又因为绝

第一节紫外一可见吸收光谱 大多数的分子光谱分析,都是用液体样品,加之仪器的 分辨率有限,因而使记录所得电子光谱的谱带变宽。 由于氧、氮、二氧化碳、水等在真空紫外区(60~ 200nm)均有吸收,因此在测定这一范围的光谱时,必 须将光学系统抽成真空,然后充以一些惰性气体,如氦、 氖、氩等。鉴于真空紫外吸收光谱的研究需要昂贵的真 空紫外分光光度计,故在实际应用中受到一定的限制。 我们通常所说的紫外一可见分光光度法,实际上是指近 紫外、可见分光光度法。 9
9 第一节 紫外—可见吸收光谱 大多数的分子光谱分析,都是用液体样品,加之仪器的 分辨率有限,因而使记录所得电子光谱的谱带变宽。 由于氧、氮、二氧化碳、水等在真空紫外区(60 ~ 200 nm)均有吸收,因此在测定这一范围的光谱时,必 须将光学系统抽成真空,然后充以一些惰性气体,如氦、 氖、氩等。鉴于真空紫外吸收光谱的研究需要昂贵的真 空紫外分光光度计,故在实际应用中受到一定的限制。 我们通常所说的紫外—可见分光光度法,实际上是指近 紫外、可见分光光度法
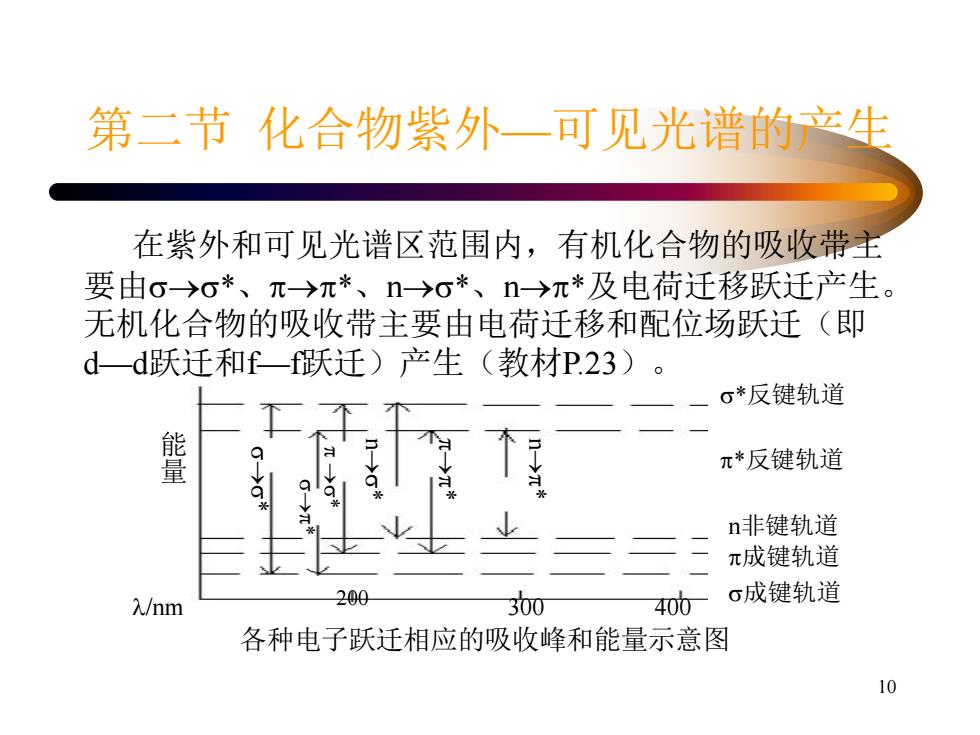
第二节化合物紫外一可见光谱的产生 在紫外和可见光谱区范围内,有机化合物的吸收带主 要由o→o*、元→π*、n→o*、n→元*及电荷迁移跃迁产生。 无机化合物的吸收带主要由电荷迁移和配位场跃迁(即 d一d跃迁和f一f跃迁)产生(教材P.23) 。 σ*反键轨道 π*反键轨道 n非键轨道 π成键轨道 入/nm 200 300 400 σ成键轨道 各种电子跃迁相应的吸收峰和能量示意图 10
10 第二节 化合物紫外—可见光谱的产生 在紫外和可见光谱区范围内,有机化合物的吸收带主 要由* 、* 、n* 、n*及电荷迁移跃迁产生。 无机化合物的吸收带主要由电荷迁移和配位场跃迁(即 d—d跃迁和f—f跃迁)产生(教材P.23)。 各种电子跃迁相应的吸收峰和能量示意图 * * * n * * n * 能 量 *反键轨道 *反键轨道 n非键轨道 成键轨道 200 成键轨道 /nm 300 400