
第3章紫外-可见分光光度法 UV-Vis
第3章 紫外-可见分光光度法 UV-Vis

3.1紫外可见吸收光谱 紫外-可见分光光度法:研究物质在紫外、可见光 区的分子吸收光谱的分析方法。 光谱区:200~800nm 吸收光谱产生的原因:价电子和分子轨道上的电 子在电子能级间的跃迁, 应用范围:无机和有机物质的定性和定量测定
紫外-可见分光光度法:研究物质在 紫外、可见光 区 的分子吸收光谱 的分析方法。 光谱区:200 ~ 800 nm 吸收光谱产生的原因:价电子和分子轨道上的电 子 在电子能级间的跃迁, 应用范围:无机和有机物质的定性和定量测定。 3.1 紫外-可见吸收光谱
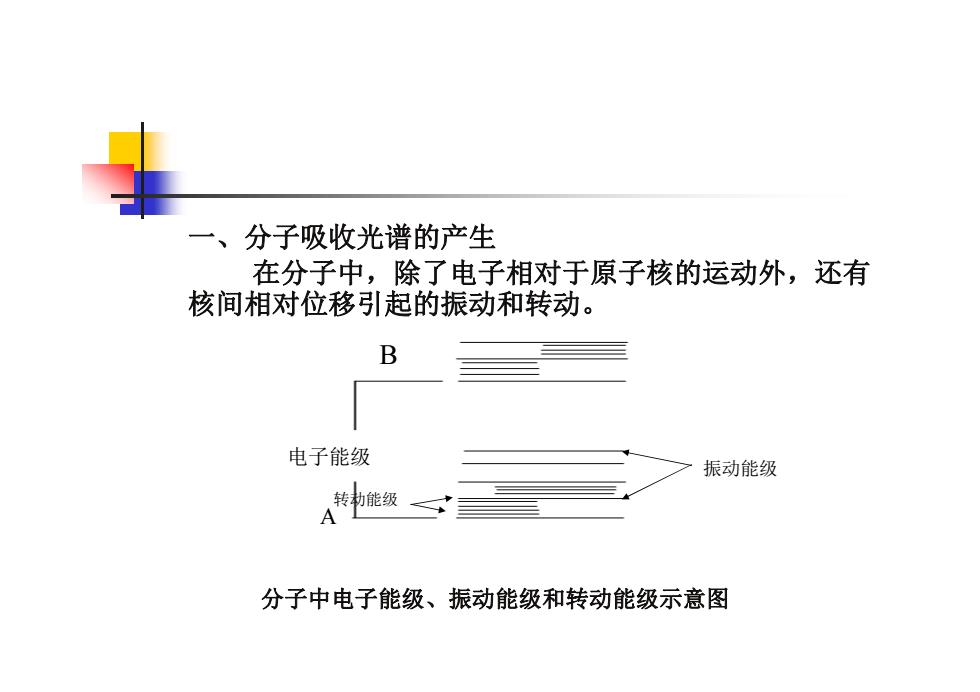
一、分子吸收光谱的产生 在分子中,除了电子相对于原子核的运动外,还有 核间相对位移引起的振动和转动。 B 电子能级 振动能级 耖能级一 A 分子中电子能级、振动能级和转动能级示意图
一、分子吸收光谱的产生 在分子中,除了电子相对于原子核的运动外,还有 核间相对位移引起的振动和转动。 分子中电子能级、振动能级和转动能级示意图 电子能级 振动能级 转动能级 B A

E分子=E电子+E振动+E转动 E电子为1~20eV 分子电子能级跃迁产生的光谱紫外一可见吸收光谱。 E振动为0.025~1eV E转动<0.025eV 分子在振动能级间跃迁,伴随着分子的转动能级的跃 迁,产生的光谱为红外吸收光谱(振转光谱)
E分子 = E电子 + E振动 + E转动 E电子为1~20eV 分子电子能级跃迁产生的光谱紫外-可见吸收光谱。 E振动为0.025~1eV E转动<0.025eV 分子在振动能级间跃迁,伴随着分子的转动能级的跃 迁,产生的光谱为红外吸收光谱(振转光谱)

物质对光的选择性吸收 紫外:200-400nm 可见:400-750nm ■红外:0.75-50μm ■单色光:波长处于某一范围的光; ■复合光:不同单色光组成的光 ■互补光:将两种适当颜色的光按一定的强度比例 混合就可形成白光,它们互称互补光。 例如:黄光和兰光、黄绿光与紫光
紫外:200-400nm 可见:400-750nm 红外:0.75-50μm 单色光:波长处于某一范围的光; 复合光:不同单色光组成的光 互补光:将两种适当颜色的光按一定的强度比例 混合就可形成白光,它们互称互补光。 例如:黄光和兰光、黄绿光与紫光 物质对光的选择性吸收
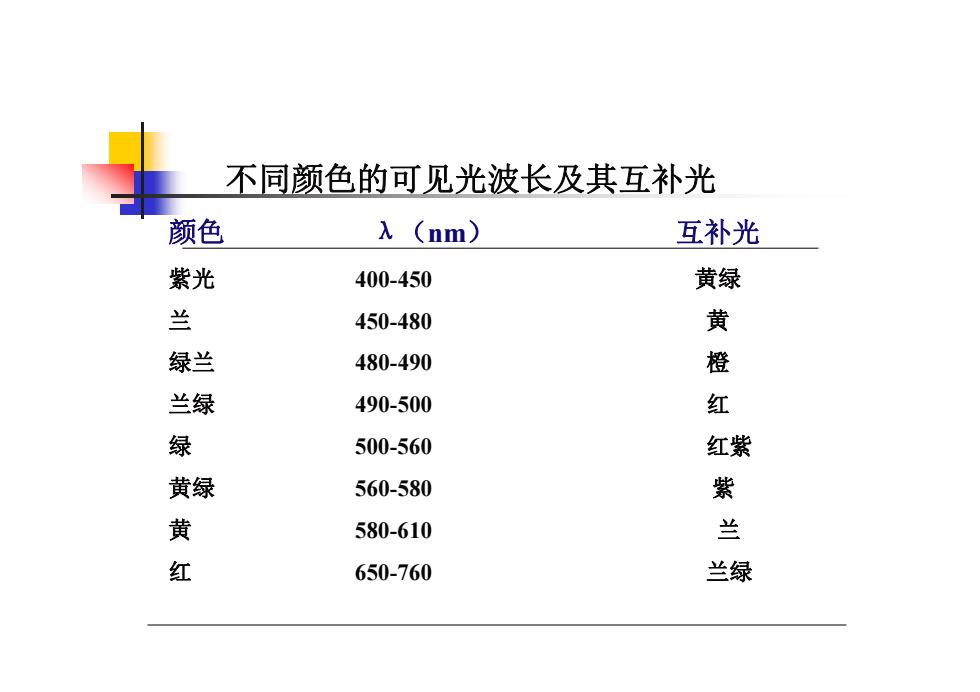
不同颜色的可见光波长及其互补光 颜色 λ(nm) 互补光 紫光 400-450 黄绿 兰 450-480 黄 绿兰 480-490 橙 兰绿 490-500 红 绿 500-560 红紫 黄绿 560-580 紫 黄 580-610 兰 红 650-760 兰绿
不同颜色的可见光波长及其互补光 颜色 λ(nm) 互补光 紫光 400-450 黄绿 兰 450-480 黄 绿兰 480-490 橙 兰绿 490-500 红 绿 500-560 红紫 黄绿 560-580 紫 黄 580-610 兰 红 650-760 兰绿
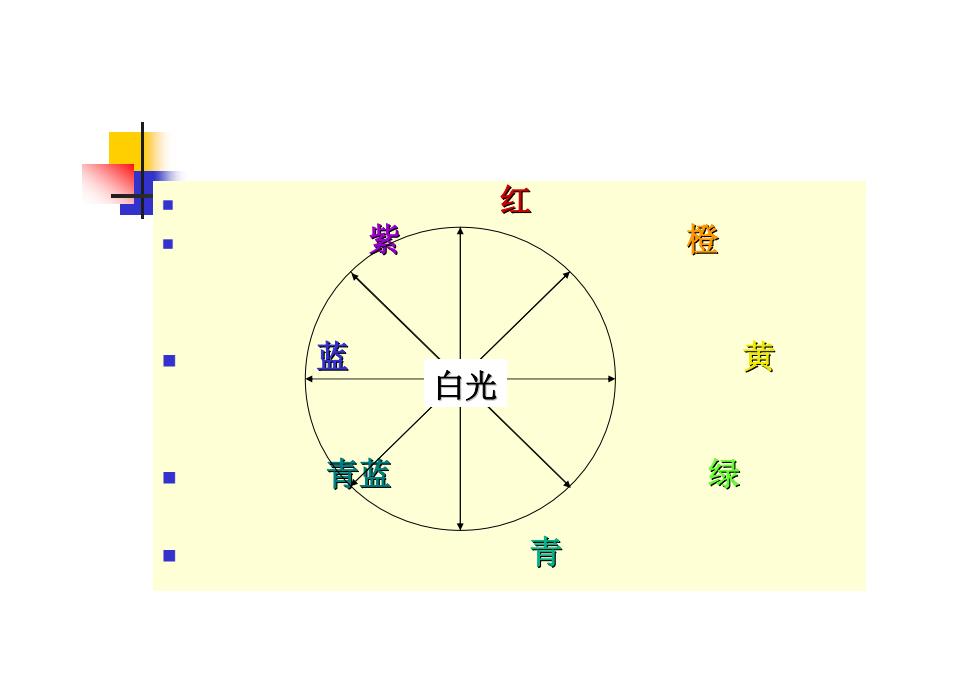
红 紫 橙 蓝 黄 白光 養蓝 绿 青
红 紫 橙 蓝 黄 青蓝 绿 青 白光

物质对光的选择性吸收 溶液的颜色呈现是它所呈现的互补光的颜色。 物质的分子内部具有一系列不连续的特征能 级,包括电子能级,振动能级和转动能级, 这些能级都是量子化的
物质对光的选择性吸收 溶液的颜色呈现是它所呈现的互补光的颜色。 物质的分子内部具有一系列不连续的特征能 级,包括电子能级,振动能级和转动能级, 这些能级都是量子化的

韧质颜色与光吸收的光系 当物质(分子或离子)吸收了相当可见光能量的电磁 波后,就会表现出被人眼所能觉察到的颜色。物质所显 示的颜色,是它对不同波长的可见光具有选择性吸收的 结果。 例:CuSO,吸收黄光,透过光为兰光; KMnO,吸收了绿青光,呈现紫红色; 黄绿 对白光全部吸收,溶液呈现黑色; 反射所有光,即透过所有的光,溶液呈现无色
物质颜色与光吸收的光系 当物质(分子或离子)吸收了相当可见光能量的电磁 波后,就会表现出被人眼所能觉察到的颜色。物质所显 示的颜色,是它对不同波长的可见光具有选择性吸收的 结果。 例:CuSO4吸收黄光,透过光为兰光; KMnO4吸收了绿青光,呈现紫红色; 对 白光全部吸收,溶液呈现黑色; 反射所有光,即透过所有的光,溶液呈现无色

溶液颜色的深浅,取决于溶液吸收光的量 的多少,即吸光物质的浓度的高低。 因此,可以通过比较物质溶液颜色的深浅,来 确定物质溶液中吸光物质的含量,这是比色分 析法的依据
溶液颜色的深浅,取决于溶液吸收光的量 的多少,即吸光物质的浓度的高低。 因此,可以通过比较物质溶液颜色的深浅,来 确定物质溶液中吸光物质的含量,这是比色分 析法的依据