
电化学分析法
电化学分析法

目 录 口」概述 口2电服的构造和原理 口电化学分析法及应用
目 录 1 概述 2 电极的构造和原理 3 电化学分析法及应用
什么是电化学分析?定义 将化学变化与电的现象紧密联系起来的学科便是电化学。应用电化学的 基本原理和实验技术,依据物质的电化学性质来测定物质组成及含量的分析 方法称之为电化学分析或电分析化学。 电化学分析法的重要特征: 直接通过测定电流电势、电导电量等物理量在溶液中有电流或无 电流流动的情况下,来研究、确定参与反应的化学物质的量。 依据测定电参数分别命名各种电化学分析方法:如电势分析法··· 依据应用方式不同可分为:直接法和间接法(仪器作为滴定终点指示装置) 电化学分析法的特点: 电位分析实验室 灵敏度准确度高,选择性好,应用广泛。 被测物质的最低量可以达到10~12o1/L数量级。 电化学仪器装置较为简单,操作方便,尤其 适合于化工生产中的自动控制和在线分析。 传统电化学分析:无机离子的分析;测定有 ☐毫伏计 机化合物也日益广泛
§1 概 述 什么是电化学分析 ? 定义: 将化学变化与电的现象紧密联系起来的学科便是电化学。应用电化学的 基本原理和实验技术,依据物质的电化学性质来测定物质组成及含量的分析 方法称之为电化学分析或电分析化学。 电化学分析法的重要特征: 直接通过测定电流、电势、电导、电量等物理量,在溶液中有电流或无 电流流动的情况下,来研究、确定参与反应的化学物质的量。 依据测定电参数分别命名各种电化学分析方法:如电势分析法‥‥‥。 依据应用方式不同可分为:直接法和间接法(仪器作为滴定终点指示装置) 。 电化学分析法的特点: 灵敏度、准确度高,选择性好,应用广泛。 被测物质的最低量可以达到10-12mol/L数量级。 电化学仪器装置较为简单,操作方便,尤其 适合于化工生产中的自动控制和在线分析。 传统电化学分析:无机离子的分析;测定有 机化合物也日益广泛

一、电化学分析法的类别 1.电势分析法 直接电势法:电极电势与溶液 中电活性物质的活度有关,通过 测量溶液的电动势,根据奈斯特 方程计算被测物质的含量; 电势滴定:分析法用电势测量 装置指示滴定分析过程中被测组 分的浓度变化,通过记录或绘制 滴定曲线来确定滴定终点的分析 方法。 研制各种高灵敏度、高选择性的电极是电势分析 法最活跃的研究领域
一、电化学分析法的类别 1.电势分析法 : 直接电势法: 电极电势与溶液 中电活性物质的活度有关,通过 测量溶液的电动势,根据奈斯特 方程计算被测物质的含量; 电势滴定: 分析法用电势测量 装置指示滴定分析过程中被测组 分的浓度变化,通过记录或绘制 滴定曲线来确定滴定终点的分析 方法。 研制各种高灵敏度、高选择性的电极是电势分析 法最活跃的研究领域

电解与库仑分析法 电解分析:在恒电流或控制电势的条件下,使 被测物质在电极上析出,实现定量分离测定目 的的方法。 电重量分析法:电解过程中在阴极上析出的物 质量通常可以用称重的方法来确定。 库仑分析法:依据法拉第电解定律,由电解过 程中电极上通过的电量来确定电极上析出的物 质量的分析方法。 电流滴定或库仑滴定:在恒电流下,电解产生 的滴定剂与被测物作用 3.极谱法写伏安分析 伏安分析是通过测定特殊条件下 的电流一电压曲线来分析电解质的组 成和含量的一类分析方法的总称。而 极谱法则是使用滴汞电极的一种特殊 的伏安分析法。 4.电导分析法
电解与库仑分析法 电解分析:在恒电流或控制电势的条件下,使 被测物质在电极上析出,实现定量分离测定目 的的方法。 电重量分析法:电解过程中在阴极上析出的物 质量通常可以用称重的方法来确定。 库仑分析法:依据法拉第电解定律,由电解过 程中电极上通过的电量来确定电极上析出的物 质量的分析方法。 电流滴定或库仑滴定:在恒电流下,电解产生 的滴定剂与被测物作用。 3.极谱法与伏安分析 伏安分析是通过测定特殊条件下 的电流—电压曲线来分析电解质的组 成和含量的一类分析方法的总称。而 极谱法则是使用滴汞电极的一种特殊 的伏安分析法。 4. 电导分析法

二、电化学分析的基本方法 显示 1.化学电池与电化学分析装置 化学电池:原电池和电解电池。 电化学基本装置:两支电极、电源、放大、显示记录装置。 2.电势及电化学参数测量的基本原理 两大类电化学分析方法: a.无电极反应,如电导,电泳分析法,使用惰性金属铂电极。 b.电极上有氧化还原反应发生,如库仑分析及伏安分析。 ⊙④ ⊙1 ⊙1© 一a 电势分析原理:△E=EA十E a 外二测:外电势随两支电极间电势变化。 104t c104'c104 0:测定过程中并没有电流流过电极。 CI C104 0.10.1 0.10.1 sol/L o1/九 参比电极:电极电势固定且不随测定溶液和浓度变化而变化的电极。 指示电极:电极电势则随测量溶液和浓度不同而变化,由电池电动势的 大小可以确定待测溶液的活度(常用浓度代替)大小。 液体接界电势:在两种不同离子的溶液或两种不同浓度的溶液接触界面 上,存在着微小的电势差,称之为液体接界电势。 液体接界电势产生的原因:各种离子具有不同的运动速度而引起
二、电化学分析的基本方法 1.化学电池与电化学分析装置 化学电池:原电池和电解电池。 电化学基本装置:两支电极、电源、放大、显示记录装置。 2.电势及电化学参数测量的基本原理 两大类电化学分析方法: a.无电极反应,如电导,电泳分析法,使用惰性金属铂电极。 b.电极上有氧化还原反应发生,如库仑分析及伏安分析。 电势分析原理:E = E + - E -+ E L E 外= E 测:外电势随两支电极间电势变化。 I=0 :测定过程中并没有电流流过电极。 参比电极:电极电势固定且不随测定溶液和浓度变化而变化的电极。 指示电极:电极电势则随测量溶液和浓度不同而变化,由电池电动势的 大小可以确定待测溶液的活度(常用浓度代替)大小。 液体接界电势:在两种不同离子的溶液或两种不同浓度的溶液接触界面 上,存在着微小的电势差,称之为液体接界电势。 液体接界电势产生的原因:各种离子具有不同的运动速度而引起
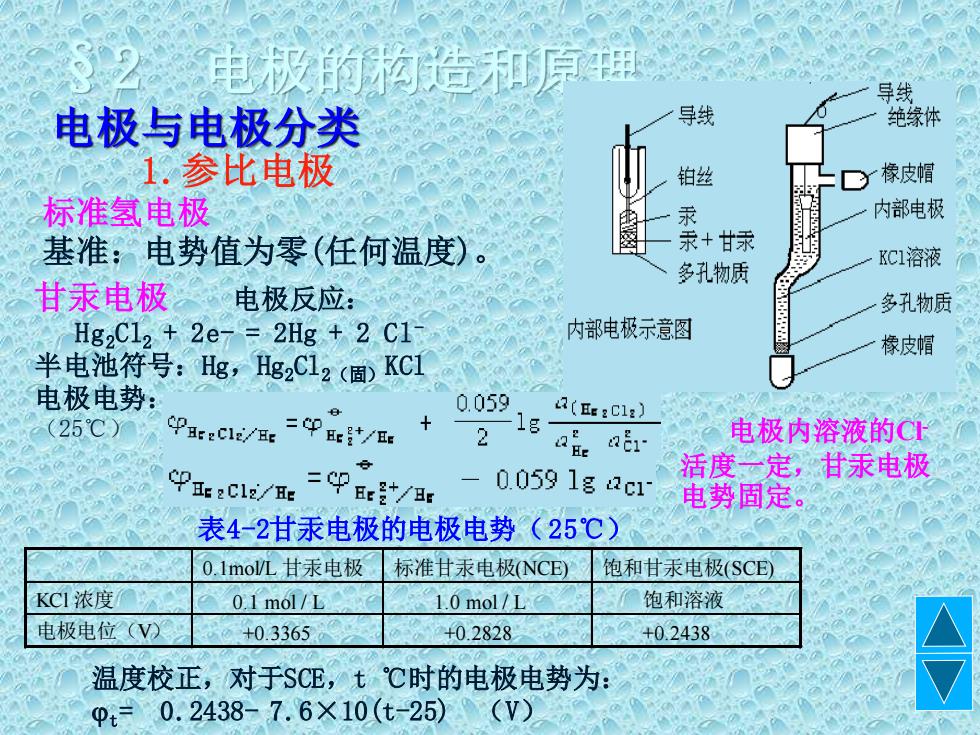
电极的构造和原腰 导线 电极与电极分类 导线 绝缘体 1.参比电极 铂丝 C椽皮帽 标准氢电极 汞 内部电极 基准:电势值为零(任何温度)。 +甘家 多孔物质 KCI溶液 甘汞电极 电极反应: 多孔物质 Hg2C12+2e7=2Hg+2C1 内部电极示意图 橡皮帽 半电池符号:Hg,g2C12()KCI 电极电势: 0.059 (25℃) PEec1E/r=Piet/Ee 2 1g 4(HE:Cl:) e E1 电极内溶液的© 9ec1/=9p2 0.0591g2c1 活度一定,甘汞电极 Hr 电势固定。 表4-2甘汞电极的电极电势(25℃) 0.1mo/L甘汞电极 标准甘汞电极(NCE) 饱和甘汞电极(SCE) KCI浓度 0.1 mol/L 1.0mol/1 饱和溶液 电极电位(V2 +0.3365 +0.2828 +0.2438 温度校正,对于SCE,t℃时的电极电势为: 0=0.2438-7.6×10(t-25) (V)
§2 电极的构造和原理 电极与电极分类 1.参比电极 标准氢电极 基准:电势值为零(任何温度)。 甘汞电极 电极反应: Hg2Cl2 + 2e- = 2Hg + 2 Cl- 半电池符号:Hg,Hg2Cl2(固)KCl 电极电势: (25℃) 电极内溶液的Cl- 活度一定,甘汞电极 电势固定。 表4-2甘汞电极的电极电势(25℃) 0.1mol/L 甘汞电极 标准甘汞电极(NCE) 饱和甘汞电极(SCE) KCl 浓度 0.1 mol / L 1.0 mol / L 饱和溶液 电极电位(V) +0.3365 +0.2828 +0.2438 温度校正,对于SCE,t ℃时的电极电势为: t= 0.2438- 7.6×10(t-25) (V)
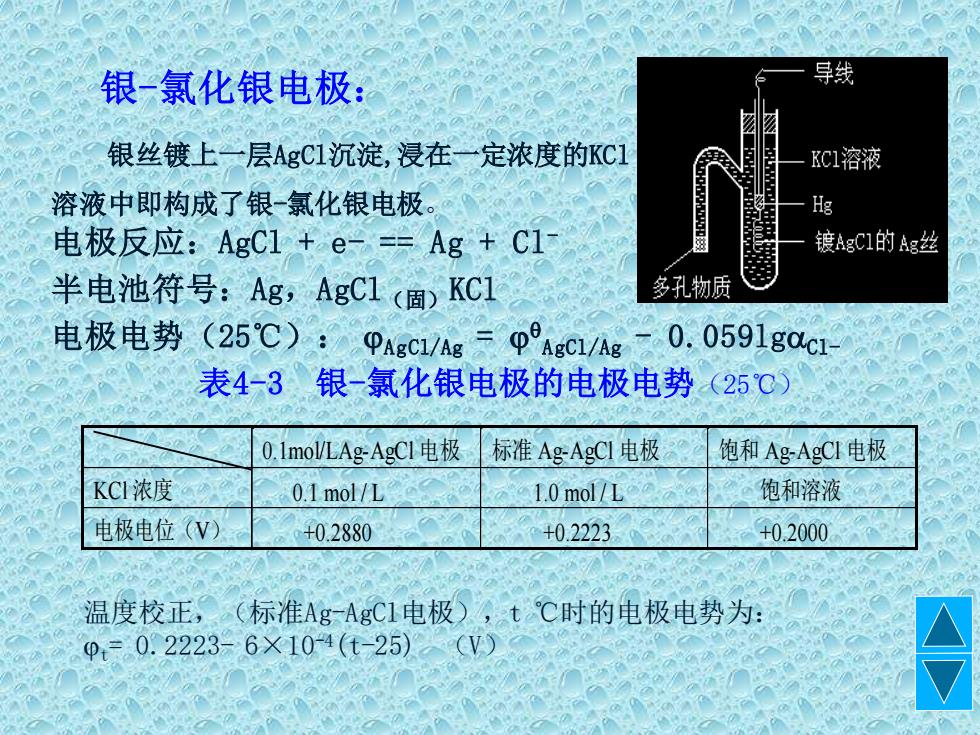
银一氯化银电极: 导线 银丝镀上二层AgC1沉淀,浸在一定浓度的KC1 溶液中即构成了银一氯化银电极 电极反应:AgC1+e-=Ag+C1 镀AgCI的Ag丝 半电池符号:Ag,AgC1(固)KC1 多孔物质 电极电势(25℃): PAgCI/Ag AgCl/Ag 0.,0591gc1 表4-3银-氯化银电极的电极电势(25℃) 0.1 moW/LAg-AgC1电极 标准Ag-AgCI电极 饱和Ag-AgCI电极 KCI浓度 0.1mol/L 1.0mol/L 饱和溶液 电极电位(V) +0.2880 +0.2223 +0.2000 温度校正,(标准Ag一AgC1电极),t℃时的电极电势为: φ,=0.2223=6X104(t-25)V)
温度校正,(标准Ag-AgCl电极),t ℃时的电极电势为: t= 0.2223- 6×10-4(t-25) (V) 银丝镀上一层AgCl沉淀,浸在一定浓度的KCl 溶液中即构成了银-氯化银电极。 电极反应:AgCl + e- == Ag + Cl- 半电池符号:Ag,AgCl(固)KCl 电极电势(25℃): AgCl/Ag = AgCl/Ag - 0.059lgCl- 表4-3 银-氯化银电极的电极电势(25℃) 0.1mol/LAg-AgCl 电 极 标准 Ag-AgCl 电极 饱和 Ag-AgCl 电极 KCl 浓度 0.1 mol / L 1.0 mol / L 饱和溶液 电极电位(V) +0.2880 +0.2223 +0.2000 银-氯化银电极:

指示电极 第一类电极一 金属金属离子电极 例如:Ag-AgNO3电极(银电极),Zn-ZnS04电极(锌电极)等: 电极电势为:0+/M=φ°M时/M0.0591ga 第一类电极的电势仅与金属离子的活度有关。 第二类电极一金属金属难溶盐电极 二个相界面,常用作参比电极 第三类电极 一汞电极 金属汞(或汞齐丝)浸入含有少量Hg+-EDTA配合物及被测金属离子 的溶液中所组成。根据溶液中同时存在的Hg+和M+与EDTA间的两个配 位平衡,可以导出以下关系式: φ(Hg22+/Hg)=φ9(Hg2+/Hg)-0.0591g0w 惰性金属电极 这类电极不参与反应,但其晶格间的自由电子可与溶液进行交换,故 惰性金属电极可作为溶液中氧化态和还原态获得电子或释放电子的场所。 膜电极
指示电极 第一类电极──金属-金属离子电极 例如:Ag-AgNO3电极(银电极),Zn-ZnSO4电极(锌电极)等。 电极电势为:M n+ /M = M n+ /M - 0.059lgaM n+ 第一类电极的电势仅与金属离子的活度有关。 第二类电极──金属-金属难溶盐电极 二个相界面,常用作参比电极 第三类电极──汞电极 金属汞(或汞齐丝)浸入含有少量Hg2+-EDTA配合物及被测金属离子 的溶液中所组成。根据溶液中同时存在的Hg2+和Mn+与EDTA间的两个配 位平衡,可以导出以下关系式: (Hg2 2+/Hg )= (Hg2 2+/Hg )- 0.059lgaM n+ 惰性金属电极 这类电极不参与反应,但其晶格间的自由电子可与溶液进行交换.故 惰性金属电极可作为溶液中氧化态和还原态获得电子或释放电子的场所。 膜电极

1.膜电极 特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。 膜电极的关键:是一个称为选择膜的敏感元件。 敏感元件可由特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及 生物膜等构成。选择膜的一面与被测溶液接触,另一面与电极的内充液相 接触,内充液中含有固定浓度的被测离子。膜内外被测离子活度的不同而 产生电势差,将膜电极和参比电极一起插到被测溶液中,则电池结构为: 外参比电极被测溶液(i未知)1内充溶液(a1一定)、内参比电极 (敏感膜) 导线 电极杆 内外参比电极的电势值固定,且内充溶液 内参比电极 中离子的活度也一定,则电池电动势为: (Ag-AgC1 内参此溶液 In ai 低球职
1.膜电极 特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。 膜电极的关键:是一个称为选择膜的敏感元件。 敏感元件可由特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及 生物膜等构成。选择膜的一面与被测溶液接触,另一面与电极的内充液相 接触,内充液中含有固定浓度的被测离子。膜内外被测离子活度的不同而 产生电势差,将膜电极和参比电极一起插到被测溶液中,则电池结构为: 外参比电极∣∣被测溶液( ai未知)∣ 内充溶液( ai一定)∣ 内参比电极 (敏感膜) 内外参比电极的电势值固定,且内充溶液 中离子的活度也一定,则电池电动势为: