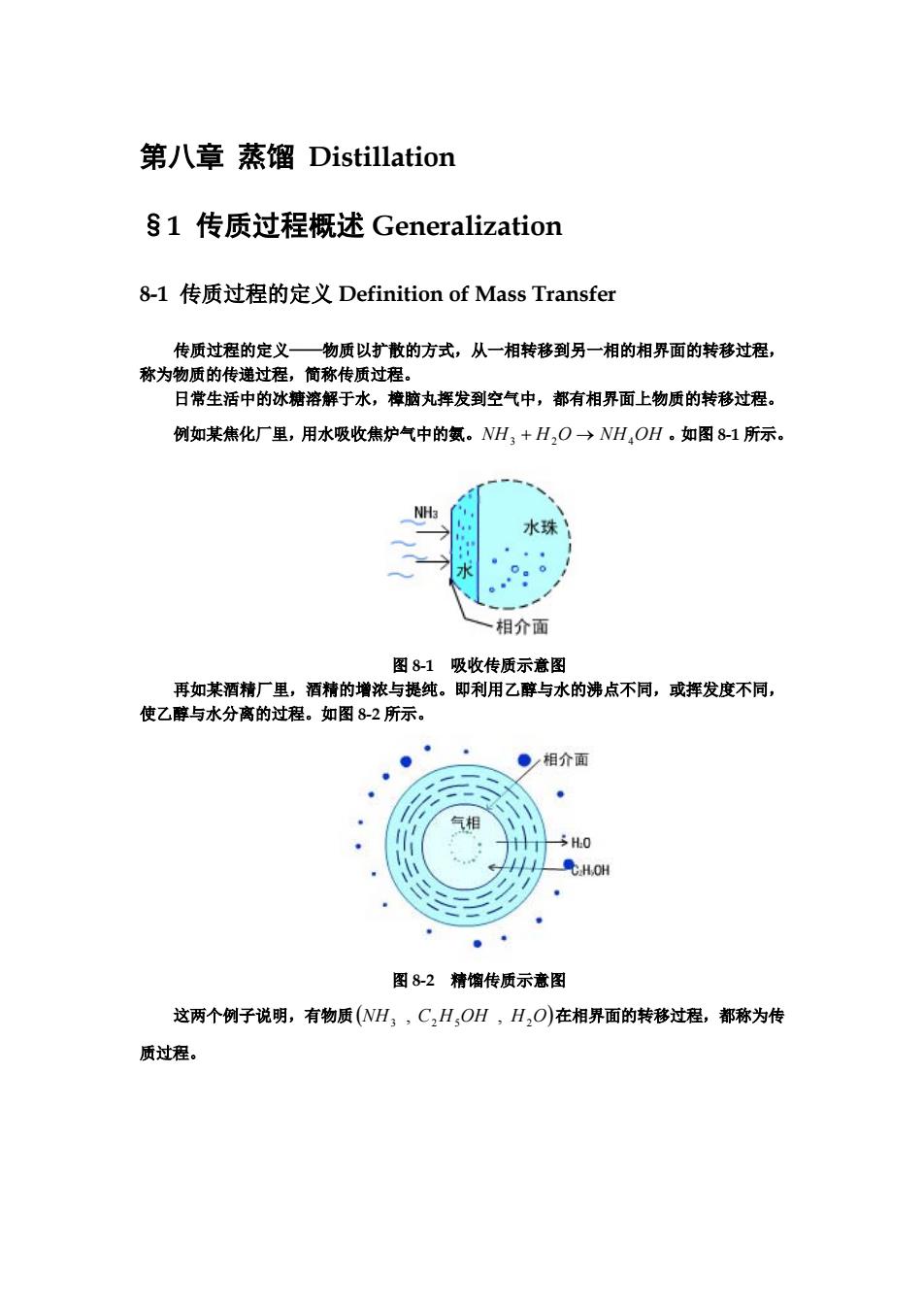
第八章 蒸馏 Distillation §1 传质过程概述 Generalization 8-1 传质过程的定义 Definition of Mass Transfer 传质过程的定义——物质以扩散的方式,从一相转移到另一相的相界面的转移过程, 称为物质的传递过程,简称传质过程。 日常生活中的冰糖溶解于水,樟脑丸挥发到空气中,都有相界面上物质的转移过程。 例如某焦化厂里,用水吸收焦炉气中的氨。NH3 + H2O → NH4OH 。如图 8-1 所示。 图 8-1 吸收传质示意图 再如某酒精厂里,酒精的增浓与提纯。即利用乙醇与水的沸点不同,或挥发度不同, 使乙醇与水分离的过程。如图 8-2 所示。 图 8-2 精馏传质示意图 这两个例子说明,有物质 在相界面的转移过程,都称为传 质过程。 (NH3 , C2H5OH , H2O)
第八章 蒸馏 Distillation §1 传质过程概述 Generalization 8-1 传质过程的定义 Definition of Mass Transfer 传质过程的定义——物质以扩散的方式,从一相转移到另一相的相界面的转移过程, 称为物质的传递过程,简称传质过程。 日常生活中的冰糖溶解于水,樟脑丸挥发到空气中,都有相界面上物质的转移过程。 例如某焦化厂里,用水吸收焦炉气中的氨。NH3 + H2O → NH4OH 。如图 8-1 所示。 图 8-1 吸收传质示意图 再如某酒精厂里,酒精的增浓与提纯。即利用乙醇与水的沸点不同,或挥发度不同, 使乙醇与水分离的过程。如图 8-2 所示。 图 8-2 精馏传质示意图 这两个例子说明,有物质 在相界面的转移过程,都称为传 质过程。 (NH3 , C2H5OH , H2O)

8-2 传质过程举例 Examples of Mass Transfer Process 焦化厂的例子,是吸收操作。——利用组成混合气体的各组分在溶剂中溶解度不同来 分离气体混合物的操作,称为吸收操作。 焦炉气中不仅含有 ,还有 等气体,利用 易溶于水, 以水为吸收剂,使 从焦炉气中分离出来。吸收主要用来分离气体混合物,所以有的教 材称吸收为气体吸收。如图 8-3 所示。 NH3 3 2 4 2 CO , CO , CH , H NH3 NH 图 8-3 吸收局部示意图 水称为溶剂, NH3 称为溶质,炉气中其他气体称为惰性组分。 用水吸收氯化氢气体(HCl) ,制备盐酸,也是一种吸收操作。 酒精厂的例子,是精馏操作。——利用液体混合物各组分沸点(或挥发度)的不同, 将物质多次部分汽化与部分冷凝,从而使液体混合物分离与提纯的过程,称为精馏操作。 精馏主要用来分离液体混合物,所以有的教材称精馏为液体精馏。 传质过程还有, 萃取——利用混合物各组分对某溶剂具有不同的溶解度,从而使混合物各组分得到分 离与提纯的操作过程。 例如用醋酸乙酯萃取醋酸水溶液中的醋酸。如图 8-4 所示。 图 8-4 萃取示意图 此例中醋酸乙酯称为萃取剂( ,醋酸称为溶质( ,水称为稀释剂 。萃取操作能 够进行的必要条件是:溶质在萃取剂中有较大的溶解度,萃取剂与稀释剂要有密度差。 S) A) (B)
8-2 传质过程举例 Examples of Mass Transfer Process 焦化厂的例子,是吸收操作。——利用组成混合气体的各组分在溶剂中溶解度不同来 分离气体混合物的操作,称为吸收操作。 焦炉气中不仅含有 ,还有 等气体,利用 易溶于水, 以水为吸收剂,使 从焦炉气中分离出来。吸收主要用来分离气体混合物,所以有的教 材称吸收为气体吸收。如图 8-3 所示。 NH3 3 2 4 2 CO , CO , CH , H NH3 NH 图 8-3 吸收局部示意图 水称为溶剂, NH3 称为溶质,炉气中其他气体称为惰性组分。 用水吸收氯化氢气体(HCl) ,制备盐酸,也是一种吸收操作。 酒精厂的例子,是精馏操作。——利用液体混合物各组分沸点(或挥发度)的不同, 将物质多次部分汽化与部分冷凝,从而使液体混合物分离与提纯的过程,称为精馏操作。 精馏主要用来分离液体混合物,所以有的教材称精馏为液体精馏。 传质过程还有, 萃取——利用混合物各组分对某溶剂具有不同的溶解度,从而使混合物各组分得到分 离与提纯的操作过程。 例如用醋酸乙酯萃取醋酸水溶液中的醋酸。如图 8-4 所示。 图 8-4 萃取示意图 此例中醋酸乙酯称为萃取剂( ,醋酸称为溶质( ,水称为稀释剂 。萃取操作能 够进行的必要条件是:溶质在萃取剂中有较大的溶解度,萃取剂与稀释剂要有密度差。 S) A) (B)

干燥操作——利用热能使湿物料的湿分汽化,水汽或蒸汽经气流带走,从而获得固体 产品的操作。如图 8-5 所示。 图 8-5 干燥传质示意图 还有固—液萃取,结晶,吸附等操作。 要研究传质过程,主要从三个方面进行研究。相平衡关系(气-液溶解度,液-液溶解度, 干燥中的水蒸气分压),物料衡算关系和传质速率关系。 浓度表示法及其换算:重量百分率(质量分率) 的摩尔数 的摩尔数 摩尔比分率 的摩尔数 的摩尔数 的摩尔数 摩尔分率 质量百分率(质量分率) B A X A B A x m m kg m kg W A A A B A A = + = + = ( ) ( ) A A A A A A A A A B A A A A A A B A A A X X x x x X W M W M W M x x M x M x M W + = − = + − = + − = 1 1 1 1 § 2 理想溶液的汽 - 液平衡 Equilibrium of Gas-Liquid for Ideal Solutions 8-3 由制酒作坊引出相平衡 Introduction to Phase Equilibrium by Wine Making 大庆油田开采出来的是原油,如何将原油加工成汽油、煤油、柴油、重油呢?酿酒厂 酿制出了原酒,如何将粗酒加工成60°的白酒呢? 先介绍以下古老的烧酒作坊吧!目前江浙一带仍有这种家庭小作坊,主要分三步: (1) 粬的制作——发酵过程(获得菌种) (2) 粗酒的制作——将酒粬与蒸熟的米饭,按一定比例混合发酵,制成酒、水、酒 糟的糊状混和物(生物降解)
干燥操作——利用热能使湿物料的湿分汽化,水汽或蒸汽经气流带走,从而获得固体 产品的操作。如图 8-5 所示。 图 8-5 干燥传质示意图 还有固—液萃取,结晶,吸附等操作。 要研究传质过程,主要从三个方面进行研究。相平衡关系(气-液溶解度,液-液溶解度, 干燥中的水蒸气分压),物料衡算关系和传质速率关系。 浓度表示法及其换算:重量百分率(质量分率) 的摩尔数 的摩尔数 摩尔比分率 的摩尔数 的摩尔数 的摩尔数 摩尔分率 质量百分率(质量分率) B A X A B A x m m kg m kg W A A A B A A = + = + = ( ) ( ) A A A A A A A A A B A A A A A A B A A A X X x x x X W M W M W M x x M x M x M W + = − = + − = + − = 1 1 1 1 § 2 理想溶液的汽 - 液平衡 Equilibrium of Gas-Liquid for Ideal Solutions 8-3 由制酒作坊引出相平衡 Introduction to Phase Equilibrium by Wine Making 大庆油田开采出来的是原油,如何将原油加工成汽油、煤油、柴油、重油呢?酿酒厂 酿制出了原酒,如何将粗酒加工成60°的白酒呢? 先介绍以下古老的烧酒作坊吧!目前江浙一带仍有这种家庭小作坊,主要分三步: (1) 粬的制作——发酵过程(获得菌种) (2) 粗酒的制作——将酒粬与蒸熟的米饭,按一定比例混合发酵,制成酒、水、酒 糟的糊状混和物(生物降解)
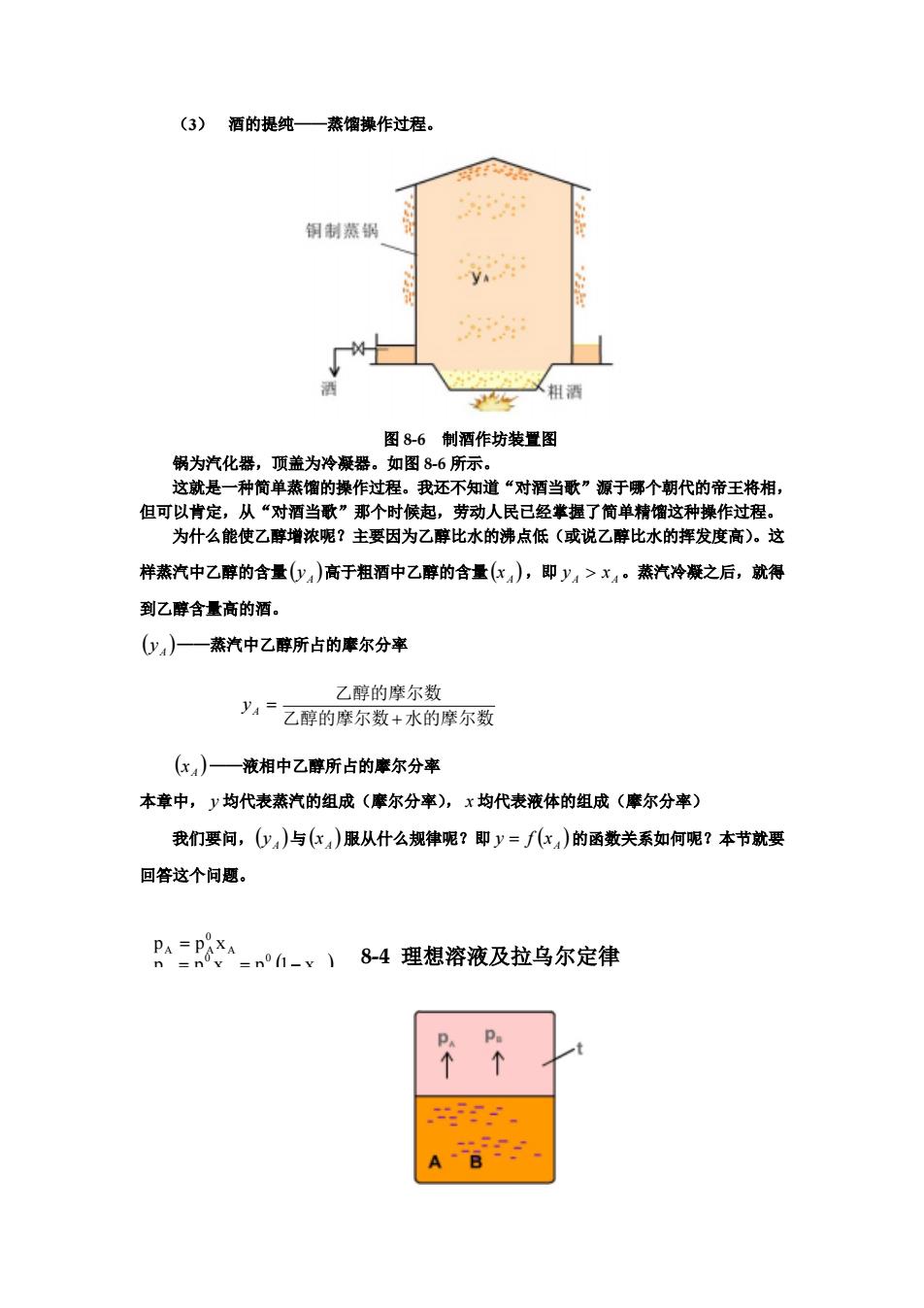
(3) 酒的提纯——蒸馏操作过程。 图 8-6 制酒作坊装置图 锅为汽化器,顶盖为冷凝器。如图 8-6 所示。 这就是一种简单蒸馏的操作过程。我还不知道“对酒当歌”源于哪个朝代的帝王将相, 但可以肯定,从“对酒当歌”那个时候起,劳动人民已经掌握了简单精馏这种操作过程。 为什么能使乙醇增浓呢?主要因为乙醇比水的沸点低(或说乙醇比水的挥发度高)。这 样蒸汽中乙醇的含量 高于粗酒中乙醇的含量( ,即 。蒸汽冷凝之后,就得 到乙醇含量高的酒。 ( A y ) ) ) A x A A y > x ( A y ——蒸汽中乙醇所占的摩尔分率 y A = 乙醇的摩尔数 水的摩尔数 乙醇的摩尔数 + ( A x ) ) ) ) ——液相中乙醇所占的摩尔分率 本章中, y 均代表蒸汽的组成(摩尔分率), x 均代表液体的组成(摩尔分率) 我们要问,( 与 服从什么规律呢?即 的函数关系如何呢?本节就要 回答这个问题。 A y ( A x ( A y = f x ( ) 0 0 A 0 A A p p x p 1 x p p x = = − = 8-4 理想溶液及拉乌尔定律
(3) 酒的提纯——蒸馏操作过程。 图 8-6 制酒作坊装置图 锅为汽化器,顶盖为冷凝器。如图 8-6 所示。 这就是一种简单蒸馏的操作过程。我还不知道“对酒当歌”源于哪个朝代的帝王将相, 但可以肯定,从“对酒当歌”那个时候起,劳动人民已经掌握了简单精馏这种操作过程。 为什么能使乙醇增浓呢?主要因为乙醇比水的沸点低(或说乙醇比水的挥发度高)。这 样蒸汽中乙醇的含量 高于粗酒中乙醇的含量( ,即 。蒸汽冷凝之后,就得 到乙醇含量高的酒。 ( A y ) ) ) A x A A y > x ( A y ——蒸汽中乙醇所占的摩尔分率 y A = 乙醇的摩尔数 水的摩尔数 乙醇的摩尔数 + ( A x ) ) ) ) ——液相中乙醇所占的摩尔分率 本章中, y 均代表蒸汽的组成(摩尔分率), x 均代表液体的组成(摩尔分率) 我们要问,( 与 服从什么规律呢?即 的函数关系如何呢?本节就要 回答这个问题。 A y ( A x ( A y = f x ( ) 0 0 A 0 A A p p x p 1 x p p x = = − = 8-4 理想溶液及拉乌尔定律
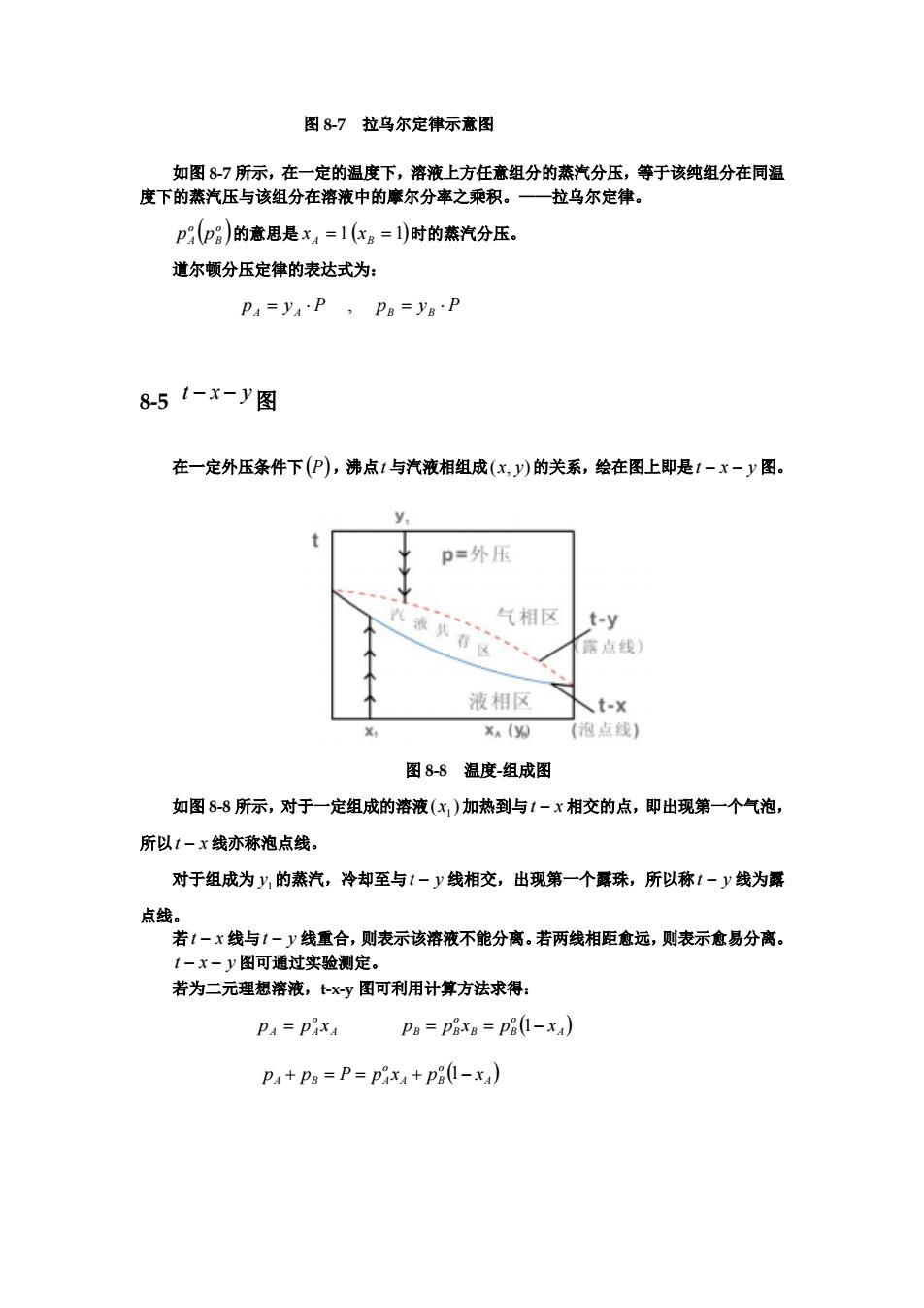
图 8-7 拉乌尔定律示意图 如图 8-7 所示,在一定的温度下,溶液上方任意组分的蒸汽分压,等于该纯组分在同温 度下的蒸汽压与该组分在溶液中的摩尔分率之乘积。——拉乌尔定律。 ( ) o B o A p p 的意思是 xA = 1 (xB = 1)时的蒸汽分压。 道尔顿分压定律的表达式为: p A = y A ⋅ P , pB = yB ⋅ P 8-5 t − x − y图 在一定外压条件下(P),沸点t 与汽液相组成(x, y)的关系,绘在图上即是t − x − y 图。 图 8-8 温度-组成图 如图 8-8 所示,对于一定组成的溶液 加热到与t 相交的点,即出现第一个气泡, 所以t 线亦称泡点线。 ( )1 x − x − x 对于组成为 的蒸汽,冷却至与t 线相交,出现第一个露珠,所以称t 线为露 点线。 1 y − y − y 若t − x 线与t − y 线重合,则表示该溶液不能分离。若两线相距愈远,则表示愈易分离。 t − x − y 图可通过实验测定。 若为二元理想溶液,t-x-y 图可利用计算方法求得: A o A A p = p x ( ) A o B B o B B p = p x = p 1− x ( ) A o A B o A B A p + p = P = p x + p 1− x
图 8-7 拉乌尔定律示意图 如图 8-7 所示,在一定的温度下,溶液上方任意组分的蒸汽分压,等于该纯组分在同温 度下的蒸汽压与该组分在溶液中的摩尔分率之乘积。——拉乌尔定律。 ( ) o B o A p p 的意思是 xA = 1 (xB = 1)时的蒸汽分压。 道尔顿分压定律的表达式为: p A = y A ⋅ P , pB = yB ⋅ P 8-5 t − x − y图 在一定外压条件下(P),沸点t 与汽液相组成(x, y)的关系,绘在图上即是t − x − y 图。 图 8-8 温度-组成图 如图 8-8 所示,对于一定组成的溶液 加热到与t 相交的点,即出现第一个气泡, 所以t 线亦称泡点线。 ( )1 x − x − x 对于组成为 的蒸汽,冷却至与t 线相交,出现第一个露珠,所以称t 线为露 点线。 1 y − y − y 若t − x 线与t − y 线重合,则表示该溶液不能分离。若两线相距愈远,则表示愈易分离。 t − x − y 图可通过实验测定。 若为二元理想溶液,t-x-y 图可利用计算方法求得: A o A A p = p x ( ) A o B B o B B p = p x = p 1− x ( ) A o A B o A B A p + p = P = p x + p 1− x

= = − − ∴ = P p x P p y p p P p x A o A A A o B o A o B A .(I) 式 说明,只要知道某温度下的 (饱和蒸汽压数据),就可以计算得到 与 , 就可以作出在指定外压( 下的t 图。式 还说明,总压 对 图是有影响 的。 (I) o B o A p 和p − y x y P) − x (I) P t − x − y 8-6 x-y 图 取t − x − y 图中的 x, y 数据,以 x 为横坐标, y 为纵坐标,绘成的图为 x − y 图。 如图 8-9 所示,用一条曲线表达汽-液相平衡,图面清晰,数据易查。 图 8-9 x-y 图 对于易挥发组分,因为 y A > xA ,所以 x − y 线均在对角线上方。 x − y 线与对角线偏离越远,表示越易分离。若 线与对角线重合,则不能用精馏 方法分离。 x − y 对于二元理想溶液, x − y 图可由式(I) 计算得到。 8-7 汽 - 液平衡解析表达式 Analytical Expressions of Phase Equilibrium 用图表达汽-液相平衡关系,利用计算机计算就十分不便,能不能用一解析式来表达呢? 挥发度——达到相平衡时,某组分在蒸汽中的分压(p A )和它在平衡液相中的摩尔分率
= = − − ∴ = P p x P p y p p P p x A o A A A o B o A o B A .(I) 式 说明,只要知道某温度下的 (饱和蒸汽压数据),就可以计算得到 与 , 就可以作出在指定外压( 下的t 图。式 还说明,总压 对 图是有影响 的。 (I) o B o A p 和p − y x y P) − x (I) P t − x − y 8-6 x-y 图 取t − x − y 图中的 x, y 数据,以 x 为横坐标, y 为纵坐标,绘成的图为 x − y 图。 如图 8-9 所示,用一条曲线表达汽-液相平衡,图面清晰,数据易查。 图 8-9 x-y 图 对于易挥发组分,因为 y A > xA ,所以 x − y 线均在对角线上方。 x − y 线与对角线偏离越远,表示越易分离。若 线与对角线重合,则不能用精馏 方法分离。 x − y 对于二元理想溶液, x − y 图可由式(I) 计算得到。 8-7 汽 - 液平衡解析表达式 Analytical Expressions of Phase Equilibrium 用图表达汽-液相平衡关系,利用计算机计算就十分不便,能不能用一解析式来表达呢? 挥发度——达到相平衡时,某组分在蒸汽中的分压(p A )和它在平衡液相中的摩尔分率

( A x )之比,叫做该组分的“挥发度”。 t 正庚烷 正辛烷 B B B A A A x p v x p v = , = 相对挥发度——各组分的挥发度之比,称为组分间的“相对挥发度”。 o B o A B B o B A A o A B B A A AB B A AB p p p x x p x x p x p x v v = ⋅ ⋅ α = , α = = 在本课程中,通常定义易挥发组分挥发度与难挥发组分挥发度之比为相对挥发度。这 样定义的α ,则α > 1。 对于二元理想溶液 ( ) ( ) o A A B o A o A B o A A o A B o A A o A A B A A x x p p x p p p x p x p x p p p y + − = + − = + = 1 1 ( ) A A A x x x + − = α 1 α ∴ ( ) 1 1 A A A x x y + − = α α .(II) 式(II) 为汽-液平衡的解析表达式。 由式(II) 得知,当α = 1时, y A = xA ,则表示该二元溶液不能用精馏的方法分离。 注意:以后所见的 x, y 均为易挥发组分浓度,就是表示 xA , y A 的意思。 8-8 相平衡计算举例 Calculation Examples of Phase Equilibrium 【例 8-1】正庚烷和正辛烷的饱和蒸汽压和温度的关系数据如下表所示。试求出该体系 的平均相对挥发度。 [ ] K 371.4 378 383 388 393 398.6 p [ ] kPa o A 101.3 125.3 140.0 160.0 180.0 205.0 p [ ] kPa o B 44.4 55.6 64.5 74.8 86.6 101.3
( A x )之比,叫做该组分的“挥发度”。 t 正庚烷 正辛烷 B B B A A A x p v x p v = , = 相对挥发度——各组分的挥发度之比,称为组分间的“相对挥发度”。 o B o A B B o B A A o A B B A A AB B A AB p p p x x p x x p x p x v v = ⋅ ⋅ α = , α = = 在本课程中,通常定义易挥发组分挥发度与难挥发组分挥发度之比为相对挥发度。这 样定义的α ,则α > 1。 对于二元理想溶液 ( ) ( ) o A A B o A o A B o A A o A B o A A o A A B A A x x p p x p p p x p x p x p p p y + − = + − = + = 1 1 ( ) A A A x x x + − = α 1 α ∴ ( ) 1 1 A A A x x y + − = α α .(II) 式(II) 为汽-液平衡的解析表达式。 由式(II) 得知,当α = 1时, y A = xA ,则表示该二元溶液不能用精馏的方法分离。 注意:以后所见的 x, y 均为易挥发组分浓度,就是表示 xA , y A 的意思。 8-8 相平衡计算举例 Calculation Examples of Phase Equilibrium 【例 8-1】正庚烷和正辛烷的饱和蒸汽压和温度的关系数据如下表所示。试求出该体系 的平均相对挥发度。 [ ] K 371.4 378 383 388 393 398.6 p [ ] kPa o A 101.3 125.3 140.0 160.0 180.0 205.0 p [ ] kPa o B 44.4 55.6 64.5 74.8 86.6 101.3

o B o A o B A p p P p x − − = 1.0 0.656 0.487 0.311 0.157 0 P p x y A o B A = 1.0 0.811 0.673 0.491 0.279 0 o B o A p p α = 2.282 2.254 2.171 2.139 2.079 2.024 2.157 6 12.949 6 = = = ∑α α §3 简单蒸馏及其计算 Simple Distillation and Its Calculations 8-9 简单蒸馏的装置 Equipments for Simple Distillation 在家庭制酒业中,即是一个简单蒸馏装置,只是冷凝装置较简单,是一个空气自然对 流冷却装置。 在实验室或工业生产中,采用如图 8-10 所示的装置,实质也是一个汽化器,一个冷凝 器。 图 8-10 简单精馏装置图 8-10 简单蒸馏的原理 Principles of Simple Distillation 在简单精馏的过程中:液相组成由 n x → x → x →L → x 1 2 3
o B o A o B A p p P p x − − = 1.0 0.656 0.487 0.311 0.157 0 P p x y A o B A = 1.0 0.811 0.673 0.491 0.279 0 o B o A p p α = 2.282 2.254 2.171 2.139 2.079 2.024 2.157 6 12.949 6 = = = ∑α α §3 简单蒸馏及其计算 Simple Distillation and Its Calculations 8-9 简单蒸馏的装置 Equipments for Simple Distillation 在家庭制酒业中,即是一个简单蒸馏装置,只是冷凝装置较简单,是一个空气自然对 流冷却装置。 在实验室或工业生产中,采用如图 8-10 所示的装置,实质也是一个汽化器,一个冷凝 器。 图 8-10 简单精馏装置图 8-10 简单蒸馏的原理 Principles of Simple Distillation 在简单精馏的过程中:液相组成由 n x → x → x →L → x 1 2 3

汽相组成(馏出液组成)由 n y → y → y →L → y 1 2 3 釜液量由 F → F − dn →L →W 若全部汽化,又全部冷凝,即最终釜液量W ,则达不到分离的目的。只有部分汽 化,部分冷凝,才可得到易挥发组分较高的馏出液。 = 0 由图 8-11 看出,当料液组成为 时,所得馏出液最高组成为 。所以用简单蒸馏的方 法,得不到纯度高的产品。 1 x 1 y 图 8-11 蒸馏原理示意图 8-11 简单蒸馏的计算公式 Calculation Formulae for Simple Distillation 设W ——任一瞬间蒸馏釜中的釜液量, kmol ; x ——任一瞬间釜液组成,摩尔分率; y ——任一瞬间蒸汽组成,摩尔分率; 经 dτ 时间后,溶液汽化量为 dW , 釜液组成变化为 dx , 如图 8-12 所示,在τ →τ + dτ 的时间间隔,对易挥发组份作衡算得: Wx = ( ) W − dW ⋅(x − dx)+ ydW .(a) 易挥发组分量 τ 时刻蒸馏釜中 挥发组分量 τ + dτ 时刻易 易挥发组分量 τ + dτ 蒸出的
汽相组成(馏出液组成)由 n y → y → y →L → y 1 2 3 釜液量由 F → F − dn →L →W 若全部汽化,又全部冷凝,即最终釜液量W ,则达不到分离的目的。只有部分汽 化,部分冷凝,才可得到易挥发组分较高的馏出液。 = 0 由图 8-11 看出,当料液组成为 时,所得馏出液最高组成为 。所以用简单蒸馏的方 法,得不到纯度高的产品。 1 x 1 y 图 8-11 蒸馏原理示意图 8-11 简单蒸馏的计算公式 Calculation Formulae for Simple Distillation 设W ——任一瞬间蒸馏釜中的釜液量, kmol ; x ——任一瞬间釜液组成,摩尔分率; y ——任一瞬间蒸汽组成,摩尔分率; 经 dτ 时间后,溶液汽化量为 dW , 釜液组成变化为 dx , 如图 8-12 所示,在τ →τ + dτ 的时间间隔,对易挥发组份作衡算得: Wx = ( ) W − dW ⋅(x − dx)+ ydW .(a) 易挥发组分量 τ 时刻蒸馏釜中 挥发组分量 τ + dτ 时刻易 易挥发组分量 τ + dτ 蒸出的

图 8-12 蒸馏计算原理推导图 整理式(a)得: Wx = Wx −Wdx − xdW + dW ⋅ dx + ydW 忽略高阶无穷小,即 dW ⋅ dx → 0 ,即得: y x dx W dW − = 若最初釜液量为 ,此时釜液组成为 ,最终釜液量为W ,此时釜液组成为 ,积 分上式: F F x Wx ∫ ∫ − = F W F W x x x x y x dx W dW ∫ − = F W x x y x dx W F ln .(b) 式(b) 可用图解积分求解。 若 ( )x x y 1+ −1 = α α ,代入上式积分得: 1 1 ln ln 1 1 ln − − + − = F W W F x x x x W F α α .(c) 若对最初与最终易挥发组分作衡算,则得: x F x W x (F W ) .( F = W ⋅ + D − d) 其中, xD 为馏出液的平均组成,摩尔分率; 式 、( 是简单蒸馏的计算公式。共有六个物理量( )两个方程 [式( 、 ],必须直接或间接的已知四个量,才可计算其他两个量。 (b) b) d) d) F ,W , x1 , x2 , xD ,α (
图 8-12 蒸馏计算原理推导图 整理式(a)得: Wx = Wx −Wdx − xdW + dW ⋅ dx + ydW 忽略高阶无穷小,即 dW ⋅ dx → 0 ,即得: y x dx W dW − = 若最初釜液量为 ,此时釜液组成为 ,最终釜液量为W ,此时釜液组成为 ,积 分上式: F F x Wx ∫ ∫ − = F W F W x x x x y x dx W dW ∫ − = F W x x y x dx W F ln .(b) 式(b) 可用图解积分求解。 若 ( )x x y 1+ −1 = α α ,代入上式积分得: 1 1 ln ln 1 1 ln − − + − = F W W F x x x x W F α α .(c) 若对最初与最终易挥发组分作衡算,则得: x F x W x (F W ) .( F = W ⋅ + D − d) 其中, xD 为馏出液的平均组成,摩尔分率; 式 、( 是简单蒸馏的计算公式。共有六个物理量( )两个方程 [式( 、 ],必须直接或间接的已知四个量,才可计算其他两个量。 (b) b) d) d) F ,W , x1 , x2 , xD ,α (