
第七章 吸收
第七章 吸收

第一节 概 述 一、工业中吸收的应用 1、吸收原理:与蒸馏操作相比,吸收广泛应用于气 体混合物的分离。 其原理是依靠气体混合物在某液体中的溶解度不 同,而进行分离的。所用的液体称为吸收剂。 气体中 易溶于吸收剂的组分A———溶质 不易溶于吸收剂的组分B——惰性气体
第一节 概 述 一、工业中吸收的应用 1、吸收原理:与蒸馏操作相比,吸收广泛应用于气 体混合物的分离。 其原理是依靠气体混合物在某液体中的溶解度不 同,而进行分离的。所用的液体称为吸收剂。 气体中 易溶于吸收剂的组分A———溶质 不易溶于吸收剂的组分B——惰性气体

2、工业中的应用 (1)原料气的净化——去除原料气中的杂质; (2)回收有用组分——合成氨生产中,用水回收氨; (3)某些产品的制取——工业中盐酸等的制取; (4)废气处理——去除废气中有害成分,如SO2等。 3、吸收分类 (1)按有无化学反应,分物理吸收和化学吸收。 例如 用NaOH吸收CO2就是化学吸收。 (2)按溶质气体数目,分单组分吸收和多组分吸 收。 (3)按有无明显热效应,分等温吸收与非等温 吸收
2、工业中的应用 (1)原料气的净化——去除原料气中的杂质; (2)回收有用组分——合成氨生产中,用水回收氨; (3)某些产品的制取——工业中盐酸等的制取; (4)废气处理——去除废气中有害成分,如SO2等。 3、吸收分类 (1)按有无化学反应,分物理吸收和化学吸收。 例如 用NaOH吸收CO2就是化学吸收。 (2)按溶质气体数目,分单组分吸收和多组分吸 收。 (3)按有无明显热效应,分等温吸收与非等温 吸收

二、吸收的流程和溶剂 1、吸收流程 如图 从合成氨原料气中回收CO2。乙醇胺对CO2有较大溶解 度,选乙醇胺做溶剂。溶剂要回收循环使用,又有了 CO2解吸塔。 吸收塔、解吸塔、锅炉构成了CO2 回收的工段或车间。 进工段的是合成氨原料气,出工段的是CO2和低浓CO2 的合成氨气
二、吸收的流程和溶剂 1、吸收流程 如图 从合成氨原料气中回收CO2。乙醇胺对CO2有较大溶解 度,选乙醇胺做溶剂。溶剂要回收循环使用,又有了 CO2解吸塔。 吸收塔、解吸塔、锅炉构成了CO2 回收的工段或车间。 进工段的是合成氨原料气,出工段的是CO2和低浓CO2 的合成氨气
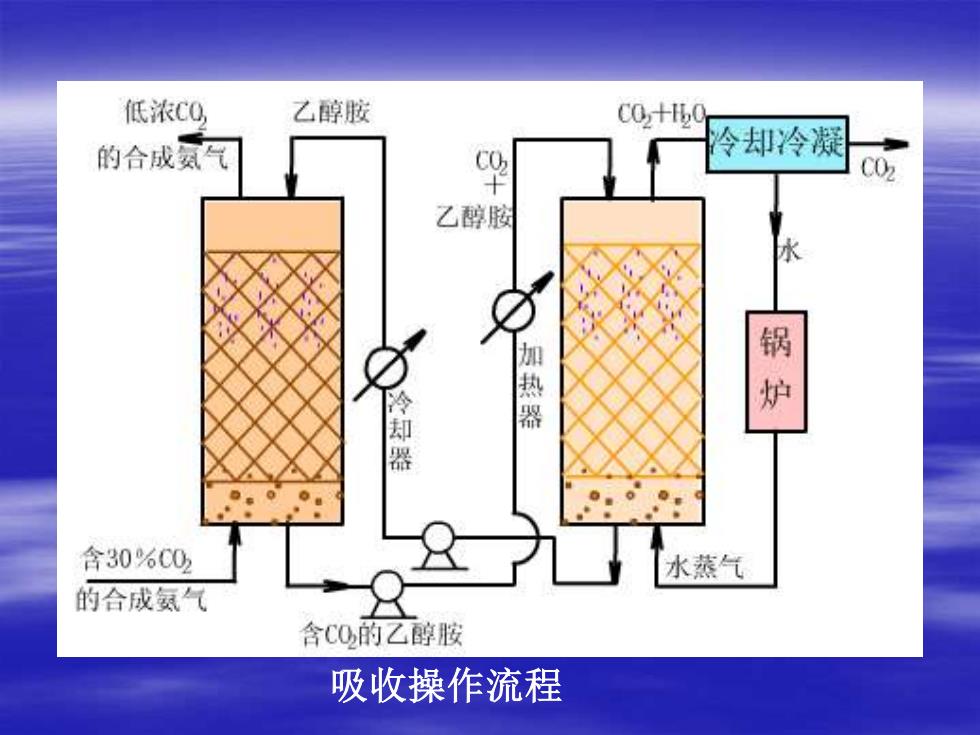
吸收操作流程
吸收操作流程

三、学习内容和目的 本章重点讨论的是单组分等温的物理吸收 1、掌握气体在液体中的溶解平衡关系—亨利定律 2、掌握传质速率方程 3、吸收塔的计算 4、了解吸收塔的结构
三、学习内容和目的 本章重点讨论的是单组分等温的物理吸收 1、掌握气体在液体中的溶解平衡关系—亨利定律 2、掌握传质速率方程 3、吸收塔的计算 4、了解吸收塔的结构
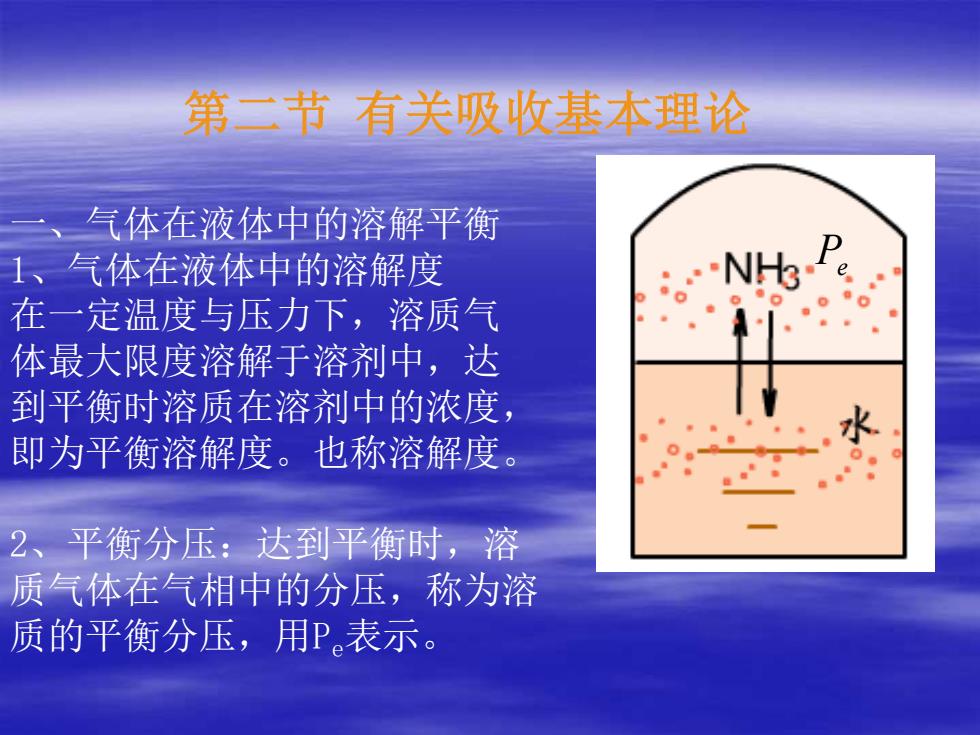
第二节 有关吸收基本理论 一、气体在液体中的溶解平衡 1、气体在液体中的溶解度 在一定温度与压力下,溶质气 体最大限度溶解于溶剂中,达 到平衡时溶质在溶剂中的浓度, 即为平衡溶解度。也称溶解度。 2、平衡分压:达到平衡时,溶 质气体在气相中的分压,称为溶 质的平衡分压,用Pe表示。 Pe
第二节 有关吸收基本理论 一、气体在液体中的溶解平衡 1、气体在液体中的溶解度 在一定温度与压力下,溶质气 体最大限度溶解于溶剂中,达 到平衡时溶质在溶剂中的浓度, 即为平衡溶解度。也称溶解度。 2、平衡分压:达到平衡时,溶 质气体在气相中的分压,称为溶 质的平衡分压,用Pe表示。 Pe

3、溶解度曲线——平衡曲线 将平衡分压(Pe)与溶解度之间的关系作成曲线,称 为溶解度曲线。 有如下特点: ① 相同的温度和分压,不同气体的溶解度差别很大; ② 一般,气体溶质的溶解度随温度升高而降低,随分 压增大而增加。 二、亨利定律 1、当总压不高(<5×105Pa)时,一定温度下,稀溶 液上方溶质的平衡分压与其在液相中的浓度之间存在 着如下的关系:
3、溶解度曲线——平衡曲线 将平衡分压(Pe)与溶解度之间的关系作成曲线,称 为溶解度曲线。 有如下特点: ① 相同的温度和分压,不同气体的溶解度差别很大; ② 一般,气体溶质的溶解度随温度升高而降低,随分 压增大而增加。 二、亨利定律 1、当总压不高(<5×105Pa)时,一定温度下,稀溶 液上方溶质的平衡分压与其在液相中的浓度之间存在 着如下的关系:

Pe -溶质在气相中的平衡分压, kPa; X-溶质在液相中的摩尔分率; E-享利系数, kPa Pe=E·X 2、在应用时,亨利定律还有其它的表达形式: C——液相中气体溶质的摩尔浓度, kmol/m3 ; H——溶解度系数, kmol/m·kN; (1) H C Pe =
Pe -溶质在气相中的平衡分压, kPa; X-溶质在液相中的摩尔分率; E-享利系数, kPa Pe=E·X 2、在应用时,亨利定律还有其它的表达形式: C——液相中气体溶质的摩尔浓度, kmol/m3 ; H——溶解度系数, kmol/m·kN; (1) H C Pe =

(2) — —相平衡常数 — —平衡时溶质的液相分率; — —平衡时溶质的气相分率; 令 , 对于 ,两边除以总压 , m x y m y m x P E y P P P E x P P P E x P e e e = = = = = 上述三种表达式都反映了达到溶解平衡时,溶质在气相 中的平衡分压与其在液相中的溶解度的关系
(2) — —相平衡常数 — —平衡时溶质的液相分率; — —平衡时溶质的气相分率; 令 , 对于 ,两边除以总压 , m x y m y m x P E y P P P E x P P P E x P e e e = = = = = 上述三种表达式都反映了达到溶解平衡时,溶质在气相 中的平衡分压与其在液相中的溶解度的关系