1 第五章 蒸发 §1 概述 5-1 蒸发的用途和分类 在日常生活中,熬中药、煲猪骨汤,许多人都操作过。抓中药时,医生会嘱咐,三碗水 煎成一碗水。熬中药的过程,既是一个中药有效成份的溶解过程,又是一个蒸发过程。广东 人煲的“老火靓汤”这一过程,也包含了蒸发过程。 什么叫蒸发?将溶液加热,使其中部分溶剂气化并不断去除,以提高溶液中的溶质浓度 的过程即蒸发。熬中药时,如果不是三碗水煎成一碗水,则三碗水中的药物浓度不高,药效 就不够。如图 5-1 所示。 图 5-1 蒸发示意图 在化工生产中,NaOH 溶液增浓、稀糖液的浓缩、由海水蒸发并冷凝制备淡水等都是采用 蒸发操作来实现的。 蒸发的方式有自然蒸发和沸腾蒸发。自然蒸发是溶液中的溶剂在低于沸点下汽化,例如 海盐的晒制。沸腾蒸发是使溶液中的溶剂在沸点时汽化,在溶液各个部分都同时发生汽化现 象。因此,沸腾蒸发的速率远超过自然蒸发速率。 蒸发可按蒸发器内的压力分为常压、加压和减压蒸发。减压蒸发又称为真空蒸发。按二 次蒸汽利用的情况分为单效蒸发和多效蒸发。若将所产生的二次蒸汽不再利用或被利用于蒸 发器以外这种操作,称为单效蒸发;如果将二次蒸汽引至另一压力较低的蒸发器加热室,作 为加热蒸汽来使用,这种操作称为多效操作蒸发
1 第五章 蒸发 §1 概述 5-1 蒸发的用途和分类 在日常生活中,熬中药、煲猪骨汤,许多人都操作过。抓中药时,医生会嘱咐,三碗水 煎成一碗水。熬中药的过程,既是一个中药有效成份的溶解过程,又是一个蒸发过程。广东 人煲的“老火靓汤”这一过程,也包含了蒸发过程。 什么叫蒸发?将溶液加热,使其中部分溶剂气化并不断去除,以提高溶液中的溶质浓度 的过程即蒸发。熬中药时,如果不是三碗水煎成一碗水,则三碗水中的药物浓度不高,药效 就不够。如图 5-1 所示。 图 5-1 蒸发示意图 在化工生产中,NaOH 溶液增浓、稀糖液的浓缩、由海水蒸发并冷凝制备淡水等都是采用 蒸发操作来实现的。 蒸发的方式有自然蒸发和沸腾蒸发。自然蒸发是溶液中的溶剂在低于沸点下汽化,例如 海盐的晒制。沸腾蒸发是使溶液中的溶剂在沸点时汽化,在溶液各个部分都同时发生汽化现 象。因此,沸腾蒸发的速率远超过自然蒸发速率。 蒸发可按蒸发器内的压力分为常压、加压和减压蒸发。减压蒸发又称为真空蒸发。按二 次蒸汽利用的情况分为单效蒸发和多效蒸发。若将所产生的二次蒸汽不再利用或被利用于蒸 发器以外这种操作,称为单效蒸发;如果将二次蒸汽引至另一压力较低的蒸发器加热室,作 为加热蒸汽来使用,这种操作称为多效操作蒸发
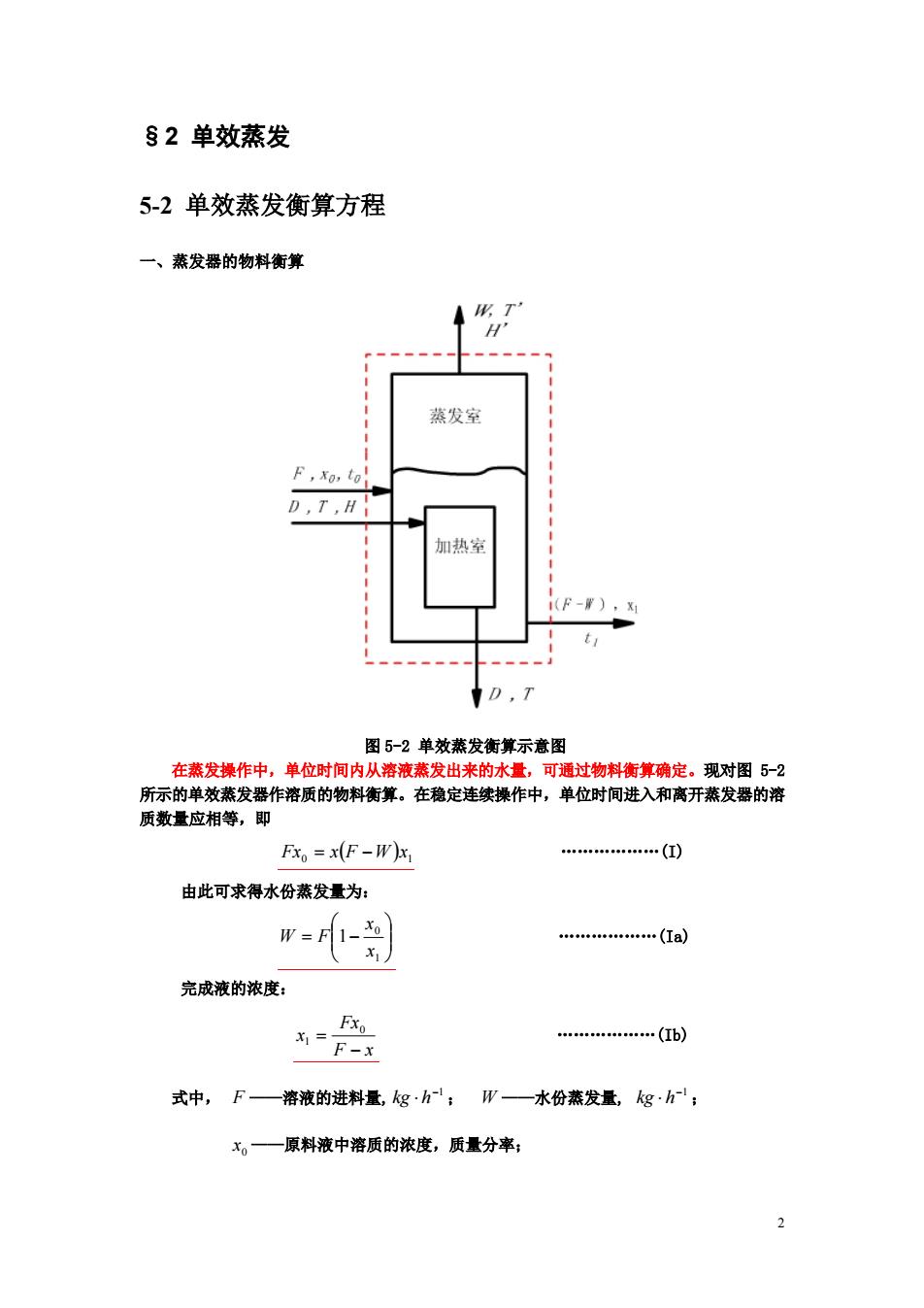
2 §2 单效蒸发 5-2 单效蒸发衡算方程 一、 蒸发器的物料衡算 图 5-2 单效蒸发衡算示意图 在蒸发操作中,单位时间内从溶液蒸发出来的水量,可通过物料衡算确定。现对图 5-2 所示的单效蒸发器作溶质的物料衡算。在稳定连续操作中,单位时间进入和离开蒸发器的溶 质数量应相等,即 ( ) 0 1 Fx = x F −W x .(I) 由此可求得水份蒸发量为: = − 1 0 1 x x W F .(Ia) 完成液的浓度: F x Fx x − = 0 1 .(Ib) 式中, F ——溶液的进料量, −1 kg ⋅ h ; W ——水份蒸发量, −1 kg ⋅ h ; 0 x ——原料液中溶质的浓度,质量分率;
2 §2 单效蒸发 5-2 单效蒸发衡算方程 一、 蒸发器的物料衡算 图 5-2 单效蒸发衡算示意图 在蒸发操作中,单位时间内从溶液蒸发出来的水量,可通过物料衡算确定。现对图 5-2 所示的单效蒸发器作溶质的物料衡算。在稳定连续操作中,单位时间进入和离开蒸发器的溶 质数量应相等,即 ( ) 0 1 Fx = x F −W x .(I) 由此可求得水份蒸发量为: = − 1 0 1 x x W F .(Ia) 完成液的浓度: F x Fx x − = 0 1 .(Ib) 式中, F ——溶液的进料量, −1 kg ⋅ h ; W ——水份蒸发量, −1 kg ⋅ h ; 0 x ——原料液中溶质的浓度,质量分率;

3 1 x ——完成液中溶质的浓度,质量分率 二、 蒸发器的热量衡算 对图 5-2 的虚线范围作热量衡算得: ( ) 1 1 ' DH + FCF t0 = WH + FCF −WCW t + DCwT 或 ( ) ( ) ( ) w w F QL D H − C T = W H − C t1 + FC t1 − t0 + ' 1 .(II) 式中, D ——加热蒸汽流率, −1 kg ⋅s ; H , H'——分别是加热蒸汽和二次蒸汽的焓, −1 J ⋅ kg ; CF ,CW ——-分别是原料液和水的比热, −1 −1 J ⋅ kg ⋅ K ; 0t 、 1t ——分别是原料温度和溶液的沸点,K; T1——冷凝液的饱和温度,K; QL ——蒸发器的热损失, −1 J ⋅s ; ∵ , ' ' 1 1 H − C T = γ H −C T = γ w w ∴ F QL D = W + FC (t1 − t0 ) + ' γ γ γ γ F QL W FC t t D + − + = ( ) 1 0 ' .(IIa) 式中,γ,γ` ——分别为加热蒸汽与二次蒸汽的汽化潜热, −1 J ⋅ kg ; 若原料液在沸点下进入蒸发器,即 kg,再忽略热损失,即 = 0 QL ,则式(IIa)得: γ γ' = W D .(IIb) D/W 称为单位蒸汽消耗量,即蒸发 1kg 水所需蒸汽量, kg蒸汽⋅ kg −1 水 由于二次蒸汽γ '与加热蒸汽γ ,随压力变化不大,即γ '= γ , ∴ = 1 W D 即原料液为沸点进料并忽略热损失时,加热蒸汽消耗量与二次蒸汽生成量 相等
3 1 x ——完成液中溶质的浓度,质量分率 二、 蒸发器的热量衡算 对图 5-2 的虚线范围作热量衡算得: ( ) 1 1 ' DH + FCF t0 = WH + FCF −WCW t + DCwT 或 ( ) ( ) ( ) w w F QL D H − C T = W H − C t1 + FC t1 − t0 + ' 1 .(II) 式中, D ——加热蒸汽流率, −1 kg ⋅s ; H , H'——分别是加热蒸汽和二次蒸汽的焓, −1 J ⋅ kg ; CF ,CW ——-分别是原料液和水的比热, −1 −1 J ⋅ kg ⋅ K ; 0t 、 1t ——分别是原料温度和溶液的沸点,K; T1——冷凝液的饱和温度,K; QL ——蒸发器的热损失, −1 J ⋅s ; ∵ , ' ' 1 1 H − C T = γ H −C T = γ w w ∴ F QL D = W + FC (t1 − t0 ) + ' γ γ γ γ F QL W FC t t D + − + = ( ) 1 0 ' .(IIa) 式中,γ,γ` ——分别为加热蒸汽与二次蒸汽的汽化潜热, −1 J ⋅ kg ; 若原料液在沸点下进入蒸发器,即 kg,再忽略热损失,即 = 0 QL ,则式(IIa)得: γ γ' = W D .(IIb) D/W 称为单位蒸汽消耗量,即蒸发 1kg 水所需蒸汽量, kg蒸汽⋅ kg −1 水 由于二次蒸汽γ '与加热蒸汽γ ,随压力变化不大,即γ '= γ , ∴ = 1 W D 即原料液为沸点进料并忽略热损失时,加热蒸汽消耗量与二次蒸汽生成量 相等

4 5-3 蒸发衡算计算举例 【例 5-1】在单效蒸发中,每小时将2000 kg 的某种水溶液从10% 连续浓缩到30%, 蒸发操作的平均压力为39.3kPa ,相应的溶液的沸点为80 ℃。加热蒸汽绝压为196kPa .原 料液的比热为 1 1 3.77 − − kJ ⋅ kg ⋅ K 。蒸发器的热损失为12000W 。试求: (1) 蒸发量 (2) 原料液温度分别为 30℃、80℃和 120℃时的加热蒸汽消耗量及单位蒸汽消耗量。 解:(1)蒸发量 由(I)式知 1 1 0 1333 0.3 0.1 1 2000 1 − = ⋅ = − W = F − kg h χ χ (2)加热蒸汽消耗量 由(IIa)式知 1 1 0 ' ( ) γ γ F QL W FC t t D + − + = 由附录查得压力为 39.3和196kPa 时的饱和蒸汽的汽化潜热分别为 2320 和 2204 −1 kJ ⋅ kg ,原料液温度为 30℃时的蒸汽消耗量为: ( ) 1 1590 2204 3600 1000 12000 1333 2320 2000 3.77 80 30 − = ⋅ × + × × − + × D = kg h 单位蒸汽消耗量为: 1.2 1333 1590 = = W D 原料液温度为 80℃时的蒸汽消耗量: 1 1420 2204 1333 2320 12000 3.6 − = ⋅ × + × D = kg h 单位蒸汽消耗量为: 1.1 1333 1420 = = W D 原料液温度为 120℃时的蒸汽消耗量为: ( ) 1 1280 2204 1333 2320 2000 3.77 80 120 1200 3.6 − = ⋅ × + × × − + × D = kg h 单位蒸汽消耗量为: 0.96 1333 1280 = = W D 由以上计算结果得知,原料液的温度愈高,蒸发 1kg 水所消耗的加热蒸汽量愈少
4 5-3 蒸发衡算计算举例 【例 5-1】在单效蒸发中,每小时将2000 kg 的某种水溶液从10% 连续浓缩到30%, 蒸发操作的平均压力为39.3kPa ,相应的溶液的沸点为80 ℃。加热蒸汽绝压为196kPa .原 料液的比热为 1 1 3.77 − − kJ ⋅ kg ⋅ K 。蒸发器的热损失为12000W 。试求: (1) 蒸发量 (2) 原料液温度分别为 30℃、80℃和 120℃时的加热蒸汽消耗量及单位蒸汽消耗量。 解:(1)蒸发量 由(I)式知 1 1 0 1333 0.3 0.1 1 2000 1 − = ⋅ = − W = F − kg h χ χ (2)加热蒸汽消耗量 由(IIa)式知 1 1 0 ' ( ) γ γ F QL W FC t t D + − + = 由附录查得压力为 39.3和196kPa 时的饱和蒸汽的汽化潜热分别为 2320 和 2204 −1 kJ ⋅ kg ,原料液温度为 30℃时的蒸汽消耗量为: ( ) 1 1590 2204 3600 1000 12000 1333 2320 2000 3.77 80 30 − = ⋅ × + × × − + × D = kg h 单位蒸汽消耗量为: 1.2 1333 1590 = = W D 原料液温度为 80℃时的蒸汽消耗量: 1 1420 2204 1333 2320 12000 3.6 − = ⋅ × + × D = kg h 单位蒸汽消耗量为: 1.1 1333 1420 = = W D 原料液温度为 120℃时的蒸汽消耗量为: ( ) 1 1280 2204 1333 2320 2000 3.77 80 120 1200 3.6 − = ⋅ × + × × − + × D = kg h 单位蒸汽消耗量为: 0.96 1333 1280 = = W D 由以上计算结果得知,原料液的温度愈高,蒸发 1kg 水所消耗的加热蒸汽量愈少

5 5-4 蒸发器传热面积 蒸发器的传热面积可依传热基本方程式求得,即 m K t Q A ∆ = .( III) 式中, A ——蒸发器的传热面积, 2 m ; K ——蒸发器的传热系数, −2 −1 W ⋅ m ⋅ K ; ∆Tm ——传热的平均温度差, K ; Q ——蒸发器的热负荷或传热速率,W 。 式( III)中的热负荷依热量衡算求取,显然Q = D ⋅γ 。其中传热系数 K 亦可按蒸汽冷凝 和液体沸腾对流传热求出间壁两侧的对流传热系数,及按经验估计的垢层热阻进行计算。对 于蒸发器的传热温度差,因为蒸发过程是间壁两侧的蒸汽冷凝和溶液沸腾之间的恒温传热, 所以 1 1 T T t ∆ m = − ,但是水溶液的沸点 t1的确定方法还有待于 5-6 节中进行讨论 。 5-5 传热面积计算举例 【例 5-2】 在单效蒸发器中,将15% 的 CaCl2 水溶液连续浓缩到25% ,原料液流量为 1 20000 − kg ⋅ h ,温度为75℃。蒸发操作的平均威力为 49kPa ,溶液的沸点为87.5 ℃。加 热蒸汽绝压为196kPa 。若蒸发器的总传热系数 K 为 2 1 1000 − − W ⋅ m ⋅ K ,热损失为蒸发器传 热量的5 %,试求蒸发器的传热面积和加热蒸汽消耗量。 解:蒸发量为 1 1 0 2.22 0.25 0.15 1 3600 20000 1 − = ⋅ = − W = F − kg s χ χ 蒸发器的热负荷为: Q = W ⋅γ '+FCF ( )( ) t1 − t0 × 1+ 5% 而其中原料液比热为: () ( ) 1 1 0 1 4.187 1 01.5 3.56 − − CF = CW − x = − = kJ ⋅ kg ⋅ K 由附录查得 49kPa 下饱各蒸汽的汽化潜热γ '为 1 2305 − kJ ⋅ kg 。所以 Q ( ) W 3 3 6 3.56 10 87.5 75 5.63 10 3600 20000 1.05 2.22 2305 10 = × = × × × + × × × − 又由附录查得196kPa 下饱各蒸汽温度为119.6℃,汽化潜热为 1 2203 − kJ ⋅ kg 所以蒸发器的传热面积为:
5 5-4 蒸发器传热面积 蒸发器的传热面积可依传热基本方程式求得,即 m K t Q A ∆ = .( III) 式中, A ——蒸发器的传热面积, 2 m ; K ——蒸发器的传热系数, −2 −1 W ⋅ m ⋅ K ; ∆Tm ——传热的平均温度差, K ; Q ——蒸发器的热负荷或传热速率,W 。 式( III)中的热负荷依热量衡算求取,显然Q = D ⋅γ 。其中传热系数 K 亦可按蒸汽冷凝 和液体沸腾对流传热求出间壁两侧的对流传热系数,及按经验估计的垢层热阻进行计算。对 于蒸发器的传热温度差,因为蒸发过程是间壁两侧的蒸汽冷凝和溶液沸腾之间的恒温传热, 所以 1 1 T T t ∆ m = − ,但是水溶液的沸点 t1的确定方法还有待于 5-6 节中进行讨论 。 5-5 传热面积计算举例 【例 5-2】 在单效蒸发器中,将15% 的 CaCl2 水溶液连续浓缩到25% ,原料液流量为 1 20000 − kg ⋅ h ,温度为75℃。蒸发操作的平均威力为 49kPa ,溶液的沸点为87.5 ℃。加 热蒸汽绝压为196kPa 。若蒸发器的总传热系数 K 为 2 1 1000 − − W ⋅ m ⋅ K ,热损失为蒸发器传 热量的5 %,试求蒸发器的传热面积和加热蒸汽消耗量。 解:蒸发量为 1 1 0 2.22 0.25 0.15 1 3600 20000 1 − = ⋅ = − W = F − kg s χ χ 蒸发器的热负荷为: Q = W ⋅γ '+FCF ( )( ) t1 − t0 × 1+ 5% 而其中原料液比热为: () ( ) 1 1 0 1 4.187 1 01.5 3.56 − − CF = CW − x = − = kJ ⋅ kg ⋅ K 由附录查得 49kPa 下饱各蒸汽的汽化潜热γ '为 1 2305 − kJ ⋅ kg 。所以 Q ( ) W 3 3 6 3.56 10 87.5 75 5.63 10 3600 20000 1.05 2.22 2305 10 = × = × × × + × × × − 又由附录查得196kPa 下饱各蒸汽温度为119.6℃,汽化潜热为 1 2203 − kJ ⋅ kg 所以蒸发器的传热面积为:

6 ( ) ( ) 2 6 1 1 175 1000 119.6 87.5 5.63 10 m K T t Q A = × − × = − = 加热蒸汽消耗量为: 1 3 6 2.56 2203 10 5.63 10 − = ⋅ × × = = kg s Q D γ 5-6 因蒸汽压下降引起沸点升高 所谓传热温度差,即加热蒸汽温度T 与溶液沸点温度t 之差,即 t T t ∆ m = − 。而溶 液的沸点由于有了溶质 A 的加入,使蒸气压下降,导致沸点升高,即高于纯水在相同压 力下的沸点( 0t ),即 0 t > t 。这个沸点升高到起的温度差 m ∆t 下降,即温度差损失(∆ )。 一般教材中讲有三种温度差损失,分别为Δ'、Δ''、Δ'''。如图 5-3 所示。 加热蒸汽温度,T 实际温度差 t T t ∆ m = − 溶液沸点,t 纯水沸点, 0t 理论温度差, 0 t T t ∆ T = − 图 5-3 温度差损失示意图 温度差损失 ( )( ) 0 0 t t T t T t t t ∆ = ∆ T − ∆ m = − − − = − 本教程换一个证法,重点研究溶液沸点升高值。某些无机物溶液在常压下的沸点可查有 关化工手册。 非常压下计算无机物溶液的沸点,常采用杜林规则。杜林规则为:某溶液在两种不同压 力下,两沸点之差( ) ' A A t − t 与另一标准液体在相应压力下两沸点之差( ) ' w w t − t ,其比值为常 数,即: K t t t t w w A A = − − ' ' .(IV)
6 ( ) ( ) 2 6 1 1 175 1000 119.6 87.5 5.63 10 m K T t Q A = × − × = − = 加热蒸汽消耗量为: 1 3 6 2.56 2203 10 5.63 10 − = ⋅ × × = = kg s Q D γ 5-6 因蒸汽压下降引起沸点升高 所谓传热温度差,即加热蒸汽温度T 与溶液沸点温度t 之差,即 t T t ∆ m = − 。而溶 液的沸点由于有了溶质 A 的加入,使蒸气压下降,导致沸点升高,即高于纯水在相同压 力下的沸点( 0t ),即 0 t > t 。这个沸点升高到起的温度差 m ∆t 下降,即温度差损失(∆ )。 一般教材中讲有三种温度差损失,分别为Δ'、Δ''、Δ'''。如图 5-3 所示。 加热蒸汽温度,T 实际温度差 t T t ∆ m = − 溶液沸点,t 纯水沸点, 0t 理论温度差, 0 t T t ∆ T = − 图 5-3 温度差损失示意图 温度差损失 ( )( ) 0 0 t t T t T t t t ∆ = ∆ T − ∆ m = − − − = − 本教程换一个证法,重点研究溶液沸点升高值。某些无机物溶液在常压下的沸点可查有 关化工手册。 非常压下计算无机物溶液的沸点,常采用杜林规则。杜林规则为:某溶液在两种不同压 力下,两沸点之差( ) ' A A t − t 与另一标准液体在相应压力下两沸点之差( ) ' w w t − t ,其比值为常 数,即: K t t t t w w A A = − − ' ' .(IV)
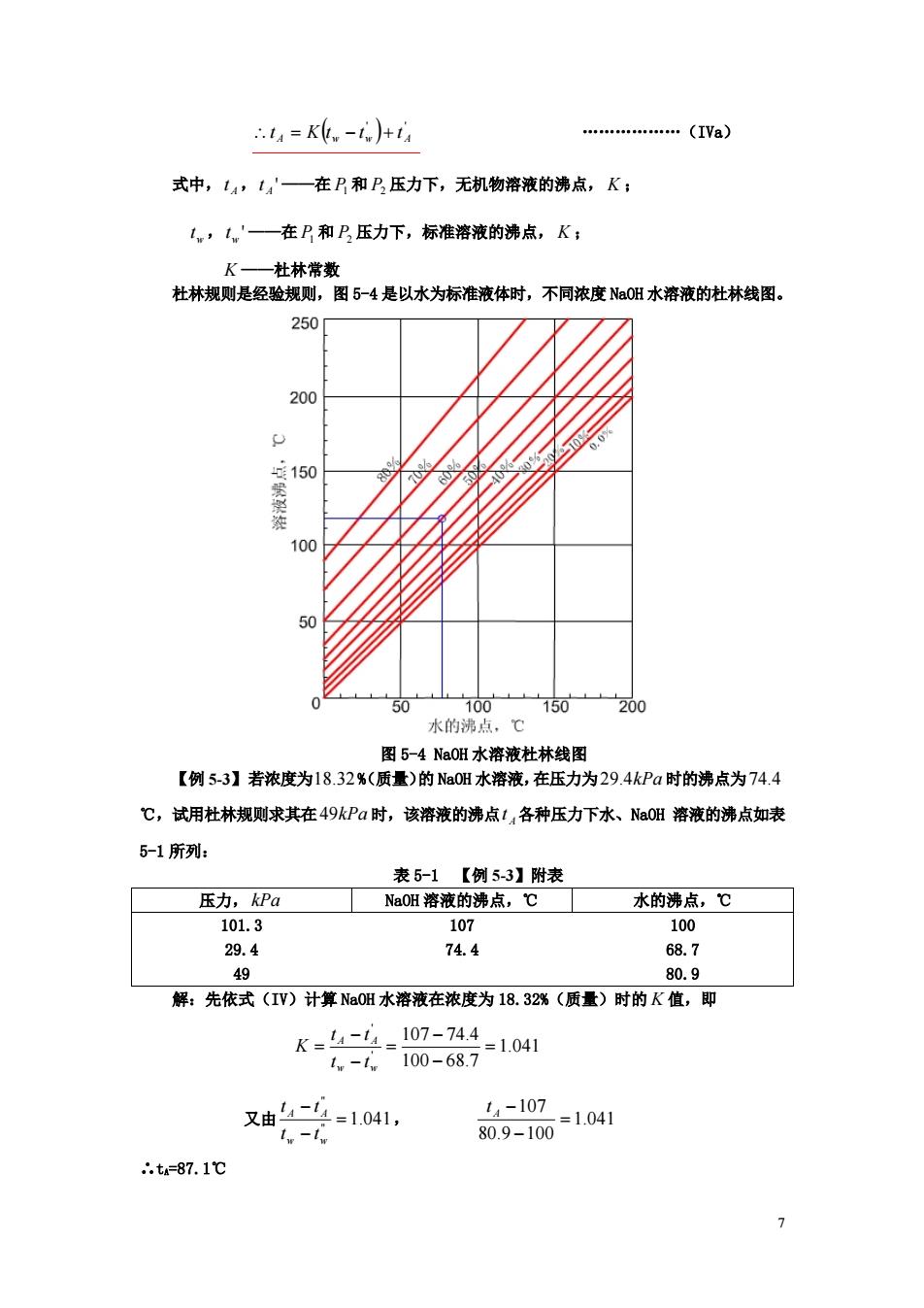
7 ( ) ' ' A w w A ∴t = K t − t + t .(IVa) 式中, At , ' At ——在 P1 和 P2 压力下,无机物溶液的沸点, K ; wt , ' wt ——在 P1 和 P2 压力下,标准溶液的沸点, K ; K ——杜林常数 杜林规则是经验规则,图 5-4 是以水为标准液体时,不同浓度 NaOH 水溶液的杜林线图。 图 5-4 NaOH 水溶液杜林线图 【例 5-3】若浓度为18.32%(质量)的 NaOH 水溶液,在压力为29.4kPa 时的沸点为74.4 ℃,试用杜林规则求其在49kPa 时,该溶液的沸点 At 各种压力下水、NaOH 溶液的沸点如表 5-1 所列: 表 5-1 【例 5-3】附表 压力, kPa NaOH 溶液的沸点,℃ 水的沸点,℃ 101.3 107 100 29.4 74.4 68.7 49 80.9 解:先依式(IV)计算 NaOH 水溶液在浓度为 18.32%(质量)时的 K 值,即 1.041 100 68.7 107 74.4 ' ' = − − = − − = w w A A t t t t K 又由 1.041 '' '' = − − w w A A t t t t , 1.041 80.9 100 107 = − t A − ∴tA=87.1℃
7 ( ) ' ' A w w A ∴t = K t − t + t .(IVa) 式中, At , ' At ——在 P1 和 P2 压力下,无机物溶液的沸点, K ; wt , ' wt ——在 P1 和 P2 压力下,标准溶液的沸点, K ; K ——杜林常数 杜林规则是经验规则,图 5-4 是以水为标准液体时,不同浓度 NaOH 水溶液的杜林线图。 图 5-4 NaOH 水溶液杜林线图 【例 5-3】若浓度为18.32%(质量)的 NaOH 水溶液,在压力为29.4kPa 时的沸点为74.4 ℃,试用杜林规则求其在49kPa 时,该溶液的沸点 At 各种压力下水、NaOH 溶液的沸点如表 5-1 所列: 表 5-1 【例 5-3】附表 压力, kPa NaOH 溶液的沸点,℃ 水的沸点,℃ 101.3 107 100 29.4 74.4 68.7 49 80.9 解:先依式(IV)计算 NaOH 水溶液在浓度为 18.32%(质量)时的 K 值,即 1.041 100 68.7 107 74.4 ' ' = − − = − − = w w A A t t t t K 又由 1.041 '' '' = − − w w A A t t t t , 1.041 80.9 100 107 = − t A − ∴tA=87.1℃

8 图 5-4 是以水为标准液体时,不同浓度 NaOH 水溶液的杜林线图。可以利用杜林线求取 不同浓度的溶液在任一压力下的沸点 At 。 5-7 溶液静压力引起沸点升高 蒸发器在操作时,器内需维持一定的液面高度(L),因而蒸发器内溶液的压力要高于表 面的压力。致使溶液内部的沸点高于液面处的沸点。此沸点之差,即因静压力引起的沸点升 高值。 图 5-5 溶液内部压力推导图。 如图 5-5 所示,设溶液的平均压强为 Pm ,操作压强(或二次蒸汽压强)为 P ,溶液内部 的压强按液面和底部间的平均压强计算,即 ( ) 2 2 gL P P P gL Pm ρ ρ = + + + = .(V) 式中, ρ ——溶液平均密度, −3 kg ⋅ m ; p ——二次蒸汽压强, Pa ; L ——液层高度, m 。 这样,溶液平均压强对应的沸点,就比操作压强对应的沸点要高。 【例 5-4】 蒸发浓度为50 %(质量百分率)的 NaOH 水溶液时,若蒸汽压为40kPa ,蒸 发器内溶液高度为 L = 2m ,溶液密度为 3 1450 − ρ = kg ⋅ m ,试求此时溶液的沸点。 解:查饱和水蒸气压表得,压力为40kPa 的水蒸气,沸点为75℃,以水的沸点75℃, 查图 5-4 的杜林线图,得117 ℃(此为溶液表面的沸点温度)。 若考虑溶液高度 L = 2m ,蒸发器内部压力为: m a a kP kP gL P P 54.22 2 1450 9.81 2 40 2 = × × = + = + ρ 压力为54.22kPa时,查得水蒸汽沸点为83.06℃, ∴因静压力的沸点升高为83.06 − 75 = 8.06℃ ∴此时溶液沸点为117 + 8.06 = 125 ℃。 因管路阻力,引起的溶液沸点升高值。根据经验,沸点升高值可取1 ~ 1.5 ℃。此处不 再详述。 综上所述,蒸发溶液温度的计算,影响着蒸发传热的温度差 m ∆t ,进而影响传热的速率
8 图 5-4 是以水为标准液体时,不同浓度 NaOH 水溶液的杜林线图。可以利用杜林线求取 不同浓度的溶液在任一压力下的沸点 At 。 5-7 溶液静压力引起沸点升高 蒸发器在操作时,器内需维持一定的液面高度(L),因而蒸发器内溶液的压力要高于表 面的压力。致使溶液内部的沸点高于液面处的沸点。此沸点之差,即因静压力引起的沸点升 高值。 图 5-5 溶液内部压力推导图。 如图 5-5 所示,设溶液的平均压强为 Pm ,操作压强(或二次蒸汽压强)为 P ,溶液内部 的压强按液面和底部间的平均压强计算,即 ( ) 2 2 gL P P P gL Pm ρ ρ = + + + = .(V) 式中, ρ ——溶液平均密度, −3 kg ⋅ m ; p ——二次蒸汽压强, Pa ; L ——液层高度, m 。 这样,溶液平均压强对应的沸点,就比操作压强对应的沸点要高。 【例 5-4】 蒸发浓度为50 %(质量百分率)的 NaOH 水溶液时,若蒸汽压为40kPa ,蒸 发器内溶液高度为 L = 2m ,溶液密度为 3 1450 − ρ = kg ⋅ m ,试求此时溶液的沸点。 解:查饱和水蒸气压表得,压力为40kPa 的水蒸气,沸点为75℃,以水的沸点75℃, 查图 5-4 的杜林线图,得117 ℃(此为溶液表面的沸点温度)。 若考虑溶液高度 L = 2m ,蒸发器内部压力为: m a a kP kP gL P P 54.22 2 1450 9.81 2 40 2 = × × = + = + ρ 压力为54.22kPa时,查得水蒸汽沸点为83.06℃, ∴因静压力的沸点升高为83.06 − 75 = 8.06℃ ∴此时溶液沸点为117 + 8.06 = 125 ℃。 因管路阻力,引起的溶液沸点升高值。根据经验,沸点升高值可取1 ~ 1.5 ℃。此处不 再详述。 综上所述,蒸发溶液温度的计算,影响着蒸发传热的温度差 m ∆t ,进而影响传热的速率

9 Q 。对于连续加料的稳定蒸发器而言,传热速率也是稳定的。如果是间歇加料蒸发器,如煎 中药、煲汤,却是不稳定的,溶液温度随蒸发的进行而升高,传热温度差在变小。 §3 多效蒸发 5-8 多效蒸发概述 为了减少蒸汽消耗量,人们考虑利用前一个蒸发器生成的二次蒸汽,来作为后一个蒸发 器的加热介质。后一个蒸发器的蒸发室是前一个蒸发器的冷凝器,此即多效蒸发。因为二次 蒸汽的压力较前一个加热蒸汽的压力为低。所以后一个蒸发器应在更低的压力下操作,即需 有抽真空的装置。 两个蒸发器串联操作,前一个称作一效,后一个称作二效。效数越多,单位蒸汽消耗量 越小,如表 5-2 所示。 表 5-1 单位蒸汽消耗量 效数 单效 双效 三效 四效 五效 (D/W)最小 1.1 0.57 0.4 0.3 0.27 5-9 多效蒸发流程 一、并流法蒸发流程。 如图 5-6 所示
9 Q 。对于连续加料的稳定蒸发器而言,传热速率也是稳定的。如果是间歇加料蒸发器,如煎 中药、煲汤,却是不稳定的,溶液温度随蒸发的进行而升高,传热温度差在变小。 §3 多效蒸发 5-8 多效蒸发概述 为了减少蒸汽消耗量,人们考虑利用前一个蒸发器生成的二次蒸汽,来作为后一个蒸发 器的加热介质。后一个蒸发器的蒸发室是前一个蒸发器的冷凝器,此即多效蒸发。因为二次 蒸汽的压力较前一个加热蒸汽的压力为低。所以后一个蒸发器应在更低的压力下操作,即需 有抽真空的装置。 两个蒸发器串联操作,前一个称作一效,后一个称作二效。效数越多,单位蒸汽消耗量 越小,如表 5-2 所示。 表 5-1 单位蒸汽消耗量 效数 单效 双效 三效 四效 五效 (D/W)最小 1.1 0.57 0.4 0.3 0.27 5-9 多效蒸发流程 一、并流法蒸发流程。 如图 5-6 所示

10 图 5-6 并流三效蒸发流程 加热蒸汽的温度T ,越来越低,即T1 > T2 > T3 蒸发室操作压力 P ,越来越低,即 P1 > P2 > P3 由于蒸发室压力越来越低,则待蒸发溶液的沸点温度t ,也会越来越低,即 1 2 3 t > t > t 。 那么加热蒸发的温度差( i i T − t )才可以维持一定的差值。如果不是抽真空装置,这个加 热推动力( i i T − t ),不可以维持一定值。 待蒸发的溶液浓度C ,会越来越高,即C1 < C2 < C3 。 待蒸发的溶液粘度 µ ,会越来越大,即 µ1 < µ 2 < µ 3 。 传热系数 K ,会越来越小,即 K1 < K2 < K3 。传热系数降低是我们不希望的。 并流加料的优点是: (1)由于后一效蒸发室的压力较前一效为低,故溶液在效间的输送勿需用泵,就能自 动从前效进入后效。 (2)由于后一效溶液的沸点较前一效为低,故前一效的溶液进入后一效时,会因过热 自行蒸发。因而可产生较多的二次蒸汽。 (3)由末效引出完成液,因其沸点最低,故带走的热量最少,减少了热量损失。 并流加料的缺点是: 由于后一效溶液的浓度较前一效为大,且温度又较低,所以料液粘度沿流动方向逐效增 大,致使后效的传热系数降低
10 图 5-6 并流三效蒸发流程 加热蒸汽的温度T ,越来越低,即T1 > T2 > T3 蒸发室操作压力 P ,越来越低,即 P1 > P2 > P3 由于蒸发室压力越来越低,则待蒸发溶液的沸点温度t ,也会越来越低,即 1 2 3 t > t > t 。 那么加热蒸发的温度差( i i T − t )才可以维持一定的差值。如果不是抽真空装置,这个加 热推动力( i i T − t ),不可以维持一定值。 待蒸发的溶液浓度C ,会越来越高,即C1 < C2 < C3 。 待蒸发的溶液粘度 µ ,会越来越大,即 µ1 < µ 2 < µ 3 。 传热系数 K ,会越来越小,即 K1 < K2 < K3 。传热系数降低是我们不希望的。 并流加料的优点是: (1)由于后一效蒸发室的压力较前一效为低,故溶液在效间的输送勿需用泵,就能自 动从前效进入后效。 (2)由于后一效溶液的沸点较前一效为低,故前一效的溶液进入后一效时,会因过热 自行蒸发。因而可产生较多的二次蒸汽。 (3)由末效引出完成液,因其沸点最低,故带走的热量最少,减少了热量损失。 并流加料的缺点是: 由于后一效溶液的浓度较前一效为大,且温度又较低,所以料液粘度沿流动方向逐效增 大,致使后效的传热系数降低