
第十三章 基因工程菌的发酵 近年来,重组 DNA 技术(基因工程)已开始由实验室走向工业生产,走向实用。 它不仅为我们提供了一种极为有效的菌种改良技术和手段,也为攻克医学上的疑难 杂症——癌、遗传病及艾滋病的深入研究和最后的治愈提供了可能;为农业的第三 次革命提供了基础;为深入探索生命的奥秘提供了有力的手段。现在由工程菌产生 的珍稀药物,如胰岛素、干扰素、人生长激素、乙肝表面抗原等等部已先后面市, 基因工程不仅保证了这些药物的来源,而且可使成本大大下降。但是从许多研究中 发现,工程菌在保存过程中及发酵生产过程中表现出不稳定性,因而工程菌不稳定 性的解决已日益受到重视并成为基因工程这一高技术成就转化为生产力的关键之 一。 第一节 工程菌的来源和应用 一、何谓基因工程 基因工程(genetic engineering)是指在基因水平上,采用与工程设计十分类似 的方法,根据人们的意愿,主要是在体外进行基因切割、拼接和重新组合,再转入 生物体内,产生出人们所期望的产物,或创造出具有新的遗传特征的生物类型,并 能使之稳定地遗传给后代。 基因工程的核心技术是 DNA 的重组技术。重组即利用供体生物的遗传物质或 人工合成的基因,经过体外或离体的限制酶切割后与适当的载体连接起来形成重组 DNA 分子,然后在将重组 DNA 分子导入到受体细胞或受体生物构建转基因生物, 该种生物就可以按人类事先设计好的蓝图表现出另外一种生物的某种性状。除 DNA 重组技术外,基因工程还应包括基因的表达技术,基因的突变技术,基因的导入技 术等。 基因工程一般分为 4 个步骤: 一是取得符合人们要求的 DNA 片段,这种 DNA 片段被称为“目的基因”;二是 将目的基因与质粒或病毒 DNA 连接成重组 DNA;三是把重组 DNA 引入某种细胞; 四是把目的基因能表达的受体细胞挑选出来。 DNA 分子很小,其直径只有 20 埃, 约相当于五百万分之一厘米,在它们身上进行“手术”是非常困难的,因此基因工程 实际上是一种“超级显微工程”,对 DNA 的切割、缝合与转运,必须有特殊的工具。 要把目的基因从供体 DNA 长链中准确地剪切下来,可不是一件容易的事。1968 年, 沃纳·阿尔伯博士、丹尼尔·内森斯博士和汉密尔·史密斯博士第一次从大肠杆菌中提 取出了限制性内切酶,它能够在 DNA 上寻找特定的“切点”,认准后将 DNA 分子的
第十三章 基因工程菌的发酵 近年来,重组 DNA 技术(基因工程)已开始由实验室走向工业生产,走向实用。 它不仅为我们提供了一种极为有效的菌种改良技术和手段,也为攻克医学上的疑难 杂症——癌、遗传病及艾滋病的深入研究和最后的治愈提供了可能;为农业的第三 次革命提供了基础;为深入探索生命的奥秘提供了有力的手段。现在由工程菌产生 的珍稀药物,如胰岛素、干扰素、人生长激素、乙肝表面抗原等等部已先后面市, 基因工程不仅保证了这些药物的来源,而且可使成本大大下降。但是从许多研究中 发现,工程菌在保存过程中及发酵生产过程中表现出不稳定性,因而工程菌不稳定 性的解决已日益受到重视并成为基因工程这一高技术成就转化为生产力的关键之 一。 第一节 工程菌的来源和应用 一、何谓基因工程 基因工程(genetic engineering)是指在基因水平上,采用与工程设计十分类似 的方法,根据人们的意愿,主要是在体外进行基因切割、拼接和重新组合,再转入 生物体内,产生出人们所期望的产物,或创造出具有新的遗传特征的生物类型,并 能使之稳定地遗传给后代。 基因工程的核心技术是 DNA 的重组技术。重组即利用供体生物的遗传物质或 人工合成的基因,经过体外或离体的限制酶切割后与适当的载体连接起来形成重组 DNA 分子,然后在将重组 DNA 分子导入到受体细胞或受体生物构建转基因生物, 该种生物就可以按人类事先设计好的蓝图表现出另外一种生物的某种性状。除 DNA 重组技术外,基因工程还应包括基因的表达技术,基因的突变技术,基因的导入技 术等。 基因工程一般分为 4 个步骤: 一是取得符合人们要求的 DNA 片段,这种 DNA 片段被称为“目的基因”;二是 将目的基因与质粒或病毒 DNA 连接成重组 DNA;三是把重组 DNA 引入某种细胞; 四是把目的基因能表达的受体细胞挑选出来。 DNA 分子很小,其直径只有 20 埃, 约相当于五百万分之一厘米,在它们身上进行“手术”是非常困难的,因此基因工程 实际上是一种“超级显微工程”,对 DNA 的切割、缝合与转运,必须有特殊的工具。 要把目的基因从供体 DNA 长链中准确地剪切下来,可不是一件容易的事。1968 年, 沃纳·阿尔伯博士、丹尼尔·内森斯博士和汉密尔·史密斯博士第一次从大肠杆菌中提 取出了限制性内切酶,它能够在 DNA 上寻找特定的“切点”,认准后将 DNA 分子的

双链交错地切断。人们把这种限制性内切酶称为“分子剪刀”。这种“分子剪刀”可以 完整地切下个别基因。自 70 年代以来,人们已经分离提取了 400 多种“分子剪刀”。 有了形形色色的“分子剪刀”,人们就可以随心所欲地进行 DNA 分子长链的切割了。 DNA 的分子链被切开后,还得缝接起来以完成基因的拼接。1976 年,科学们在 5 个实验室里几乎同时发现并提取出一种酶,这种酶可以将两个 DNA 片段连接起来, 修复好 DNA 链的断裂口。1974 年以后,科学界正式肯定了这一发现,并把这种酶 叫作 DNA 连接酶。从此,DNA 连接酶就成了名符其实的“缝合”基因的“分子针线”。 只要在用同一种“分子剪刀”剪切的两种 DNA 碎片中加上“分子针线”,就会把两种 DNA 片段重新连接起来。把“拼接”好的 DNA 分子运送到受体细胞中去,必须寻找 一种分子小、能自由进出细胞,而且在装载了外来的 DNA 片段后仍能照样复制的 运载体。理想的运载体是质粒,因为质粒能自由进出细菌细胞,应当用“分子剪刀” 把它切开,再给它安装上一段外来的 DNA 片段后,它依然如故地能自我复制。有 了限制性内切酶、连接酶及运载体,进行基因工程就可以如愿以偿了。运载体将目 的基因运到受体细胞是基因工程的最后一步,目的基因的导入过程是肉眼看不到的。 因此,要知道导入是否成功,事先应找到特定的标志。例如我们用一种经过改造的 抗四环素质粒 PSC100 作载体,将一种基因移入自身无抗性的大肠杆菌时,如果基 因移入后大肠杆菌不能被四环素杀死,就说明转入获得成功了。 二、工程菌的获得 1,确定目的产物。 2,找出产该产物的细胞。 3,将细胞破碎后提纯出全部信使 RNA。这些信使中包含了该细胞内表达的所 有蛋白质的合成信息。 4,利用基因扩增技术(PCR),找出所需的目的基因。 5,将目的基因连接到设计好的质粒载体,形成了重组 DNA 分子。 6,将重组后 DNA 分子引入到受体细胞内,然后选择合适的培养条件使细胞繁 殖。根据选择性标记,从菌落中筛选出目的基因的重组(工程)菌。 三、工程菌应具备的条件 1,发酵产品是高浓度、高转化率和高产率的,同时是分泌型菌株。 2,菌株能利用常用的碳源,并可进行连续发酵。 3,菌株不是致病株,也不产内毒素。 4,代谢控制容易进行
双链交错地切断。人们把这种限制性内切酶称为“分子剪刀”。这种“分子剪刀”可以 完整地切下个别基因。自 70 年代以来,人们已经分离提取了 400 多种“分子剪刀”。 有了形形色色的“分子剪刀”,人们就可以随心所欲地进行 DNA 分子长链的切割了。 DNA 的分子链被切开后,还得缝接起来以完成基因的拼接。1976 年,科学们在 5 个实验室里几乎同时发现并提取出一种酶,这种酶可以将两个 DNA 片段连接起来, 修复好 DNA 链的断裂口。1974 年以后,科学界正式肯定了这一发现,并把这种酶 叫作 DNA 连接酶。从此,DNA 连接酶就成了名符其实的“缝合”基因的“分子针线”。 只要在用同一种“分子剪刀”剪切的两种 DNA 碎片中加上“分子针线”,就会把两种 DNA 片段重新连接起来。把“拼接”好的 DNA 分子运送到受体细胞中去,必须寻找 一种分子小、能自由进出细胞,而且在装载了外来的 DNA 片段后仍能照样复制的 运载体。理想的运载体是质粒,因为质粒能自由进出细菌细胞,应当用“分子剪刀” 把它切开,再给它安装上一段外来的 DNA 片段后,它依然如故地能自我复制。有 了限制性内切酶、连接酶及运载体,进行基因工程就可以如愿以偿了。运载体将目 的基因运到受体细胞是基因工程的最后一步,目的基因的导入过程是肉眼看不到的。 因此,要知道导入是否成功,事先应找到特定的标志。例如我们用一种经过改造的 抗四环素质粒 PSC100 作载体,将一种基因移入自身无抗性的大肠杆菌时,如果基 因移入后大肠杆菌不能被四环素杀死,就说明转入获得成功了。 二、工程菌的获得 1,确定目的产物。 2,找出产该产物的细胞。 3,将细胞破碎后提纯出全部信使 RNA。这些信使中包含了该细胞内表达的所 有蛋白质的合成信息。 4,利用基因扩增技术(PCR),找出所需的目的基因。 5,将目的基因连接到设计好的质粒载体,形成了重组 DNA 分子。 6,将重组后 DNA 分子引入到受体细胞内,然后选择合适的培养条件使细胞繁 殖。根据选择性标记,从菌落中筛选出目的基因的重组(工程)菌。 三、工程菌应具备的条件 1,发酵产品是高浓度、高转化率和高产率的,同时是分泌型菌株。 2,菌株能利用常用的碳源,并可进行连续发酵。 3,菌株不是致病株,也不产内毒素。 4,代谢控制容易进行

5,能进行适当的 DNA 重组,并且稳定,重组的 DNA 不易脱落。 四、工程菌的应用 1,基因药物 例如,红细胞生成素、胰岛素、干优素、乙肝疫苗、生长激素和粒细胞巨噬细 胞集落刺激因子等。 2,其它发酵产品 例如酶制剂、氨基酸(苏氨酸、色氨酸)、抗生素等。 第二节 工程菌的培养 就生产流程而言,从发酵到分离、纯化目标产物,工程菌和常规微生物并无太 多的差异。但工程菌在保存过程中及发酵生产过程中表现出不稳定性,以及安全性 等问题,使得工程菌的培养有着自身所特有的特点。 一、安全问题 关于基因工程的社会问题,必须提到它的潜在危险性。经过重组的菌和质粒一 旦用于,工业化生产,就不可避免地进入自然界。这些菌能间接地危害人体健康, 使治疗药物失去效用,污染环境等。因此,安全问题是极其重要的。 1974 年,提出了 DNA 重组实验具有潜在生物危险性的问题。后来,美、日等 国都制定了有关 DNA 重组实验的准则,即在试管内用酶等构建异种 DNA 的重组分 子,并用它转入活细胞中的实验,以及使用重组体的实验应遵循的规程。其目的是 保证实验的安全和推动重组 DNA 的研究。这些准则参照了防止病原微生物污染的 措施,以及根据对实验安全度的评定,采用物理密封(P1~P4)和生物学密封(B1 和 B2) 两种方法。 物理密封是将重组菌封闭于设备内,以防止传染给实验人员和向外界扩散。实 验规模在 20L 以下时,物理密封由密封设施、实验室设计和实验注意事项组成。密 封程度分为 P1、P2、P3 和 P4 级,数字越大,密封水平越高。生物学密封要求用只 有在特殊培养条件下才能生存的宿主,同时用不能转移至其它活细胞的载体,通过 这样组合的宿主载体系统,可以防止重组菌向外扩散。按密封程度分 B1 和 B2 级, B2 级的密封要求最严格。 企业中进行重组菌培养时的设备标准有 LS-1 和 LS-2。LS-2 相当严格,工业生 产起码应在 LS-1 的设备标准下培养。LS-1 标准要点是:(1)使用防止重组菌体外漏, 能在密闭状态下进行内部灭菌的培养装置;(2)培养装置的排气由除菌器排出;(3)
5,能进行适当的 DNA 重组,并且稳定,重组的 DNA 不易脱落。 四、工程菌的应用 1,基因药物 例如,红细胞生成素、胰岛素、干优素、乙肝疫苗、生长激素和粒细胞巨噬细 胞集落刺激因子等。 2,其它发酵产品 例如酶制剂、氨基酸(苏氨酸、色氨酸)、抗生素等。 第二节 工程菌的培养 就生产流程而言,从发酵到分离、纯化目标产物,工程菌和常规微生物并无太 多的差异。但工程菌在保存过程中及发酵生产过程中表现出不稳定性,以及安全性 等问题,使得工程菌的培养有着自身所特有的特点。 一、安全问题 关于基因工程的社会问题,必须提到它的潜在危险性。经过重组的菌和质粒一 旦用于,工业化生产,就不可避免地进入自然界。这些菌能间接地危害人体健康, 使治疗药物失去效用,污染环境等。因此,安全问题是极其重要的。 1974 年,提出了 DNA 重组实验具有潜在生物危险性的问题。后来,美、日等 国都制定了有关 DNA 重组实验的准则,即在试管内用酶等构建异种 DNA 的重组分 子,并用它转入活细胞中的实验,以及使用重组体的实验应遵循的规程。其目的是 保证实验的安全和推动重组 DNA 的研究。这些准则参照了防止病原微生物污染的 措施,以及根据对实验安全度的评定,采用物理密封(P1~P4)和生物学密封(B1 和 B2) 两种方法。 物理密封是将重组菌封闭于设备内,以防止传染给实验人员和向外界扩散。实 验规模在 20L 以下时,物理密封由密封设施、实验室设计和实验注意事项组成。密 封程度分为 P1、P2、P3 和 P4 级,数字越大,密封水平越高。生物学密封要求用只 有在特殊培养条件下才能生存的宿主,同时用不能转移至其它活细胞的载体,通过 这样组合的宿主载体系统,可以防止重组菌向外扩散。按密封程度分 B1 和 B2 级, B2 级的密封要求最严格。 企业中进行重组菌培养时的设备标准有 LS-1 和 LS-2。LS-2 相当严格,工业生 产起码应在 LS-1 的设备标准下培养。LS-1 标准要点是:(1)使用防止重组菌体外漏, 能在密闭状态下进行内部灭菌的培养装置;(2)培养装置的排气由除菌器排出;(3)

使用易产气溶胶的设备时,要安装可收集气溶胶的安全箱等。设计用于基因重组菌 的培养装置时,不仅要考虑外部杂菌的侵入,还要防止重组菌的外漏。此外,培养 后的菌体分离、破碎等处理也必须在安全柜内进行,或是采用密闭型的设备。 二、基因工程细胞培养特点 前已述及,基因工程细胞培养过程与培养方式与天然细胞培养过程或方式基本 —致。但亦有其自身持点。实践表明,基因工程细胞工业化培养中,产物的产率往 往比实验室培养规模为低。其原因主要与基因工程细胞特点有关,首先基因工程细 胞的生长速率及表达率与其所载外源 DNA 的稳定性及产物分泌过程有关,其中重 组 DNA 的稳定性尤为重要,重组 DNA 在宿主内表达方式有两种,其一是游离表达 方式、其二是结合表达方式。因此,基因工程细胞培养过程,重组 DNA 的丢失方 式亦有两种,其一是细胞培养过程,由于回复突变或分配作用致使 DNA 丢失.称 为脱落性不稳定,其二是重组 DNA 中编码的结构基因在宿主内发生再重组过程产 生突变,不再表达目的产物,此称加结构性不稳定。其次为提高基因工程细胞表达 效率,需采取适当措施,提高重组 DNA 在宿主细胞内的拷贝数及促进表达产物自 细胞内向细胞外分泌。此外,基因工程细胞的原宿主通常是某些培养物质(如某种氨 基酸或维生素等)的缺陷型,有些基因工程细胞生产过程亦产生某些抑制细胞生长的 代谢物。由此,在培养工程中应考虑控制培养液营养成分及其浓度,同时采取措施, 消除抑制细胞生长的代谢物,以保证细胞正常生长。由此可见,在基因工程细胞培 养过程,除—般培养条件外,必需考虑基因工程细胞的自身特点,确定最佳培养条 件。 三、基因工程细胞的培养 前已述及,基因工程细胞的培养过程与一般需氧细胞培养基本一致,同时培养 方式亦无差异,可采用各种分批培养方式,亦可采用连续培养、半连续培养及透析 培养等方式。至于影响基因工程细胞培养的细胞生物量得率与产物量的因素及有关 参数。亦可参照普通细胞相应培养方式求得。 目前关于动植物基因工程细胞培养工程的研究刚刚起步,有待进—步发展。这 里仅对基因工程菌的营养控制、质粒稳定性、重组质粒拷贝数的控制及表达效率作 简单讨论。 1,底物浓度的控制 在基因工程茵培养过程,至少要遵循 PI 级物理防护的规定,因此必需进行菌体 的高密度培养。普通 E.coli 培养时最高干重菌体收率可达 12.5%,酿酒酵母可得
使用易产气溶胶的设备时,要安装可收集气溶胶的安全箱等。设计用于基因重组菌 的培养装置时,不仅要考虑外部杂菌的侵入,还要防止重组菌的外漏。此外,培养 后的菌体分离、破碎等处理也必须在安全柜内进行,或是采用密闭型的设备。 二、基因工程细胞培养特点 前已述及,基因工程细胞培养过程与培养方式与天然细胞培养过程或方式基本 —致。但亦有其自身持点。实践表明,基因工程细胞工业化培养中,产物的产率往 往比实验室培养规模为低。其原因主要与基因工程细胞特点有关,首先基因工程细 胞的生长速率及表达率与其所载外源 DNA 的稳定性及产物分泌过程有关,其中重 组 DNA 的稳定性尤为重要,重组 DNA 在宿主内表达方式有两种,其一是游离表达 方式、其二是结合表达方式。因此,基因工程细胞培养过程,重组 DNA 的丢失方 式亦有两种,其一是细胞培养过程,由于回复突变或分配作用致使 DNA 丢失.称 为脱落性不稳定,其二是重组 DNA 中编码的结构基因在宿主内发生再重组过程产 生突变,不再表达目的产物,此称加结构性不稳定。其次为提高基因工程细胞表达 效率,需采取适当措施,提高重组 DNA 在宿主细胞内的拷贝数及促进表达产物自 细胞内向细胞外分泌。此外,基因工程细胞的原宿主通常是某些培养物质(如某种氨 基酸或维生素等)的缺陷型,有些基因工程细胞生产过程亦产生某些抑制细胞生长的 代谢物。由此,在培养工程中应考虑控制培养液营养成分及其浓度,同时采取措施, 消除抑制细胞生长的代谢物,以保证细胞正常生长。由此可见,在基因工程细胞培 养过程,除—般培养条件外,必需考虑基因工程细胞的自身特点,确定最佳培养条 件。 三、基因工程细胞的培养 前已述及,基因工程细胞的培养过程与一般需氧细胞培养基本一致,同时培养 方式亦无差异,可采用各种分批培养方式,亦可采用连续培养、半连续培养及透析 培养等方式。至于影响基因工程细胞培养的细胞生物量得率与产物量的因素及有关 参数。亦可参照普通细胞相应培养方式求得。 目前关于动植物基因工程细胞培养工程的研究刚刚起步,有待进—步发展。这 里仅对基因工程菌的营养控制、质粒稳定性、重组质粒拷贝数的控制及表达效率作 简单讨论。 1,底物浓度的控制 在基因工程茵培养过程,至少要遵循 PI 级物理防护的规定,因此必需进行菌体 的高密度培养。普通 E.coli 培养时最高干重菌体收率可达 12.5%,酿酒酵母可得

14.5%,浙枯草杆菌仅可得 2%左右。根据这些结果采用枯草杆菌不太合适,除非其 具有产物的高效分泌系统。 从生物安全性考虑,培养的基因工程菌通常是维生素或氨基酸的营养缺陷型突 变株。培养过程细胞对维生素需求量甚微,在培养开始即加入必需量对细胞生长并 无影响,但培养一开始即加入足够量氨基酸则可能因氨基酸浓度过大而抑制细胞生 长。在此情况下,可采取培养过程中,在调节 pH 值同时补加氨基酸混合物和葡萄 糖的方法,以便培养过程葡萄糖及氨基酸浓度的基本恒定,从而实现高密度培养, 如 E.coli C600 株培养时可获得 6%干菌体。但菌体对葡萄糖及氨基酸的收率因培 养条件而异,如以葡萄糖及分别用苏氨酸、亮氨酸、组氨酸及色氨酸为底物时,则 平均每克底物所获干菌体量分别为 0.3、2.5、15、40 及 40g 。按每克干菌体成本计, 应用苏氨酸成本最高,故应避免应用苏氨酸缺陷型菌株为宿主,最好选用维生素缺 陷型菌株为宿主。 2、质粒稳定性 重组质粒上通常载有 Ap r 基因,获得该类重组质粒的基因工程菌在含氨苄青霉 素培养液中可以生长,而非基因工程菌不能生长。但在基因工程菌高密度培养时, 外加的抗生素 AP 易于失活,影响培养。为此考虑采用抗生素依赖性变异法替代抗 生素添加法。其方法是通过诱变使宿主成为某抗生素依赖性突变株(如链霉素依赖性 Smd)。只有在 Sm 存在下宿主才能生长,但重组质粒上含有 Sm 非依赖性(Smid)基因, 将重组质粒导入宿主细胞后,所获克隆菌可在不含抗生素培养基中生长,而丢失质 粒菌株却不能生长。此法很有实用价值,但缺点是宿主细胞易产生回复突变,造成 培养工程复杂化,产物产率下降。 为考察质粒稳定性,在此引入质粒保持率 Fn 的概念,Fn 表示分批培养中细胞分 裂 n 次后,培养液中基因工程细胞数与总细胞数的比值,即 假定在分批培养过程中,细胞在对数生长期每次分裂时,其质粒丢失率为 P, 则 Fn 为: 式中 α-质粒丢失菌株与质粒保持率菌株μ的比值; n-细胞分裂次数
14.5%,浙枯草杆菌仅可得 2%左右。根据这些结果采用枯草杆菌不太合适,除非其 具有产物的高效分泌系统。 从生物安全性考虑,培养的基因工程菌通常是维生素或氨基酸的营养缺陷型突 变株。培养过程细胞对维生素需求量甚微,在培养开始即加入必需量对细胞生长并 无影响,但培养一开始即加入足够量氨基酸则可能因氨基酸浓度过大而抑制细胞生 长。在此情况下,可采取培养过程中,在调节 pH 值同时补加氨基酸混合物和葡萄 糖的方法,以便培养过程葡萄糖及氨基酸浓度的基本恒定,从而实现高密度培养, 如 E.coli C600 株培养时可获得 6%干菌体。但菌体对葡萄糖及氨基酸的收率因培 养条件而异,如以葡萄糖及分别用苏氨酸、亮氨酸、组氨酸及色氨酸为底物时,则 平均每克底物所获干菌体量分别为 0.3、2.5、15、40 及 40g 。按每克干菌体成本计, 应用苏氨酸成本最高,故应避免应用苏氨酸缺陷型菌株为宿主,最好选用维生素缺 陷型菌株为宿主。 2、质粒稳定性 重组质粒上通常载有 Ap r 基因,获得该类重组质粒的基因工程菌在含氨苄青霉 素培养液中可以生长,而非基因工程菌不能生长。但在基因工程菌高密度培养时, 外加的抗生素 AP 易于失活,影响培养。为此考虑采用抗生素依赖性变异法替代抗 生素添加法。其方法是通过诱变使宿主成为某抗生素依赖性突变株(如链霉素依赖性 Smd)。只有在 Sm 存在下宿主才能生长,但重组质粒上含有 Sm 非依赖性(Smid)基因, 将重组质粒导入宿主细胞后,所获克隆菌可在不含抗生素培养基中生长,而丢失质 粒菌株却不能生长。此法很有实用价值,但缺点是宿主细胞易产生回复突变,造成 培养工程复杂化,产物产率下降。 为考察质粒稳定性,在此引入质粒保持率 Fn 的概念,Fn 表示分批培养中细胞分 裂 n 次后,培养液中基因工程细胞数与总细胞数的比值,即 假定在分批培养过程中,细胞在对数生长期每次分裂时,其质粒丢失率为 P, 则 Fn 为: 式中 α-质粒丢失菌株与质粒保持率菌株μ的比值; n-细胞分裂次数
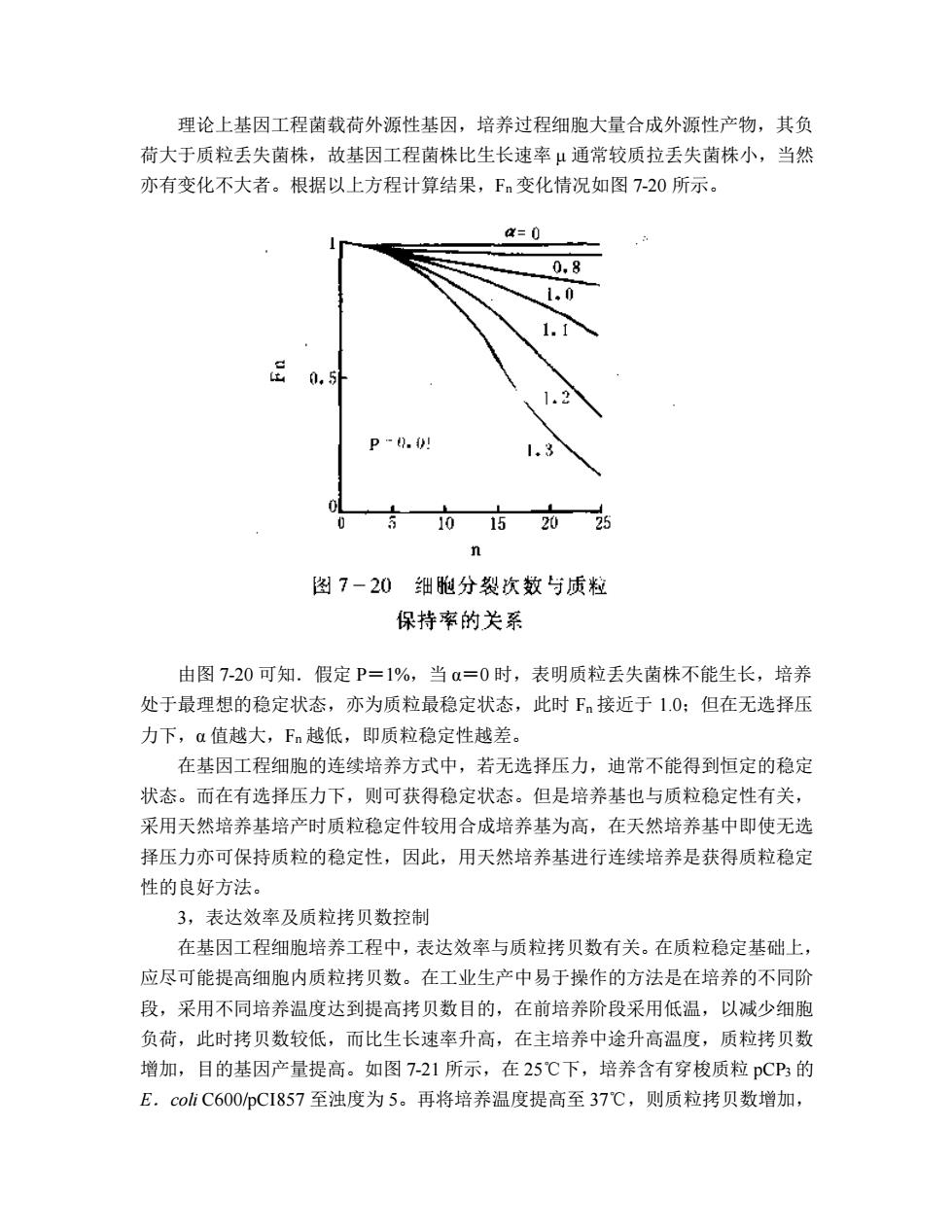
理论上基因工程菌载荷外源性基因,培养过程细胞大量合成外源性产物,其负 荷大于质粒丢失菌株,故基因工程菌株比生长速率 μ 通常较质拉丢失菌株小,当然 亦有变化不大者。根据以上方程计算结果,Fn 变化情况如图 7-20 所示。 由图 7-20 可知.假定 P=1%,当 α=0 时,表明质粒丢失菌株不能生长,培养 处于最理想的稳定状态,亦为质粒最稳定状态,此时 Fn 接近于 1.0;但在无选择压 力下,α 值越大,Fn 越低,即质粒稳定性越差。 在基因工程细胞的连续培养方式中,若无选择压力,迪常不能得到恒定的稳定 状态。而在有选择压力下,则可获得稳定状态。但是培养基也与质粒稳定性有关, 采用天然培养基培产时质粒稳定件较用合成培养基为高,在天然培养基中即使无选 择压力亦可保持质粒的稳定性,因此,用天然培养基进行连续培养是获得质粒稳定 性的良好方法。 3,表达效率及质粒拷贝数控制 在基因工程细胞培养工程中,表达效率与质粒拷贝数有关。在质粒稳定基础上, 应尽可能提高细胞内质粒拷贝数。在工业生产中易于操作的方法是在培养的不同阶 段,采用不同培养温度达到提高拷贝数目的,在前培养阶段采用低温,以减少细胞 负荷,此时拷贝数较低,而比生长速率升高,在主培养中途升高温度,质粒拷贝数 增加,目的基因产量提高。如图 7-21 所示,在 25℃下,培养含有穿梭质粒 pCP3 的 E.coli C600/pCI857 至浊度为 5。再将培养温度提高至 37℃,则质粒拷贝数增加
理论上基因工程菌载荷外源性基因,培养过程细胞大量合成外源性产物,其负 荷大于质粒丢失菌株,故基因工程菌株比生长速率 μ 通常较质拉丢失菌株小,当然 亦有变化不大者。根据以上方程计算结果,Fn 变化情况如图 7-20 所示。 由图 7-20 可知.假定 P=1%,当 α=0 时,表明质粒丢失菌株不能生长,培养 处于最理想的稳定状态,亦为质粒最稳定状态,此时 Fn 接近于 1.0;但在无选择压 力下,α 值越大,Fn 越低,即质粒稳定性越差。 在基因工程细胞的连续培养方式中,若无选择压力,迪常不能得到恒定的稳定 状态。而在有选择压力下,则可获得稳定状态。但是培养基也与质粒稳定性有关, 采用天然培养基培产时质粒稳定件较用合成培养基为高,在天然培养基中即使无选 择压力亦可保持质粒的稳定性,因此,用天然培养基进行连续培养是获得质粒稳定 性的良好方法。 3,表达效率及质粒拷贝数控制 在基因工程细胞培养工程中,表达效率与质粒拷贝数有关。在质粒稳定基础上, 应尽可能提高细胞内质粒拷贝数。在工业生产中易于操作的方法是在培养的不同阶 段,采用不同培养温度达到提高拷贝数目的,在前培养阶段采用低温,以减少细胞 负荷,此时拷贝数较低,而比生长速率升高,在主培养中途升高温度,质粒拷贝数 增加,目的基因产量提高。如图 7-21 所示,在 25℃下,培养含有穿梭质粒 pCP3 的 E.coli C600/pCI857 至浊度为 5。再将培养温度提高至 37℃,则质粒拷贝数增加
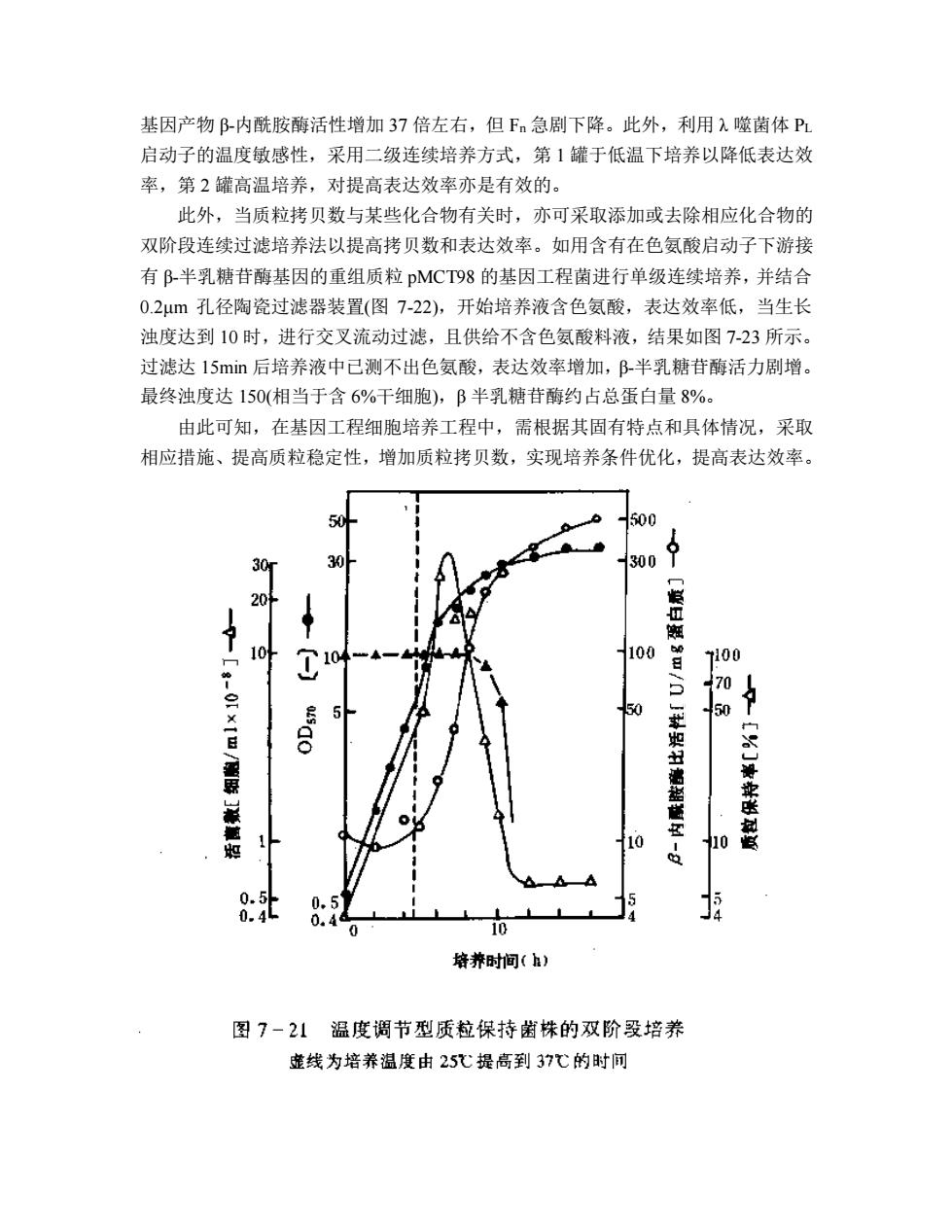
基因产物 β-内酰胺酶活性增加 37 倍左右,但 Fn 急剧下降。此外,利用 λ 噬菌体 PL 启动子的温度敏感性,采用二级连续培养方式,第 1 罐于低温下培养以降低表达效 率,第 2 罐高温培养,对提高表达效率亦是有效的。 此外,当质粒拷贝数与某些化合物有关时,亦可采取添加或去除相应化合物的 双阶段连续过滤培养法以提高拷贝数和表达效率。如用含有在色氨酸启动子下游接 有 β-半乳糖苷酶基因的重组质粒 pMCT98 的基因工程菌进行单级连续培养,并结合 0.2μm 孔径陶瓷过滤器装置(图 7-22),开始培养液含色氨酸,表达效率低,当生长 浊度达到 10 时,进行交叉流动过滤,且供给不含色氨酸料液,结果如图 7-23 所示。 过滤达 15min 后培养液中已测不出色氨酸,表达效率增加,β-半乳糖苷酶活力剧增。 最终浊度达 150(相当于含 6%干细胞),β 半乳糖苷酶约占总蛋白量 8%。 由此可知,在基因工程细胞培养工程中,需根据其固有特点和具体情况,采取 相应措施、提高质粒稳定性,增加质粒拷贝数,实现培养条件优化,提高表达效率
基因产物 β-内酰胺酶活性增加 37 倍左右,但 Fn 急剧下降。此外,利用 λ 噬菌体 PL 启动子的温度敏感性,采用二级连续培养方式,第 1 罐于低温下培养以降低表达效 率,第 2 罐高温培养,对提高表达效率亦是有效的。 此外,当质粒拷贝数与某些化合物有关时,亦可采取添加或去除相应化合物的 双阶段连续过滤培养法以提高拷贝数和表达效率。如用含有在色氨酸启动子下游接 有 β-半乳糖苷酶基因的重组质粒 pMCT98 的基因工程菌进行单级连续培养,并结合 0.2μm 孔径陶瓷过滤器装置(图 7-22),开始培养液含色氨酸,表达效率低,当生长 浊度达到 10 时,进行交叉流动过滤,且供给不含色氨酸料液,结果如图 7-23 所示。 过滤达 15min 后培养液中已测不出色氨酸,表达效率增加,β-半乳糖苷酶活力剧增。 最终浊度达 150(相当于含 6%干细胞),β 半乳糖苷酶约占总蛋白量 8%。 由此可知,在基因工程细胞培养工程中,需根据其固有特点和具体情况,采取 相应措施、提高质粒稳定性,增加质粒拷贝数,实现培养条件优化,提高表达效率
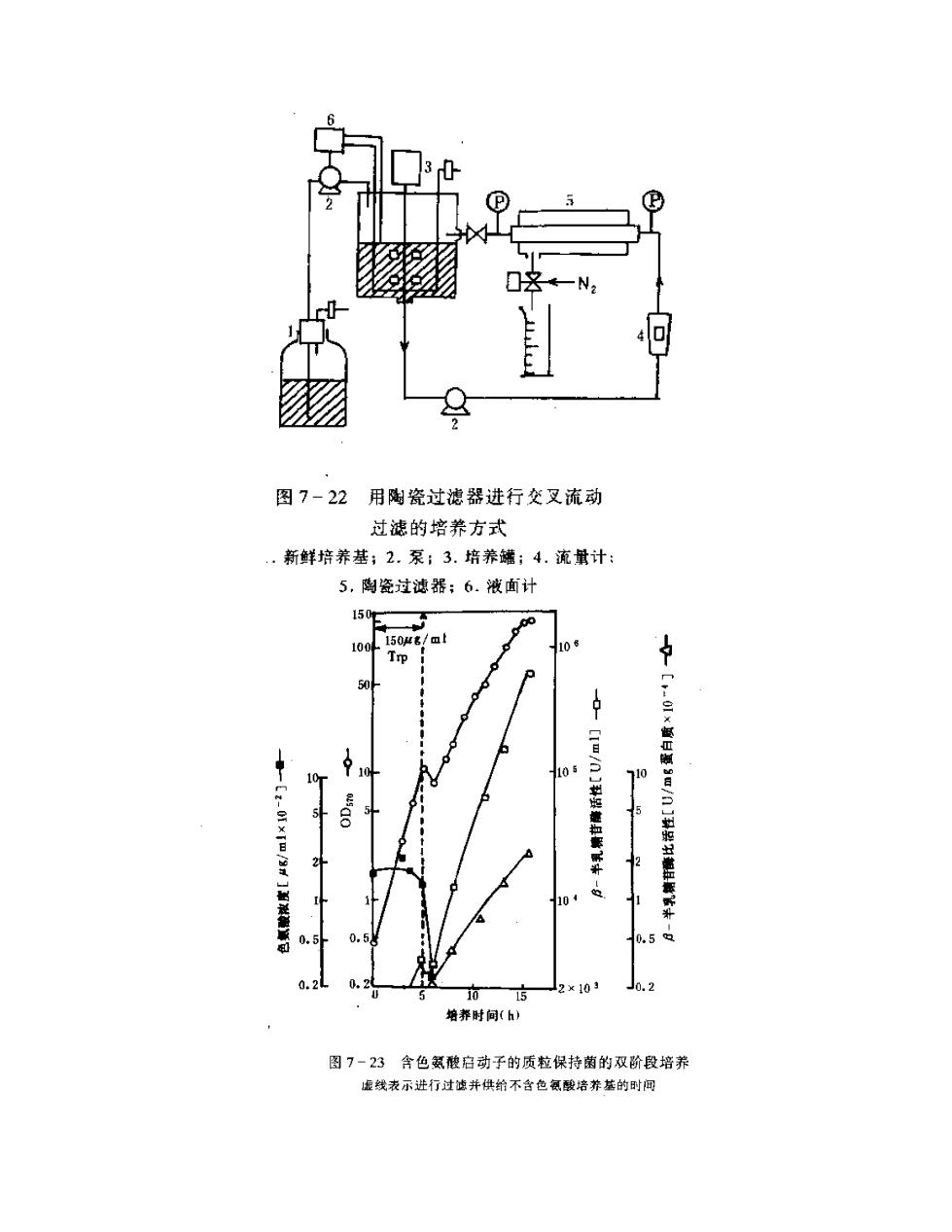
图7-22用陶瓷过滤器进行交叉流动 过滤的培养方式 .新鲜培养基;2.泵;3.培养罐;4.流计 5,陶瓷过滤器:6.液面计 150E 100 150g/▣ 710 -0fxIm/m .5 c10 培养时间(h) 图7-23含色氨酸启动子的质拉保持菌的双阶段培养 虚线表示进行过并供给不含色氯酸培养基的时闻

第三节工程菌分批培养动力学 对于质粒脱落性不稳定,细胞在分裂时丢失质粒的概率为 p,则 所以 对于底物 对于产物 第四节 培养装置与产物的提取 工程菌的培养与普通微生物的培养方法类似。在进行以工业化为目的的 DNA 重组实验,以及为生产异种基因产物而培养重组菌时,当然应采用简便易行的培养 系统。现在多半使用大肠杆菌为宿主,而在一般的通气搅拌罐中大肠杆菌能生长良 好。 一、培养装置 作为基因重组体的培养装置,与一直沿用的通气搅拌培养罐要有区别,即不仅 要防止外部微生物侵入罐内,还必须采用不使培养物外漏的培养装置。按实验准则, 可把这类密闭型通气搅拌式培养罐划分为操作液量 20L 以上和 20L 以下两种。 现今使用的微生物培养装置,按其灭菌法又可分两类。一是在高压灭菌器中进 行培养基及培养罐的灭菌,罐本身通常是玻璃制的,容量在 10L 以下的居多;另一 类是 20L 以上的培养罐,一般为不锈钢制品,多采用通新鲜蒸气进行灭菌。前者是 可移动的台式,罐本身不能承受高压;后者,蒸汽、空气等供给是用固定管道连接 的,一般不能移动;这两类罐要充分考虑不使微生物由罐外进入罐内的问题,但并 不一定要解决防止罐内微生物的外漏问题。 因此,采用高压灭菌器灭菌的小型培 养罐时应在安全柜内运转。但培养罐稍大,该法就难以使用了。 − − + + − + + + + + + = − + = pX K S S X K S S dt dX p X K S S dt dX S m S m S m (1 ) + + − − + + + − − + = p X X X p dX dX m m m (1 ) dt dX dt Y dX dt Y dS − − + + − = + 1 1 + + = + X dt dX dt dP
第三节工程菌分批培养动力学 对于质粒脱落性不稳定,细胞在分裂时丢失质粒的概率为 p,则 所以 对于底物 对于产物 第四节 培养装置与产物的提取 工程菌的培养与普通微生物的培养方法类似。在进行以工业化为目的的 DNA 重组实验,以及为生产异种基因产物而培养重组菌时,当然应采用简便易行的培养 系统。现在多半使用大肠杆菌为宿主,而在一般的通气搅拌罐中大肠杆菌能生长良 好。 一、培养装置 作为基因重组体的培养装置,与一直沿用的通气搅拌培养罐要有区别,即不仅 要防止外部微生物侵入罐内,还必须采用不使培养物外漏的培养装置。按实验准则, 可把这类密闭型通气搅拌式培养罐划分为操作液量 20L 以上和 20L 以下两种。 现今使用的微生物培养装置,按其灭菌法又可分两类。一是在高压灭菌器中进 行培养基及培养罐的灭菌,罐本身通常是玻璃制的,容量在 10L 以下的居多;另一 类是 20L 以上的培养罐,一般为不锈钢制品,多采用通新鲜蒸气进行灭菌。前者是 可移动的台式,罐本身不能承受高压;后者,蒸汽、空气等供给是用固定管道连接 的,一般不能移动;这两类罐要充分考虑不使微生物由罐外进入罐内的问题,但并 不一定要解决防止罐内微生物的外漏问题。 因此,采用高压灭菌器灭菌的小型培 养罐时应在安全柜内运转。但培养罐稍大,该法就难以使用了。 − − + + − + + + + + + = − + = pX K S S X K S S dt dX p X K S S dt dX S m S m S m (1 ) + + − − + + + − − + = p X X X p dX dX m m m (1 ) dt dX dt Y dX dt Y dS − − + + − = + 1 1 + + = + X dt dX dt dP

二、基因重组菌外漏的防范 首先应了解培养微生物在普通通气搅拌罐中可能发生外漏的部位和操作。归纳 起来有:(1)排气,(2)机械密封,(3)接种,(4)取样,(5)培养后的灭菌(通入湿热蒸气), (6) 排液(输至下一工序)。针对这些均应采取一些措施以防菌体外漏。现分别说明如 下。 1,排气 排出的气中含有大量气溶胶,在激烈起泡的培养时,培养液呈泡沫状。它们从 排气口向外排出,重组菌也容易随之外漏。 以往培养病原菌时;为防止菌体外流,采取加药剂槽的方法,但效果如何尚有 疑问。有人试验证明,排气中的微生物数量随着培养液中菌体浓度和通风速度等而 变化。用 5L 培养罐(装液量 2.5L),以搅拌速度 400r/min,通气速度 1:1(VVM), 即 2.5L/min(换算成罐内通气速度为 11cm/min)来培养大肠杆菌,发现每毫升培养液 中含 109 个菌体,每小时有 150~400 个菌随气排出;而培养酿酒酵母时,每小时从 每毫升含 108 个菌体培养液的排气中检出 30~70 个。由此可见,虽然培养液中菌体 浓度相差很大,但大肠杆菌和酵母菌仍以几乎相同程度从排气中漏出,并不取决于 菌体个体的大小。再有,提高通气速度时,单位体积的排气中,大肠杆菌和酵母菌 菌数都增加,通气速度与漏菌数之间也密切相关。总之,排气过程中含有相当多的 菌。为此,在通用通气搅拌型培养罐上安装排气鼓泡器,以防止激烈起泡时泡沫直 接外溢和外部微生物侵入污染,同时还能肉眼观察通气状态等(图 11-8)。气体通过 排气管到鼓泡瓶,再通过膜滤器。进而考察了该排气鼓泡瓶中加入药剂(如 2mol/L NaOH)的效果。 另外,为了解加热能否对排气灭菌,进行了与上述类似的实验。图 11-9 的结果 表明。用电热器对排气进行加热时,在电热器出口处的排气温度被控制在 200°C 左 右。电热器之后附有冷凝器,旨在使高温的排气冷却,以防膜滤器烧毁。 图 11-8 和图 11-9 的结果如表 11-4 所示。表中数字为培养开始启 12h 中在膜滤 器上捕集到的活菌数。结果表明,排气仅通过药剂还不能完全灭菌。使用药剂时若 能在排气鼓泡瓶内进行搅拌、消泡的话,是会有效果的。用电热器将排气加热至 200°C 时,均末在膜滤器上检出大肠杆菌和酵母菌。 图 11-10 是基因重组菌培养装置中普遍采用的排气除菌系统。为减少培养液的 蒸发量和降低排气的相对湿度。在罐排气口外安装冷却冷凝器,其后才是加热器, 排气气体经此加热至 60~80°C。相对湿度降低可预防滤器上凝结水汽。除菌滤器与 培养罐空气入口处的相同
二、基因重组菌外漏的防范 首先应了解培养微生物在普通通气搅拌罐中可能发生外漏的部位和操作。归纳 起来有:(1)排气,(2)机械密封,(3)接种,(4)取样,(5)培养后的灭菌(通入湿热蒸气), (6) 排液(输至下一工序)。针对这些均应采取一些措施以防菌体外漏。现分别说明如 下。 1,排气 排出的气中含有大量气溶胶,在激烈起泡的培养时,培养液呈泡沫状。它们从 排气口向外排出,重组菌也容易随之外漏。 以往培养病原菌时;为防止菌体外流,采取加药剂槽的方法,但效果如何尚有 疑问。有人试验证明,排气中的微生物数量随着培养液中菌体浓度和通风速度等而 变化。用 5L 培养罐(装液量 2.5L),以搅拌速度 400r/min,通气速度 1:1(VVM), 即 2.5L/min(换算成罐内通气速度为 11cm/min)来培养大肠杆菌,发现每毫升培养液 中含 109 个菌体,每小时有 150~400 个菌随气排出;而培养酿酒酵母时,每小时从 每毫升含 108 个菌体培养液的排气中检出 30~70 个。由此可见,虽然培养液中菌体 浓度相差很大,但大肠杆菌和酵母菌仍以几乎相同程度从排气中漏出,并不取决于 菌体个体的大小。再有,提高通气速度时,单位体积的排气中,大肠杆菌和酵母菌 菌数都增加,通气速度与漏菌数之间也密切相关。总之,排气过程中含有相当多的 菌。为此,在通用通气搅拌型培养罐上安装排气鼓泡器,以防止激烈起泡时泡沫直 接外溢和外部微生物侵入污染,同时还能肉眼观察通气状态等(图 11-8)。气体通过 排气管到鼓泡瓶,再通过膜滤器。进而考察了该排气鼓泡瓶中加入药剂(如 2mol/L NaOH)的效果。 另外,为了解加热能否对排气灭菌,进行了与上述类似的实验。图 11-9 的结果 表明。用电热器对排气进行加热时,在电热器出口处的排气温度被控制在 200°C 左 右。电热器之后附有冷凝器,旨在使高温的排气冷却,以防膜滤器烧毁。 图 11-8 和图 11-9 的结果如表 11-4 所示。表中数字为培养开始启 12h 中在膜滤 器上捕集到的活菌数。结果表明,排气仅通过药剂还不能完全灭菌。使用药剂时若 能在排气鼓泡瓶内进行搅拌、消泡的话,是会有效果的。用电热器将排气加热至 200°C 时,均末在膜滤器上检出大肠杆菌和酵母菌。 图 11-10 是基因重组菌培养装置中普遍采用的排气除菌系统。为减少培养液的 蒸发量和降低排气的相对湿度。在罐排气口外安装冷却冷凝器,其后才是加热器, 排气气体经此加热至 60~80°C。相对湿度降低可预防滤器上凝结水汽。除菌滤器与 培养罐空气入口处的相同