
第2章 电解质溶液和电离平衡 溶液由溶质和溶剂组成。溶质分电解质和非电解 质。 非电解质:溶于水后形成不带电的分子的物质叫非 电解质。 电解质:而溶于水后能形成带电的离子的物质叫电 解质。 电解质在溶液中是全部或部分以离子形式存在, 电解质之间的反应实质上是离子反应
第2章 电解质溶液和电离平衡 溶液由溶质和溶剂组成。溶质分电解质和非电解 质。 非电解质:溶于水后形成不带电的分子的物质叫非 电解质。 电解质:而溶于水后能形成带电的离子的物质叫电 解质。 电解质在溶液中是全部或部分以离子形式存在, 电解质之间的反应实质上是离子反应

2.1酸碱质子理论 2.1.1 酸碱的定义 酸碱质子理论:凡能给出质子(H+)的物质都是 酸,凡能接受质子的物质都是碱。酸给出质子后剩 余部分便是碱,碱接受质子后其生成物便是酸。 酸和碱之间的这种相互关系称为共轭关系, 对于仅差一个质子的对应酸、碱称为共轭酸 碱对。 酸≒质子+碱 HAc≒H++Ac- HCO3 -≒H++CO3 2- H2SO4≒H++HSO4 -
2.1酸碱质子理论 2.1.1 酸碱的定义 酸碱质子理论:凡能给出质子(H+)的物质都是 酸,凡能接受质子的物质都是碱。酸给出质子后剩 余部分便是碱,碱接受质子后其生成物便是酸。 酸和碱之间的这种相互关系称为共轭关系, 对于仅差一个质子的对应酸、碱称为共轭酸 碱对。 酸≒质子+碱 HAc≒H++Ac- HCO3 -≒H++CO3 2- H2SO4≒H++HSO4 -
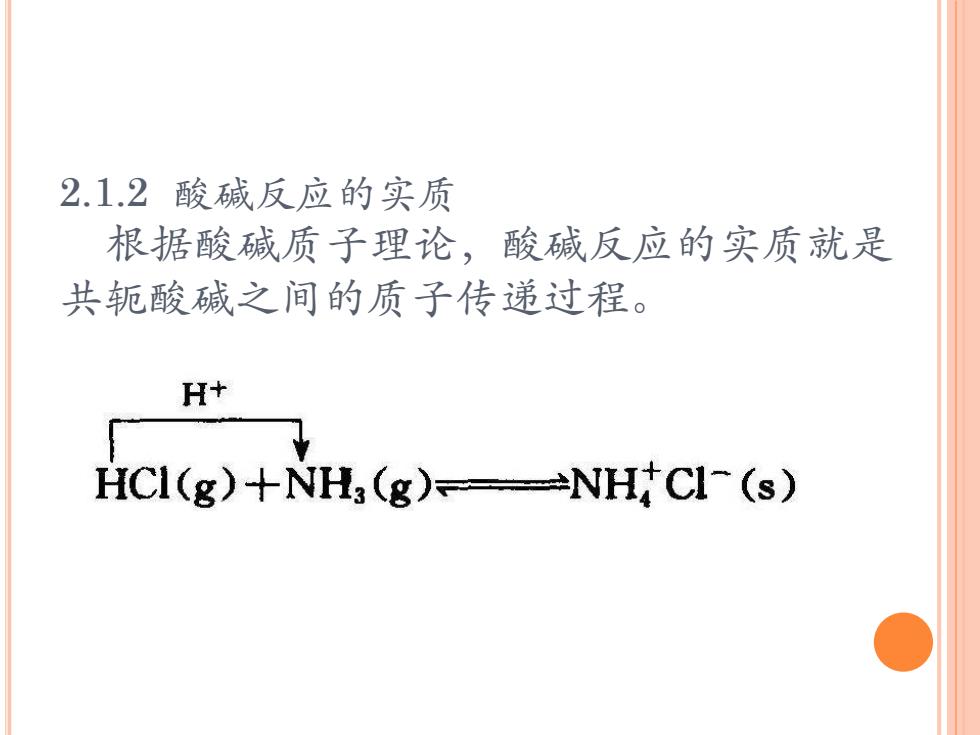
2.1.2 酸碱反应的实质 根据酸碱质子理论,酸碱反应的实质就是 共轭酸碱之间的质子传递过程
2.1.2 酸碱反应的实质 根据酸碱质子理论,酸碱反应的实质就是 共轭酸碱之间的质子传递过程

2.1.3水的离解和溶液的PH值 1.水的离解 H2O + H2O H3O+ + OH− H2O H+ + OH− 298K,纯水中的 [H3O+] = [OH− ] = 1.0 10−7 mol·dm−3 Kw θ =[H3O+][OH- ]=1.0× 10-14 Kw θ水的离子积常数,在一定的温度下是一 个常数
2.1.3水的离解和溶液的PH值 1.水的离解 H2O + H2O H3O+ + OH− H2O H+ + OH− 298K,纯水中的 [H3O+] = [OH− ] = 1.0 10−7 mol·dm−3 Kw θ =[H3O+][OH- ]=1.0× 10-14 Kw θ水的离子积常数,在一定的温度下是一 个常数

2.溶液的酸碱性和PH值 lg[ ] + pH = − H lg[ ] − pOH = − OH pH + pOH =14 PH值的概念: 氢离子浓度的负对数叫做PH值 POH值的概念: 氢氧根离子浓度的负对数叫POH值
2.溶液的酸碱性和PH值 lg[ ] + pH = − H lg[ ] − pOH = − OH pH + pOH =14 PH值的概念: 氢离子浓度的负对数叫做PH值 POH值的概念: 氢氧根离子浓度的负对数叫POH值

2.2电解质溶液 1.强电解质的概念 根据近代物质结构理论,强电解质是离子型化合物或具有 强极性的共价化合物,它们在溶液中是全部电离的,电离度应 接近100%。 观点:强电解质在溶液中是完全电离的,但 是由于离子间的相互作用,每一个离子都受 到相反电荷离子的束缚,这种离子间的相互 作用使溶液中的离子并不完全自由,其表现 是: 溶液导电能力下降,电离度下降,依数性异 常
2.2电解质溶液 1.强电解质的概念 根据近代物质结构理论,强电解质是离子型化合物或具有 强极性的共价化合物,它们在溶液中是全部电离的,电离度应 接近100%。 观点:强电解质在溶液中是完全电离的,但 是由于离子间的相互作用,每一个离子都受 到相反电荷离子的束缚,这种离子间的相互 作用使溶液中的离子并不完全自由,其表现 是: 溶液导电能力下降,电离度下降,依数性异 常

1/ 2 ( ) 2 mi Zi I = mi :溶液中第i种离子的浓度, Zi:第i种离子的电荷 离子强度I表示了离子在溶液中产生的电场强度的大小。 离子强度越大,正负离子间作用力越大
1/ 2 ( ) 2 mi Zi I = mi :溶液中第i种离子的浓度, Zi:第i种离子的电荷 离子强度I表示了离子在溶液中产生的电场强度的大小。 离子强度越大,正负离子间作用力越大

2、活度与活度系数 活度:是指有效浓度,即单位体积电解质溶液中表现出 来的表观离子有效浓度,即扣除了离子间相互作用的浓 度。以a (activity)表示。 f:活度系数,稀溶液中,f < 1;极稀溶液中, f 接近1 规律:① 离子强度越大,离子间相互作用越显著, 活度 系数越小; ② 离子强度越小,活度系数约为1。稀溶液接近理想溶液, 活度近似等于浓度。 ③ 离子电荷越大,相互作用越强,活度系数越小。 a = f c
2、活度与活度系数 活度:是指有效浓度,即单位体积电解质溶液中表现出 来的表观离子有效浓度,即扣除了离子间相互作用的浓 度。以a (activity)表示。 f:活度系数,稀溶液中,f < 1;极稀溶液中, f 接近1 规律:① 离子强度越大,离子间相互作用越显著, 活度 系数越小; ② 离子强度越小,活度系数约为1。稀溶液接近理想溶液, 活度近似等于浓度。 ③ 离子电荷越大,相互作用越强,活度系数越小。 a = f c

2.2.2弱电解质 1.一元弱酸、弱碱的离解平衡 1)解离度:就是离解平衡时,已离解的弱电 解质分子数和离解前溶液中它的分子总数的百 分比。离解度常用α表示。 离解度的大小可以相对地表示电解质的强弱。 = 100% 电离前分子总数 已电离的分子数
2.2.2弱电解质 1.一元弱酸、弱碱的离解平衡 1)解离度:就是离解平衡时,已离解的弱电 解质分子数和离解前溶液中它的分子总数的百 分比。离解度常用α表示。 离解度的大小可以相对地表示电解质的强弱。 = 100% 电离前分子总数 已电离的分子数

2)离解平衡常数 HAc + H2O ≒ H3O+ + Ac− 称为酸的离解平衡常数, 碱的离解平衡常数 NH3·H2O≒NH4 ++OH- [ ] [ ][ ] HAc H Ac Ka + − = Ka Kb [ ] [ ][ ] 3 4 NH NH OH Kb + − =
2)离解平衡常数 HAc + H2O ≒ H3O+ + Ac− 称为酸的离解平衡常数, 碱的离解平衡常数 NH3·H2O≒NH4 ++OH- [ ] [ ][ ] HAc H Ac Ka + − = Ka Kb [ ] [ ][ ] 3 4 NH NH OH Kb + − =