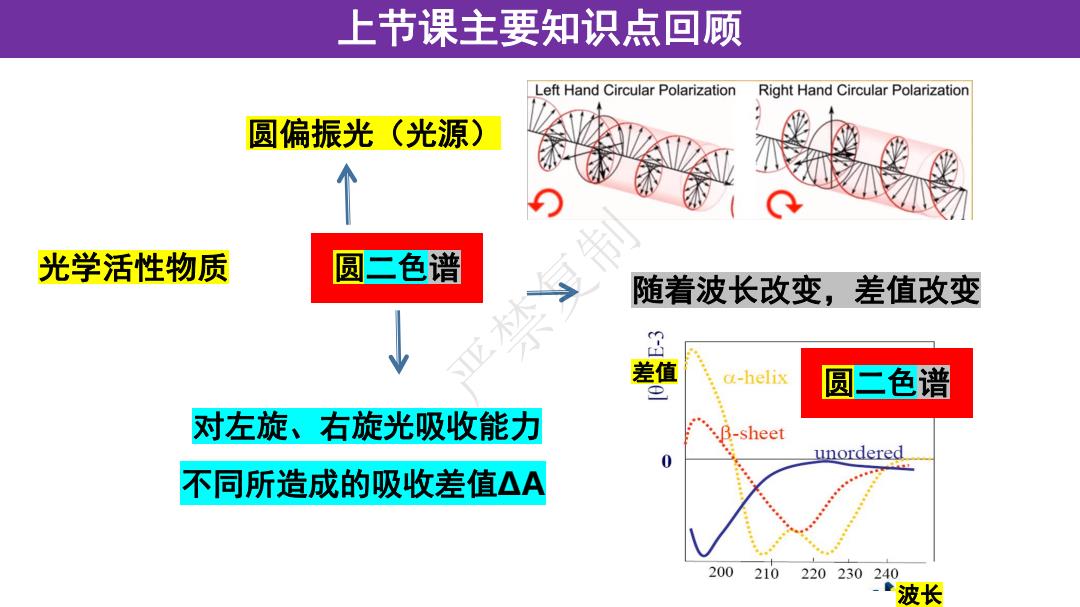
上节课主要知识点回顾 Left Hand Circular Polarization Right Hand Circular Polarization 圆偏振光(光源) 光学活性物质 圆三色谱 随着波长改变,差值改变 差值 a-helix 圆二色谱 对左旋、右旋光吸收能力 .B-sheet 0 unordered 不同所造成的吸收差值△A 200 210 220230240 波长
上节课主要知识点回顾 圆二色谱 圆偏振光(光源) 对左旋、右旋光吸收能力 不同所造成的吸收差值ΔA 光学活性物质 随着波长改变,差值改变 波长 严禁复制 差值 圆二色谱

上节课主要知识点回顾 ide Am 400-4000cm-1(光源) Amide 红外光谱 亚禁复制 1700 1600 1500 14001300 12001100 1000 Wavenumber cm-1 羰基吸收1600-1700cm-1、伸缩振动加剧 (Amide Ii带) N-H吸收1500-1600cm-1、弯曲振动加剧(Amide IⅡ带)
上节课主要知识点回顾 红外光谱 400-4000cm-1(光源) N-H吸收1500-1600 cm-1、弯曲振动加剧 (Amide II 带) 羰基吸收1600-1700 cm-1、伸缩振动加剧(Amide I带) 严禁复制

文中文-综合案例 nature communications Explore contentv About the journalv Publish with usv nature nature communications articles article Open Access Published:22 August 2016 Rapid a-oligomer formation mediated by the AB C terminus initiates an amyloid assembly pathway Pinaki Misra,Ravindra Kodali,Saketh Chemuru,Karunakar Kar Ronald Wetzel Nature Communications 7,Article number:12419 (2016) Cite this article 4167 Accesses 41 Citations 7 Altmetric Metrics
文中文 --- 综合案例 严禁复制
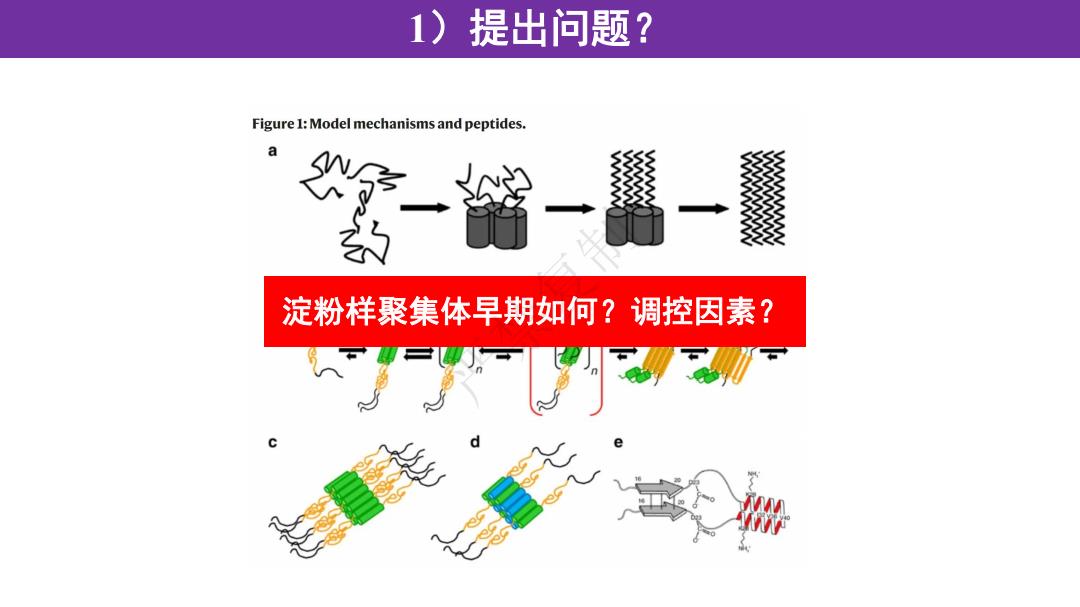
1)提出问题? Figure 1:Model mechanisms and peptides. a 淀粉样聚集体早期如何?调控因素?
1)提出问题? 淀粉样聚集体早期如何?调控因素? 严禁复制
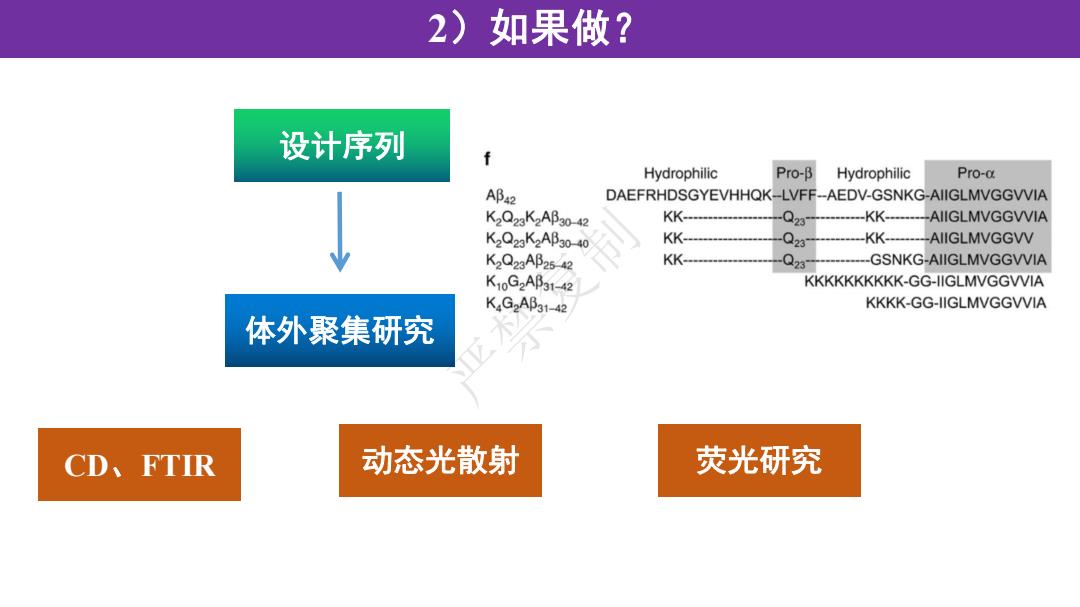
2)如果做? 设计序列 f Hydrophilic Pro-B Hydrophilic Pro-a AB42 DAEFRHDSGYEVHHQK-LVFF--AEDV-GSNKG-AIIGLMVGGVVIA K2Q23K2AB30-42 KK- 023 KK- AIIGLMVGGVVIA K2Q23K2Ap30-40 KK- Q28 KK- AIIGLMVGGVV K2Q23AB25-42 KK- 03 GSNKG-AIIGLMVGGVVIA K10G2AB31-42 KKKKKKKKK-GG-lIGLMVGGVVIA KG2Ap31-42 KKKK-GG-IIGLMVGGVVIA 体外聚集研究 CD、FTIR 动态光散射 荧光研究
2)如果做? 设计序列 体外聚集研究 CD、FTIR 动态光散射 荧光研究 严禁复制
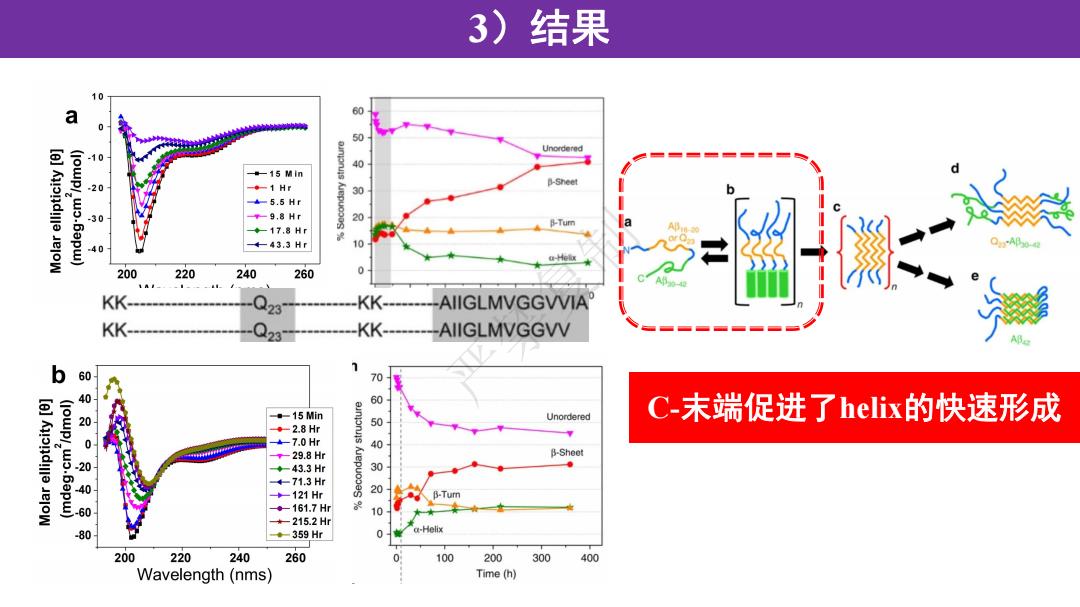
3)结果 a 60 50 10 -15 Min -◆-1Hr 500 B-Sheet +-5.5Hf -9.8 Hr 30 Tum ◆-17.8H 40 4-43.3Hr 10 (-H1e 200 220 240 260 0 KK- KK- AIIGLMVGGWVIA KK- KK- AIIGLMVGGWV b 7 60 70 40 15 Min 5 Unordered C-末端促进了helix的快速形成 ◆-2.8Hr 。 +-7.0Hr t-29.8Hr B-Sheet 43.3H 030 +-71.3H +-121Hr 0 60 。-161.7H 10 -215.2H -80 ◆-359Hr 0 a-Helix 200 220 240 260 0 100 200 300 400 Wavelength(nms) Time(h)
3)结果 严禁复制 C-末端促进了helix的快速形成
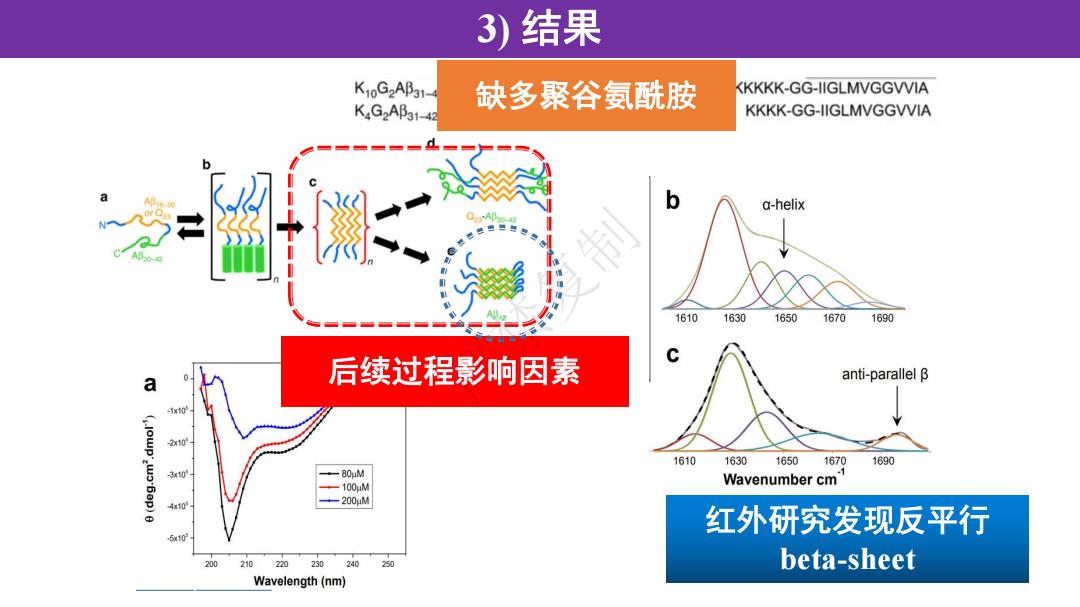
3)结果 K10G2AB31- KKKKK-GG-IIGLMVGGVVIA KG2Ap31-42 缺多聚谷氨酰胺 KKKK-GG-IIGLMVGGVVIA a-helix 16101630 1650 16701690 后续过程影响因素 anti-parallel B a 2x10 1610 1630 16501670 1690 310 +-80uM -100uM Wavenumber cm 4x10 -200uM 红外研究发现反平行 510 210220230240 20 beta-sheet Wavelength(nm)
3) 结果 缺多聚谷氨酰胺 后续过程影响因素 红外研究发现反平行 beta-sheet 严禁复制

蛋白质浴液检测红外- 最大的“敌人” 与安被打 水的红外光谱 0.8 0.6 如何解决? 0.4 0.2 FTIR spectroscopy Aggregates were collected at the end of aggregation reaction by centrifugation at 14,000 r.p.m.for 30 min.The pellet is washed once(PBS plus centrifugation),resuspended in~50ul of 1x PBS,and the suspension placed between two polished CaF2 windows using a BioCell module(BioTools,Inc.)on an ABB Prota-2x MB 3000 FTIR instrument.Spectra were collected at 4 cm-1 resolution (average of 400 scans)and corrected for buffer absorption until a flat baseline was obtained in the 1,700-1,800 cm region.Second derivative spectra for the amide-I region were calculated using PROTA software
蛋白质溶液检测红外 ------ 最大的“敌人” 如何解决? 严禁复制
课堂讨论 讨论1分离、纯化过程 讨论-2蛋白质一级结构测定 讨论3蛋白质二级结构检测 讨论4蛋白质三级结构检测 讨论5蛋白质高级结构解析简介
课堂讨论 讨论-1 分离、纯化过程 讨论-2 蛋白质一级结构测定 讨论-3 蛋白质二级结构检测 讨论-4 蛋白质三级结构检测 讨论-5 蛋白质高级结构解析简介 严禁复制
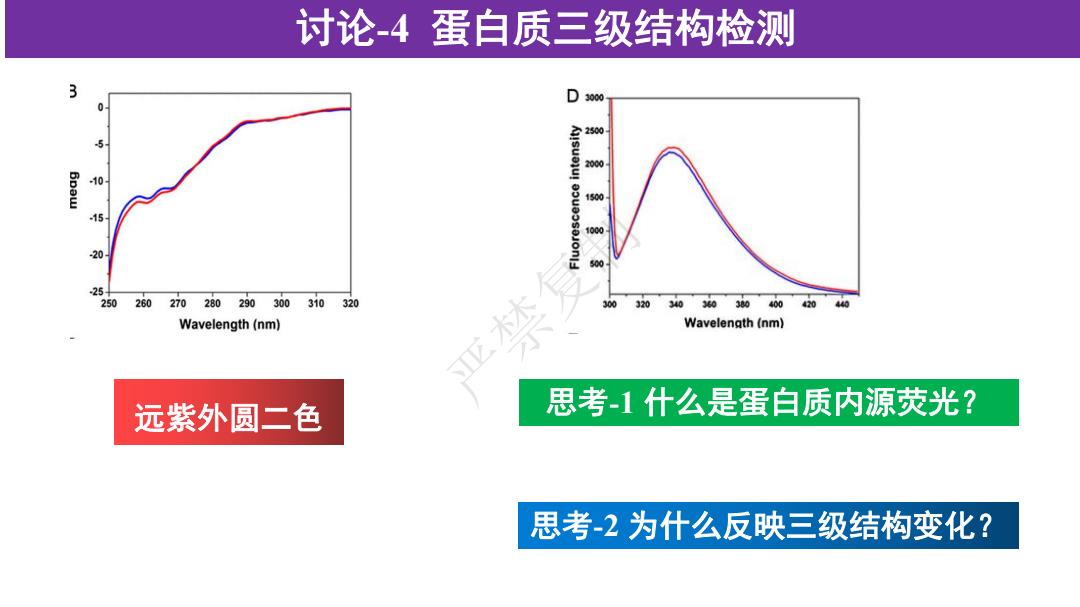
讨论-4蛋白质三级结构检测 3 D 3000 0 2500 200 Bpaw 10 1500 15 00 25- 250 260270280290300 310320 300 3030303400420 440 Wavelength(nm) Wavelength (nm) 远紫外圆二色 思考-1什么是蛋白质内源荧光? 思考-2为什么反映三级结构变化?
讨论-4 蛋白质三级结构检测 思考-1 什么是蛋白质内源荧光? 思考-2 为什么反映三级结构变化? 远紫外圆二色 严禁复制