
4。二烯烃和炔烃 Diene and Alkyne
4。二烯烃和炔烃 Diene and Alkyne

本章内容 4.1二烯烃 4.1.1分类 共轭效应 4.1.2二烯的命名 4.1.3共轭双烯的化学性质 热力学控制的产物 4.2炔烃(alkynes) 动力学控制的产物 4.2.1结构与命名 4.2.2炔烃的反应 1)加成反应:(1)还原成烯烃(2)亲电加成3)自由基加成 (4)亲核加成: 2)氧化反应;3)金属炔化物的生成;4)聚合反应 4.2.3炔烃的制备
本章内容 4.1 二烯烃 4.1.1 分类 4.1.2 二烯的命名 4.1.3 共轭双烯的化学性质 4.2 炔烃(alkynes) 4.2.1 结构与命名 4.2.2 炔烃的反应 1)加成反应:(1)还原成烯烃(2)亲电加成(3)自由基加成 (4)亲核加成; 2) 氧化反应; 3) 金属炔化物的生成; 4) 聚合反应 4.2.3 炔烃的制备 共轭效应 热力学控制的产物 动力学控制的产物
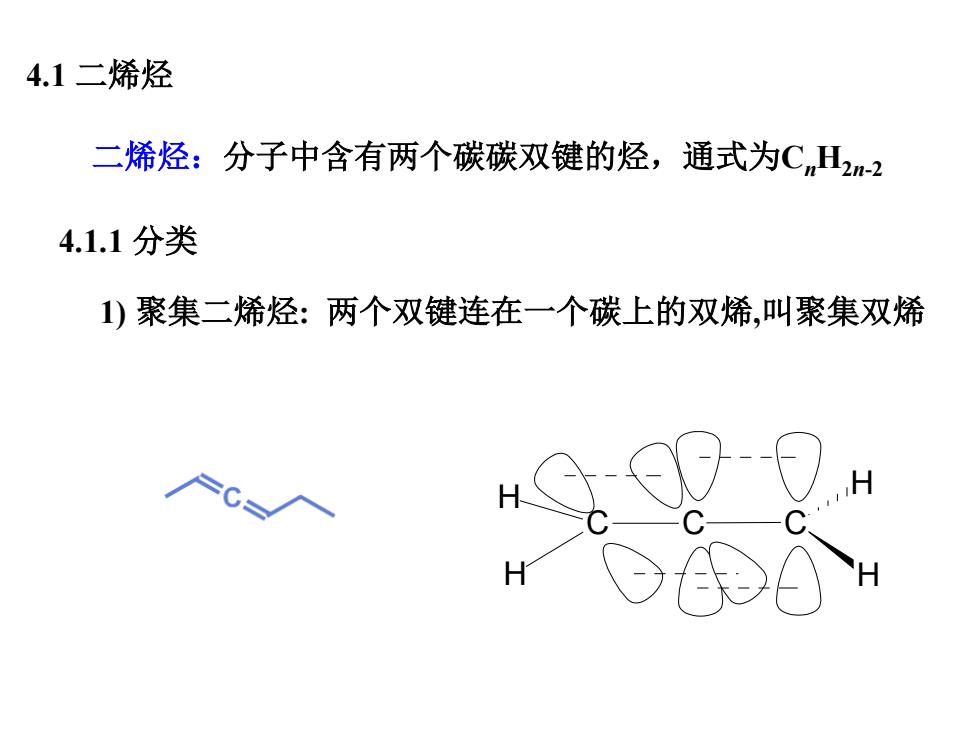
4.1二烯烃 二烯烃:分子中含有两个碳碳双键的烃,通式为CH2m-2 4.1.1分类 1)聚集二烯烃:两个双键连在一个碳上的双烯,叫聚集双烯 H
二烯烃:分子中含有两个碳碳双键的烃,通式为CnH2n-2 4.1 二烯烃 1) 聚集二烯烃: 两个双键连在一个碳上的双烯,叫聚集双烯 C H H C C H H 4.1.1 分类
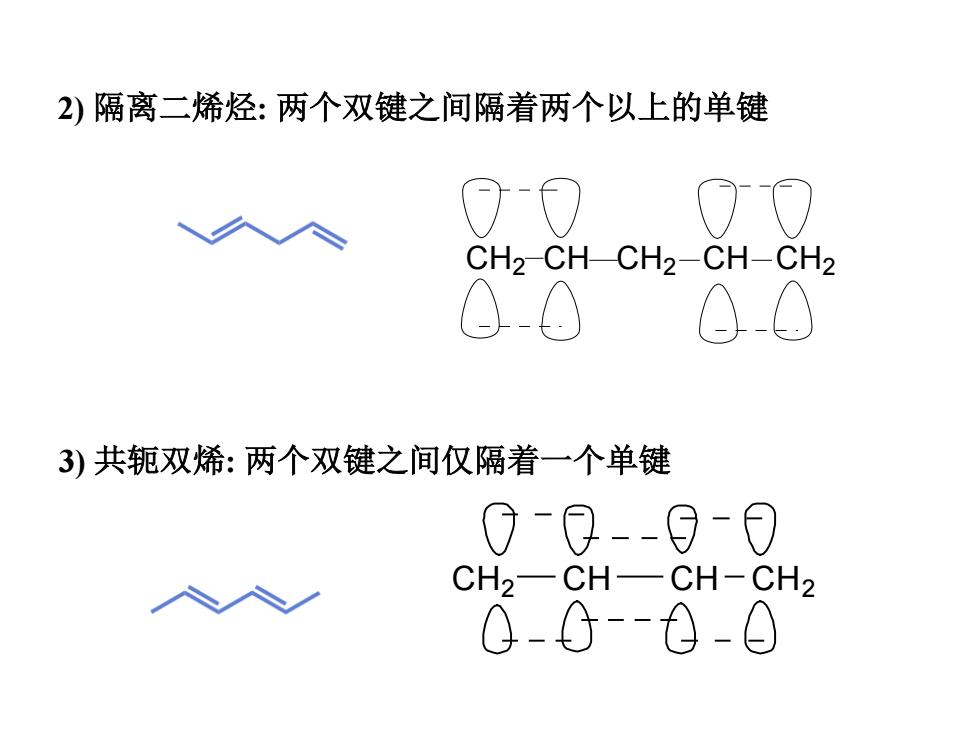
2)隔离二烯烃:两个双键之间隔着两个以上的单键 00 00 CH2-CH-CH2-CH-CH2 0.0 00 3)共轭双烯:两个双键之间仅隔着一个单键 0-0-0-0 CH2-CH-CH-CH2 0-G-6-0
2) 隔离二烯烃: 两个双键之间隔着两个以上的单键 CH2 CH CH2 CH CH2 3) 共轭双烯: 两个双键之间仅隔着一个单键 CH2 CH CH CH2
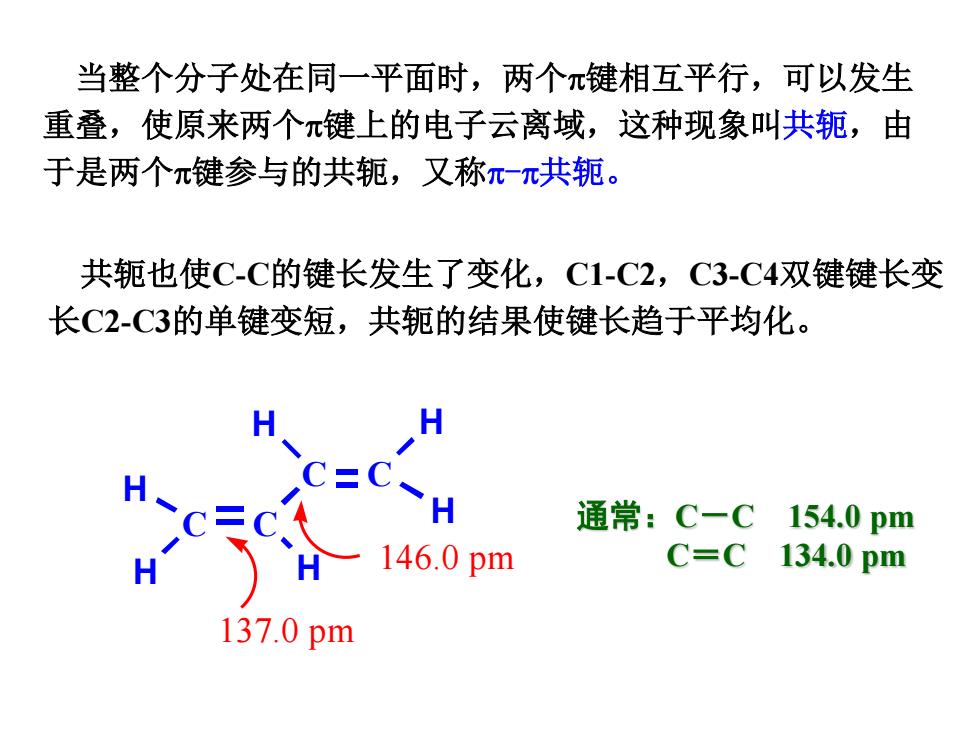
当整个分子处在同一平面时,两个π键相互平行,可以发生 重叠,使原来两个π键上的电子云离域,这种现象叫共轭,由 于是两个π键参与的共轭,又称π一π共轭。 共轭也使C-C的键长发生了变化,C1-C2,C3-C4双键键长变 长C2-C3的单键变短,共轭的结果使键长趋于平均化。 通常:C-C154.0pm 146.0pm C=C 134.0pm 137.0pm
当整个分子处在同一平面时,两个π键相互平行,可以发生 重叠,使原来两个π键上的电子云离域,这种现象叫共轭,由 于是两个π键参与的共轭,又称π-π共轭。 共轭也使C-C的键长发生了变化,C1-C2,C3-C4双键键长变 长C2-C3的单键变短,共轭的结果使键长趋于平均化。 通常:C-C 154.0 pm C=C 134.0 pm C C H C H H C H H H 137.0 pm 146.0 pm
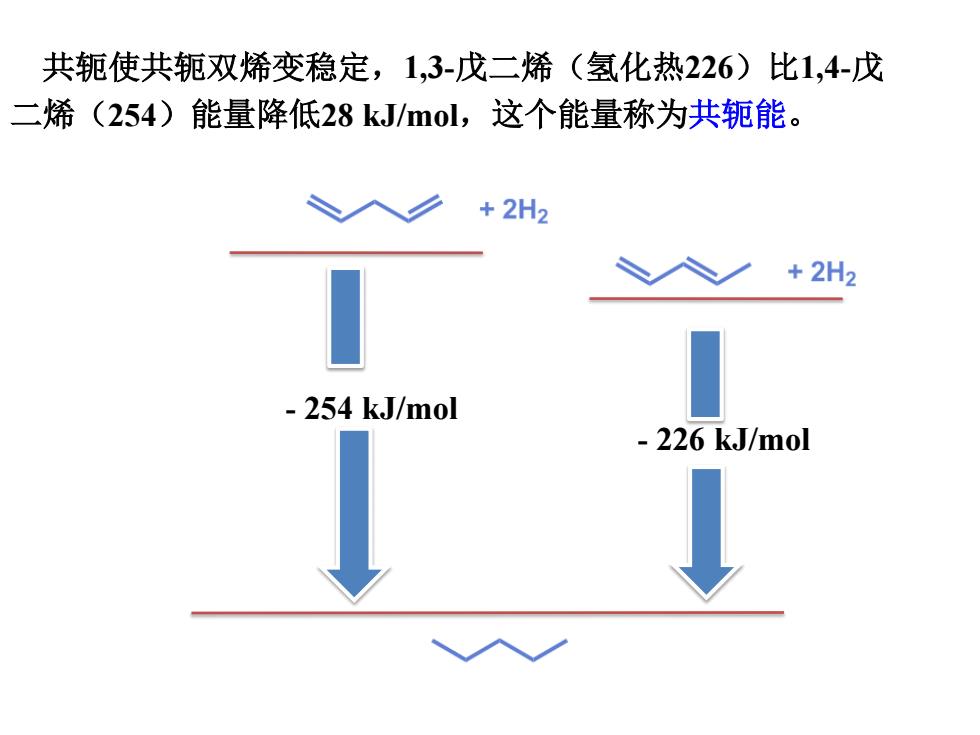
共轭使共轭双烯变稳定,1,3-戊二烯(氢化热226)比1,4-戊 二烯(254)能量降低28kJ/mol,这个能量称为共轭能。 +2H2 +2H2 254 kJ/mol -226kJ/m0l
- 226 kJ/mol - 254 kJ/mol 共轭使共轭双烯变稳定,1,3-戊二烯(氢化热226)比1,4-戊 二烯(254)能量降低28 kJ/mol,这个能量称为共轭能
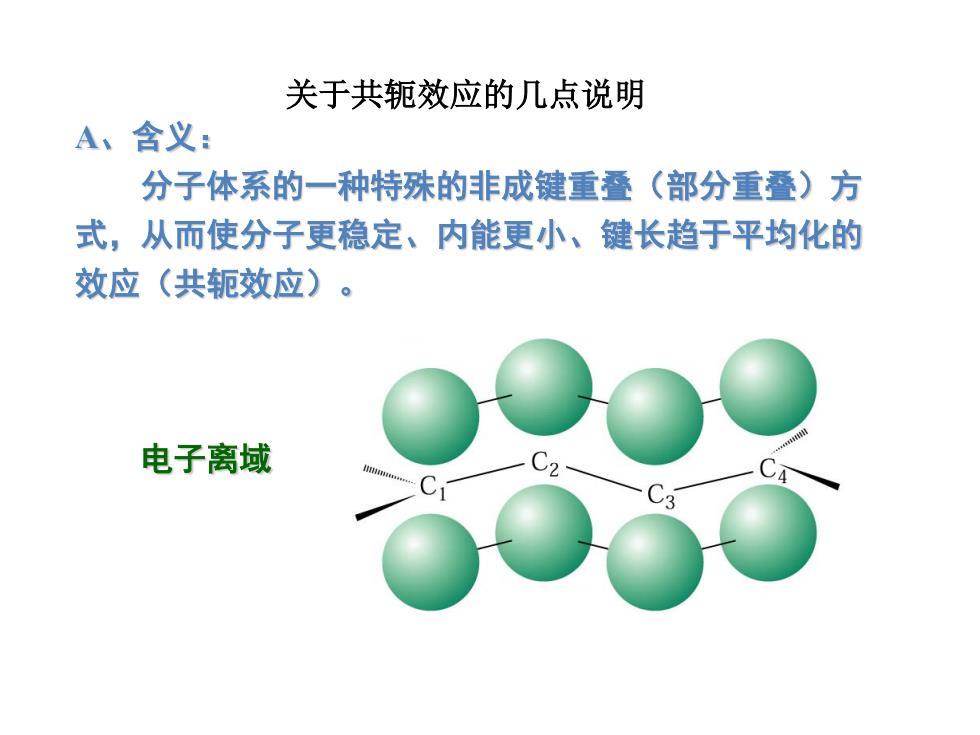
关于共轭效应的几点说明 A、含义: 分子体系的一种特殊的非成键重叠(部分重叠)方 式,从而使分子更稳定、内能更小、键长趋于平均化的 效应(共轭效应) 。 电子离域
电子离域 A、含义: 分子体系的一种特殊的非成键重叠(部分重叠)方 式,从而使分子更稳定、内能更小、键长趋于平均化的 效应(共轭效应)。 关于共轭效应的几点说明
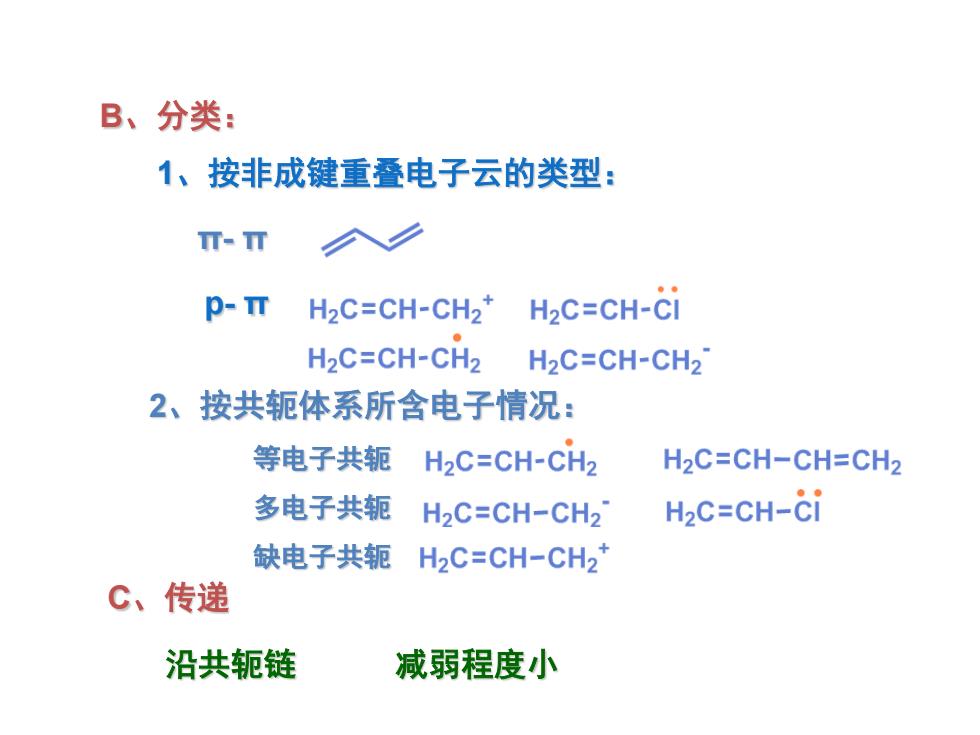
B、分类: 1、按非成键重叠电子云的类型: I-m p-TT H2C=CH-CH2* H2C=CH-Ci H2C=CH-CH2 H2C=CH-CH2 2、按共轭体系所含电子情况: 等电子共轭 H2C=CH-CH2 H2C=CH-CH=CH2 多电子共轭 H2C=CH-CH27 H2C=CH-ci 缺电子共轭 H2C=CH-CH2* C、传递 沿共轭链 减弱程度小
B、分类: 2、按共轭体系所含电子情况: 等电子共轭 多电子共轭 缺电子共轭 C、传递 沿共轭链 减弱程度小 π- π 1、按非成键重叠电子云的类型: p- π

D、共轭体系分子轨道形状 由四个碳原子组成的共轭体系 aeoa orbitals 反键轨道 1⊥11 Four isolated porbitals (with an electron in each) 成键轨道 orbitals molecular orbitals Calculated molecular orbitals
D、共轭体系分子轨道形状 由四个碳原子组成的共轭体系 反键轨道 成键轨道
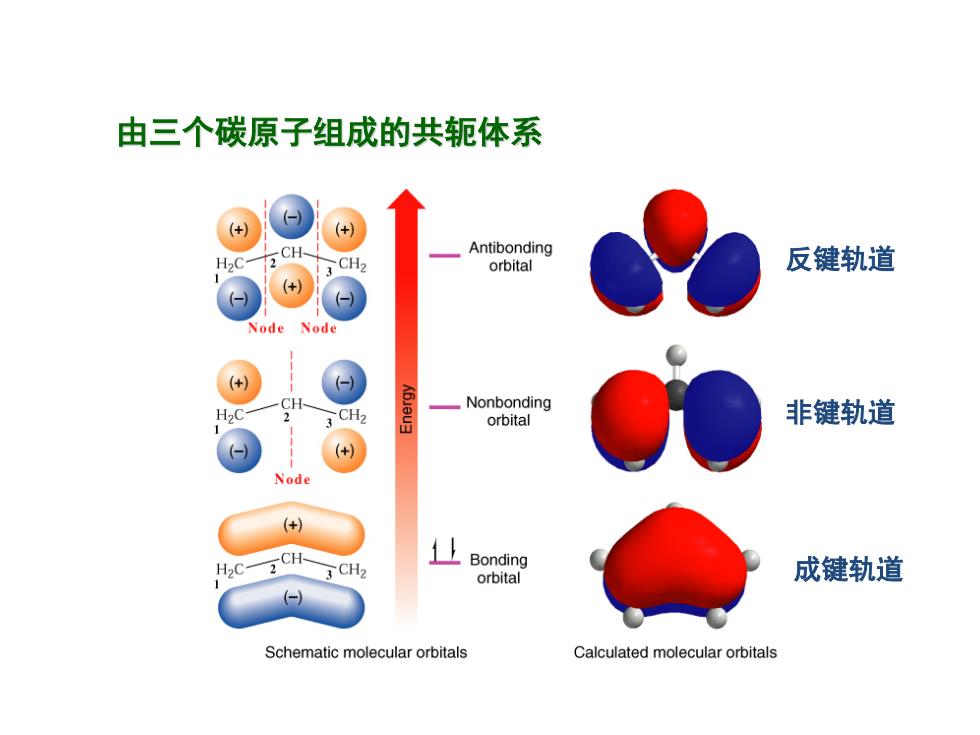
由三个碳原子组成的共轭体系 Antibonding orbital 反键轨道 Node Node (+) Nonbonding CH2 orbital 非键轨道 Node (+ CH ⊥Bonding orbital 成键轨道 Schematic molecular orbitals Calculated molecular orbitals
由三个碳原子组成的共轭体系 反键轨道 成键轨道 非键轨道