
6A 第十三章氧族元素 O Chapter 13 THel2s22p oxygen 16.00 Oxygen Family Elements 16 Ne]3s23p sulfur 32.07 oxygen Sulphur Selenium 4 Se 0 S Se A4s23d104p 898 Tellurium Polonium 是 Te Po 1276 84 也称为成矿元素 Po e624r145d106 polonium (ore-forming element) (209) ns2np4
第十三章 氧族元素 Chapter 13 Oxygen Family Elements Oxygen Sulphur Selenium O S Se Tellurium Polonium Te Po 也称为成矿元素 (ore-forming element) ns2np4
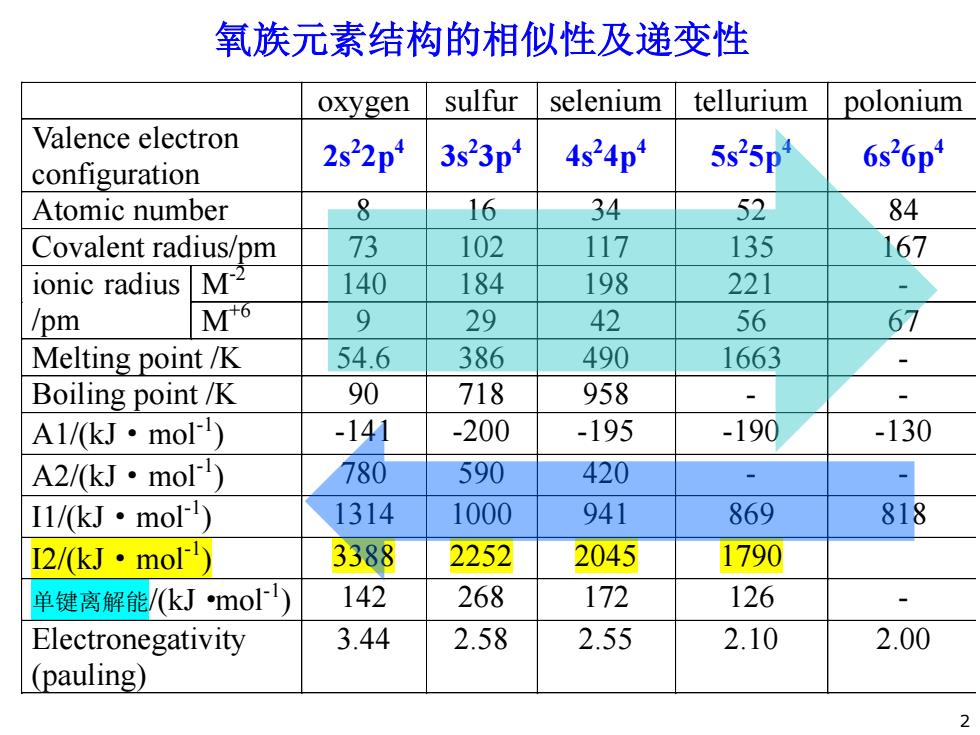
氧族元素结构的相似性及递变性 oxygen sulfur selenium tellurium polonium Valence electron configuration 2s22p 3s23p 4s24p 5s25p 6s26p Atomic number 8 16 34 52 84 Covalent radius/pm 73 102 117 135 167 ionic radius M2 140 184 198 221 /pm M6 9 29 42 56 67 Melting point /K 54.6 386 490 1663 Boiling point/K 90 718 958 A1/kJ·mol -141 -200 -195 -190 -130 A2/kJ·mol) 780 590 420 Il/kJ·mo) 1314 1000 941 869 818 I2/kJ·mo) 3388 2252 2045 1790 单键离解能/kJmo) 142 268 172 126 Electronegativity 3.44 2.58 2.55 2.10 2.00 (pauling) 2
oxygen sulfur selenium tellurium polonium Valence electron configuration 2s2 2p4 3s2 3p4 4s2 4p4 5s2 5p4 6s2 6p4 Atomic number 8 16 34 52 84 Covalent radius/pm 73 102 117 135 167 ionic radius /pm M-2 140 184 198 221 - M+6 9 29 42 56 67 Melting point /K 54.6 386 490 1663 - Boiling point /K 90 718 958 - - A1/(kJ·mol-1 ) -141 -200 -195 -190 -130 A2/(kJ·mol-1 ) 780 590 420 - - I1/(kJ·mol-1 ) 1314 1000 941 869 818 I2/(kJ·mol-1 ) 3388 2252 2045 1790 单键离解能/(kJ·mol-1 ) 142 268 172 126 - Electronegativity (pauling) 3.44 2.58 2.55 2.10 2.00 氧族元素结构的相似性及递变性 2
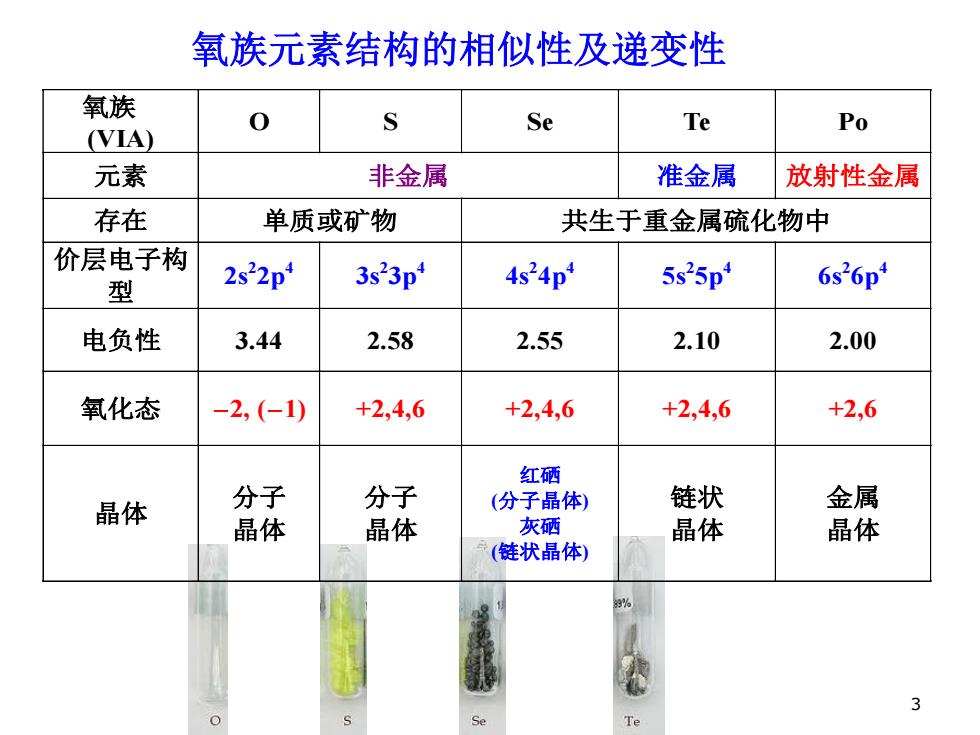
氧族元素结构的相似性及递变性 氧族 0 (VIA) Se Te Po 元素 非金属 准金属 放射性金属 存在 单质或矿物 共生于重金属硫化物中 价层电子构 型 2s22p 3s23p 4s24p 5s25p4 6s26p 电负性 3.44 2.58 2.55 2.10 2.00 氧化态 -2,(-1) +2,4,6 +2,4,6 +2,4,6 +2,6 红硒 晶体 分子 分子 (分子晶体) 链状 金属 晶体 晶体 灰硒 晶体 晶体 (链状晶体) 9% 3 Te
氧族元素结构的相似性及递变性 氧族 (VIA) O S Se Te Po 元素 非金属 准金属 放射性金属 存在 单质或矿物 共生于重金属硫化物中 价层电子构 型 2s 2 2p4 3s2 3p4 4s 2 4p4 5s 2 5p4 6s 2 6p4 电负性 3.44 2.58 2.55 2.10 2.00 氧化态 -2, (-1) +2,4,6 +2,4,6 +2,4,6 +2,6 晶体 分子 晶体 分子 晶体 红硒 (分子晶体) 灰硒 (链状晶体) 链状 晶体 金属 晶体 3

$13-1 Oxygen and its compounds -、Simple substance 1.除了He、Ne、Ar以外,氧与所有 元素化合;只有与氟化合时,才呈还 原性(OF2)。 2.最常见的氧化数为-2,还有+2 Colorless gas:pale blue liquid.Oxygen bubbles rise in this photo of liquid oxygen (oF2),+4[0(02)], +1(02F2),-1(H202)
一、Simple substance 1. 除了He、Ne、Ar以外,氧与所有 元素化合;只有与氟化合时,才呈还 原性(OF2)。 2. 最常见的氧化数为-2,还有+2 (OF2) ,+4[O(O2)] , +1(O2F2) , -1(H2O2) §13-1 Oxygen and its compounds 4
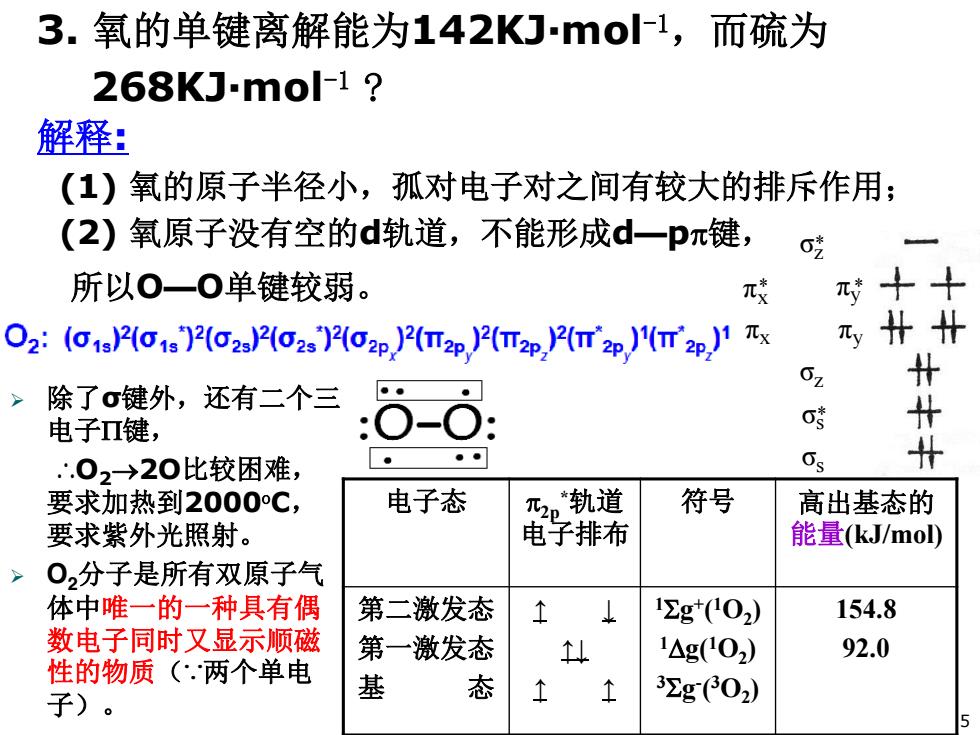
3.氧的单键离解能为142KJmo1,而硫为 268KJmo-1? 解释: (1)氧的原子半径小,孤对电子对之间有较大的排斥作用: (2)氧原子没有空的d轨道,不能形成d一pπ键, 0 所以O一0单键较弱。 π装 O2:((0)2(22(O2(Ozp)2(W2p)2(T2p2(p)(p)1 x 元扑北 02 t > 除了σ键外,还有二个三只 电子Π键, 专 ●● ∴.02→20比较困难, 5 t 要求加热到2000C, 电子态 乃轨道 符号 高出基态的 要求紫外光照射。 电子排布 能量(kJ/mo) 02分子是所有双原子气 体中唯一的一种具有偶 第二激发态 12g*02) 154.8 数电子同时又显示顺磁 第一激发态 个 1△g02) 92.0 性的物质(.两个单电 基 态 子)。 个 3Σg(02) 5
解释: (1) 氧的原子半径小,孤对电子对之间有较大的排斥作用; (2) 氧原子没有空的d轨道,不能形成d—pS键, 所以O—O单键较弱。 电子态 S2p *轨道 电子排布 符号 高出基态的 能量(kJ/mol) 第二激发态 第一激发态 基 态 ↑ ↓ ↑↓ ↑ ↑ 16g+(1O2) 1'g(1O2) 36g- (3O2) 154.8 92.0 σz πx πy πx * πy * σz * σs σs * ¾ 除了σ键外,还有二个三 电子3键, ∴O2o2O比较困难, 要求加热到2000oC, 要求紫外光照射。 ¾ O2分子是所有双原子气 体中唯一的一种具有偶 数电子同时又显示顺磁 性的物质(∵两个单电 子)。 5 3. 氧的单键离解能为142KJ·mol-1,而硫为 268KJ·mol-1 ?
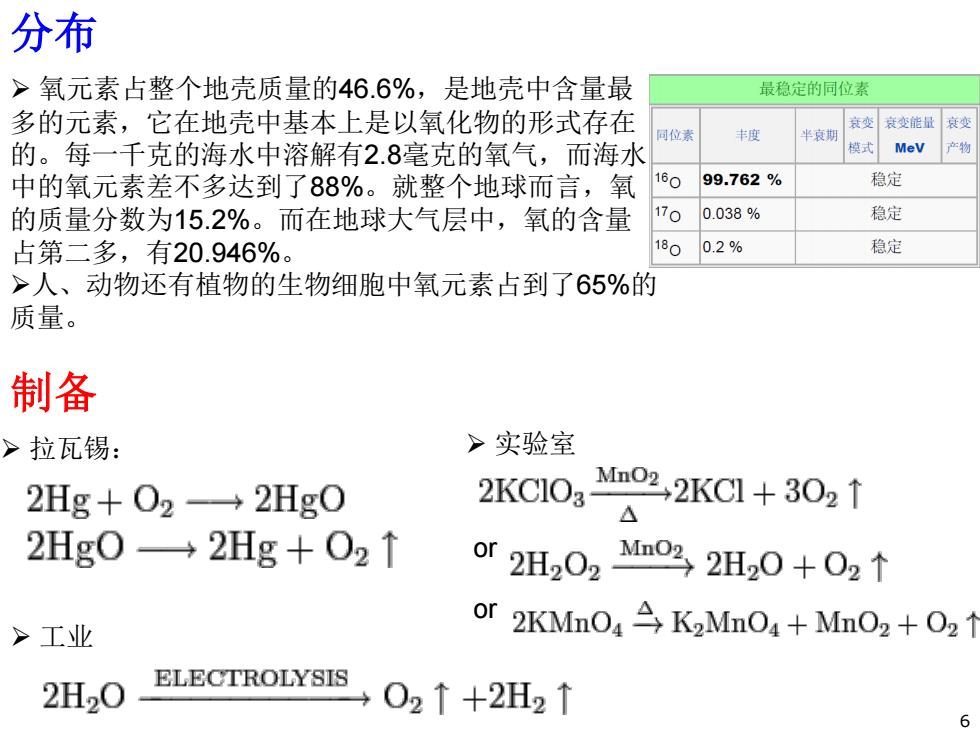
分布 >氧元素占整个地壳质量的46.6%,是地壳中含量最 最稳定的同位素 多的元素,它在地壳中基本上是以氧化物的形式存在 衰变衰变能量衰变 同位素 丰度 半哀期 的。每一千克的海水中溶解有28毫克的氧气,而海水 模式 MeV 产物 中的氧元素差不多达到了88%。就整个地球而言,氧 160 99.762% 稳定 的质量分数为15.2%。而在地球大气层中,氧的含量 170 0.038% 稳定 占第二多,有20.946%。 180 0.2% 稳定 >人、动物还有植物的生物细胞中氧元素占到了65%的 质量。 制备 >拉瓦锡: >实验室 2Hg+02→2Hg0 2KC103 Mmo2,2KC+302↑ △ 2Hg0→2Hg+02↑ or2H202M032H20+02↑ or >工业 2KMnO K2Mn04+Mn2 +02 1 ELECTROLYSIS 2H20 02↑+2H2↑ 6
¾ 氧元素占整个地壳质量的46.6%,是地壳中含量最 多的元素,它在地壳中基本上是以氧化物的形式存在 的。每一千克的海水中溶解有2.8毫克的氧气,而海水 中的氧元素差不多达到了88%。就整个地球而言,氧 的质量分数为15.2%。而在地球大气层中,氧的含量 占第二多,有20.946%。 ¾人、动物还有植物的生物细胞中氧元素占到了65%的 质量。 ¾ 拉瓦锡: 分布 制备 ¾ 实验室 or ¾ 工业 or 6
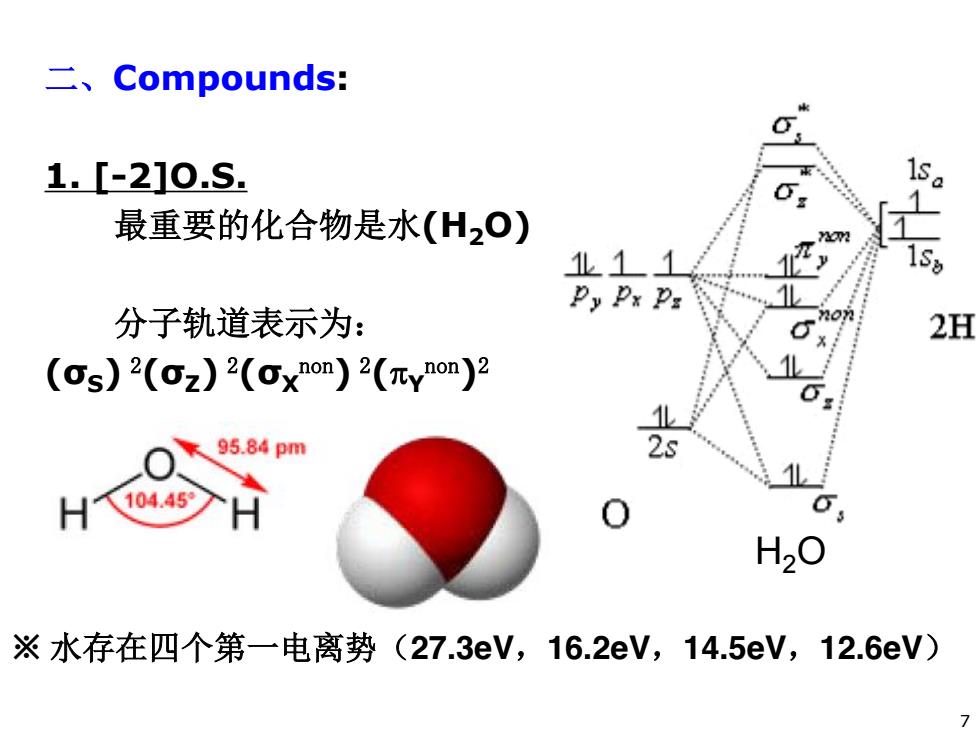
二、Compounds: 1.[-210.S. 最重要的化合物是水(H2O) 07 1L11 Py Px P: 分子轨道表示为: 2H (s)2(z)2(xnon)2(nynon)2 95.84pm 2s 104.45 ※水存在四个第一电离势(27.3eV,16.2eV,14.5eV,12.6eV)
二、Compounds: 1. [-2]O.S. 最重要的化合物是水(H2O) 分子轨道表示为: (σS) 2(σZ) 2(σX non) 2(SY non)2 H2O 7 ※ 水存在四个第一电离势(27.3eV,16.2eV,14.5eV,12.6eV)

2P: +2p H. H s 1 IP,P:p: 2H non 17 2s 2s ※Py垂直于HOH xy平面 →不能与H1s重叠→元non H,O i,0 8
8 ※ Py垂直于HOH xy平面 不能与H1s重叠Snon
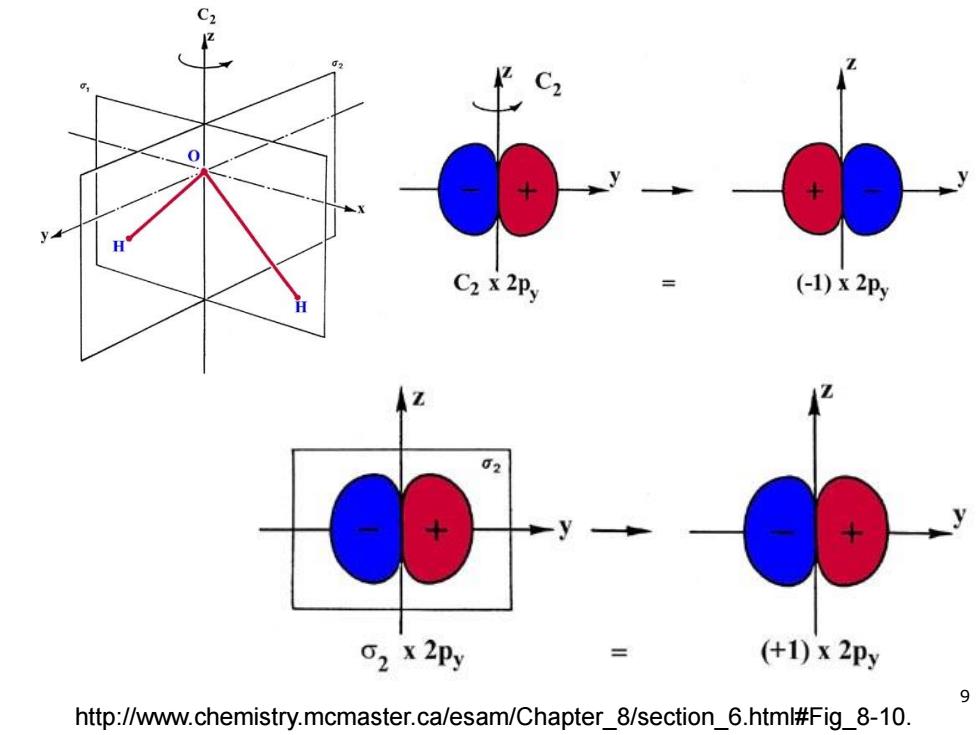
C2 C2 x 2Py (-1)x 2Py 2 X 2Py (+1)x2py 9 http://www.chemistry.mcmaster.ca/esam/Chapter 8/section 6.html#Fig 8-10
http://www.chemistry.mcmaster.ca/esam/Chapter_8/section_6.html#Fig_8-10. 9

Table 8-3 Symmetry Properties and Orbital Energies for the Water Molecule Atomic Orbitals Symmetry Behaviour Under Symmetry on Oxygen Classification Orbital Energy(au) 6 0 0 +1 +1 +1 20.669 2s +1 +1 +1 -1.244 2p. +1 +1 +1 8 2p. y +1 1 b -0.632 2p, -1 -1 +1 b Atomic Orbitals on Hydrogen (1s+1s) +1 +1 +1 (1s-1s) -1 b 3 -0.500 Molecular Orbital Energies for HO(au) la, 2a, 1b2 3a, lb, -20.565 -1.339 -0.728 -0.595 -0.521 10 http://www.chemistry.mcmaster.ca/esam/Chapter 8/section 6.html#Table 8-3
http://www.chemistry.mcmaster.ca/esam/Chapter_8/section_6.html#Table_8-3. 10