
5A 7 N 第十四章氮族元素 THel2s22p nitrogen 14.01 Chapter 14 Nitrogen 15 P [Ne]3s23p Family Elements 50.7 3 As Nitrogen Phosphorus Arsenic arsenic 74.92 N P As Sb K5s24d105p Antimony Bismuth antimony 121.8 Sb Bi Bi bismuth 208.9 ns2np3
第十四章 氮族元素 Chapter 14 Nitrogen Family Elements Nitrogen Phosphorus Arsenic N P As Antimony Bismuth Sb Bi ns2np3
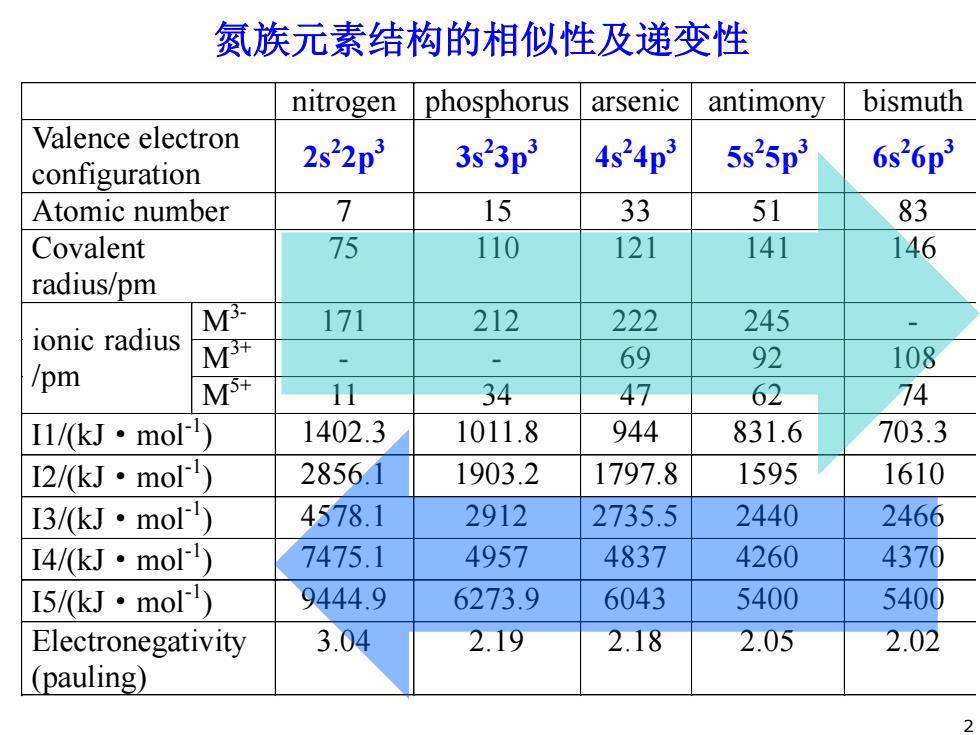
氮族元素结构的相似性及递变性 nitrogen phosphorus arsenic antimony bismuth Valence electron configuration 2s22p3 3s23p3 4s24p 5s25p3 6s26p3 Atomic number 7 15 33 51 83 Covalent 75 110 121 141 146 radius/pm M3- 171 212 222 245 ionic radius M开 69 92 108 /pm MS 11 34 47 62 74 I1/kJ·mol) 1402.3 1011.8 944 831.6 703.3 I2/kJ·mol) 2856.1 1903.2 1797.8 1595 1610 I3/kJ·mol) 4578.1 2912 2735.5 2440 2466 I4/kJ·mo) 7475.1 4957 4837 4260 4370 I5/kJ·molr) 9444.9 6273.9 6043 5400 5400 Electronegativity 3.04 2.19 2.18 2.05 2.02 (pauling) 2
nitrogen phosphorus arsenic antimony bismuth Valence electron configuration 2s2 2p3 3s2 3p3 4s2 4p3 5s2 5p3 6s2 6p3 Atomic number 7 15 33 51 83 Covalent radius/pm 75 110 121 141 146 ionic radius /pm M3- 171 212 222 245 - M3+ - - 69 92 108 M5+ 11 34 47 62 74 I1/(kJ·mol-1 ) 1402.3 1011.8 944 831.6 703.3 I2/(kJ·mol-1 ) 2856.1 1903.2 1797.8 1595 1610 I3/(kJ·mol-1 ) 4578.1 2912 2735.5 2440 2466 I4/(kJ·mol-1 ) 7475.1 4957 4837 4260 4370 I5/(kJ·mol-1 ) 9444.9 6273.9 6043 5400 5400 Electronegativity (pauling) 3.04 2.19 2.18 2.05 2.02 氮族元素结构的相似性及递变性 2
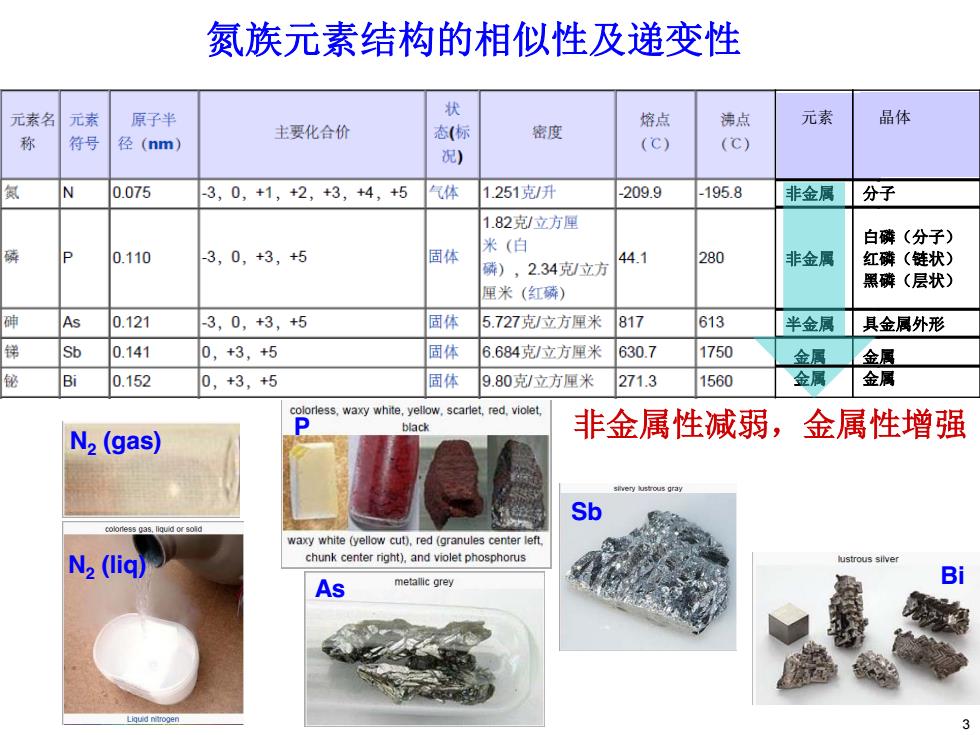
氮族元素结构的相似性及递变性 元素名 元素 原子半 状 主要化合价 熔点 沸点 元素 晶体 密度 称 符号 径(nm) 态(标 (C)】 (C) 况) N 0.075 3,0,+1,+2,+3,+4,+5 气体 1.251克/升 -209.9 -195.8 非金属] 分子 1.82克/立方厘 米(白 白磷(分子) 0.110 3,0,+3,+5 固体 44.1 280 磷),2.34克立方 非金属 红磷(链状) 黑磷(层状) 厘米(红磷) 砷 As 0.121 3,0,+3,5 固体 5.727克/立方厘米 817 613 半金属 具金属外形 锑 Sb 0.141 0,+3,+5 固体 6.684克立方厘米 630.7 1750 金属 金属 Bi 0.152 0,+3,+5 固体 9.80克/立方厘米 271.3 1560 金属 金属 less,waxy white,yellow,scarlet,red,violet, black N2(gas) 非金属性减弱,金属性增强 Sb waxy white (yellow cut),red(granules center left. N2 (liq) chunk center right),and violet phosphorus lustrous silver As metallic grey
非金属性减弱,金属性增强 元素 非金属 非金属 半金属 金属 金属 晶体 分子 白磷(分子) 红磷(链状) 黑磷(层状) 具金属外形 金属 金属 氮族元素结构的相似性及递变性 As Sb Bi N2 (gas) N2 (liq) P 3

§14-1 Nitrogen and its compounds 一、General properties >其电负性(electronegativity,3.04)仅 N2(gas) 次于氟(4.0)、氧(3.5)、氯(3.16); >N的三重键键能大于P、C的三重键键能, 但N的单重键键能很弱; N2(liq) N≡N945kJmo11 P=P 481kJ.mol 1 C≡C 835kJ-mol-1 N-N 200 kJ-mol-1 346kJmol >氮的氧化数为-3,-2,-1,+1,+3,+5; 也有+2,+4
一、General properties ¾ 其电负性(electronegativity, 3.04)仅 次于氟(4.0)、氧(3.5)、氯(3.16); ¾ N的三重键键能大于P、C的三重键键能, 但N的单重键键能很弱; ¾ 氮的氧化数为-3, -2, -1, +1, +3, +5; 也有+2, +4 §14-1 Nitrogen and its compounds N2 (gas) N2 (liq) 4

一、General properties >氮为植物和动物机体蛋白质的成份(proteins); >存在:主要存在于空气中(占空气体积的78%)、动 植物体内(组成蛋白质的重要元素)。在地壳中的丰 度为4.6x10-3,主要以硝石(Chile saltpeter智利硝石 NaNO3;Indian saltpeter印度硝石KNO3): 也存在于星云和太阳大气,天王星,海王星中
一、General properties ¾ 氮为植物和动物机体蛋白质的成份(proteins); ¾ 存在:主要存在于空气中(占空气体积的78%)、动 植物体内(组成蛋白质的重要元素)。在地壳中的丰 度为4.6x10-3 , 主要以硝石(Chile saltpeter 智利硝石 NaNO3; Indian saltpeter 印度硝石 KNO3); 也存在于星云和太阳大气,天王星,海王星中。 5

发现及命名 >1772年在苏格兰爱丁堡,由伦敦的医生、化学家 Daniel Rutherford D.Rutherford发现。D.Rutherford发现将生物放 入其中都会室息而死,因此命名为noxious air(有 毒的气体); >1787年Lavoisier将其称为Azote(来自希腊文 azotos(无生命的):席勒将之命名为“无用的气 体” 。 >德文中便直接以sticken(导致室息)和Stoff(物质)组 合,命名为Stickstoff(导致室息的物质),日文及韩 文便自此将之意译为“室素”。 英文名称Nitrogen则来自希腊文Nitre(硝石)和gen (构成.的物质)组合(构成硝石的物质)
发现及命名 ¾1772年在苏格兰爱丁堡,由 伦敦的医生、化学家 D. Rutherford 发现。D. Rutherford发现将生物放 入其中都会窒息而死,因此命名为noxious air(有 毒的气体); ¾ 1787年Lavoisier将其称为Azote(来自希腊文 azotos(无生命的);席勒将之命名为“无用的气 体”。 ¾ 德文中便直接以sticken(导致窒息)和Stoff(物质)组 合,命名为Stickstoff(导致窒息的物质),日文及韩 文便自此将之意译为“窒素”。 ¾ 英文名称Nitrogen则来自希腊文Nitre(硝石)和gen (构成.的物质)组合 (构成硝石的物质)。 6

用途 ★低温外科。 ★冷却剂(液氨)。 ★氨产物和肥料。 ★火箭燃料。 ★氮气保护光亮退火,金属粉末烧 结,淬火气体渗氮。 成安装置 高能燃料 N ★石油、化工行业:化工厂做保护 气,置换气,洗涤气以保障生产 安全。 ★电子元器件制造及生产线保护。 ★食品储存保鲜。 ★药物充氮、包装运输及生产中置 换、洗涤用气。 ★浮法玻璃锡槽保护气。 液氮冷却剂 于冷轧带钢 汽车中的气袋
用 途 7
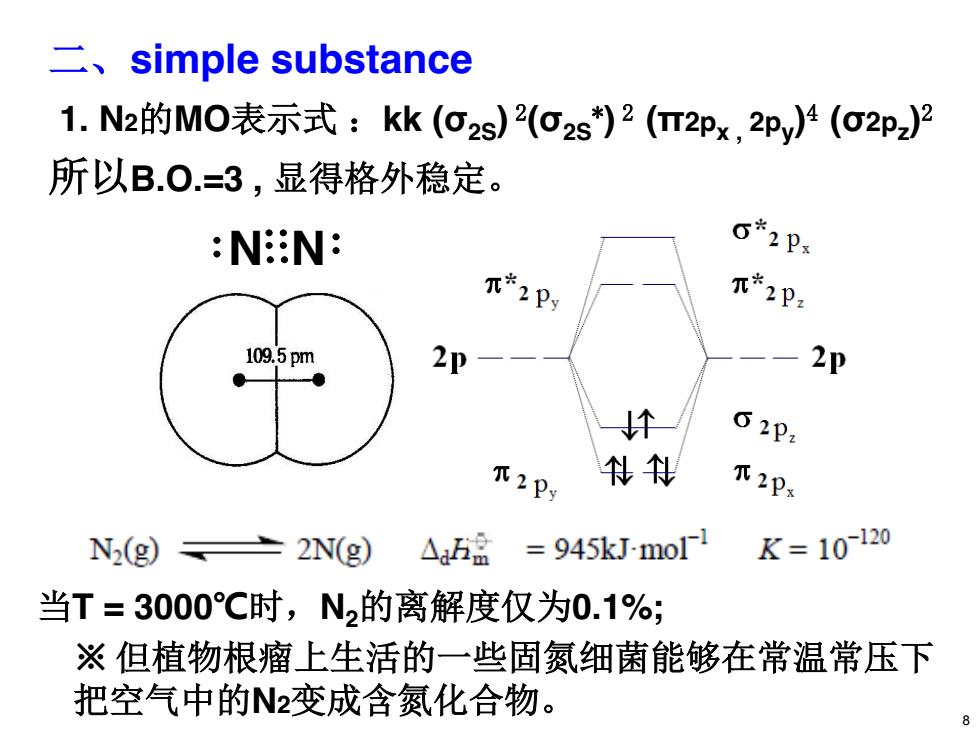
二、simple substance 1.N2的MO表示式:kk(o2s)2(o2s)2(T2Px,2py)4(o2pz) 所以B0.=3,显得格外稳定。 NN: 6*2px 元*2Py 元*2P2 109.5pm 2p 2P 个 62P1 下2Py 俐钊 w2Ps N2(g)± 2N(g) )△:h盘=945 kJ-mol K=10-120 当T=3000℃时,N2的离解度仅为0.1%; ※但植物根瘤上生活的一些固氮细菌能够在常温常压下 把空气中的N2变成含氮化合物
二、simple substance 1. N2的MO表示式 :kk (σ2S) 2(σ2S *) 2 (π2px , 2py)4 (σ2pz)2 所以B.O.=3 , 显得格外稳定。 当T = 3000℃时,N2的离解度仅为0.1%; ※ 但植物根瘤上生活的一些固氮细菌能够在常温常压下 把空气中的N2变成含氮化合物。 N N 8

2.许多氮化物的△H0>0,而△S<0,所以△G总是大于 零,因此氨化物在热力学上不稳定,易分解。 3.在通常条件下,N2是化学惰性的,在一定条件下, N2与金属,非金属反应: Li,Mg,Ca,Sr,Ba在炽热温度与N2直接化合 6Li+N2△ 2LisN 放电 N2+O2 2NO N2+3H2= 2NH3(中温,高压,催化剂) N2(g)+CaC2(s)=CaCN2(s)(calcium cyanamide)+C(s) 制备 (1)Industry:液态空气低温分馏; (2)Laboratory: NHCI NaNO2 NaCl NH4NO2 NH4NO2云N2+2H2O
3. 在通常条件下, N2是化学惰性的,在一定条件下, N2与金属,非金属反应: Li, Mg , Ca , Sr , Ba在炽热温度与N2直接化合 N2 (g) + CaC2 (s) = CaCN2 (s) (calcium cyanamide) + C (s) 2. 许多氮化物的∆Hf O >0,而∆S<0,所以∆Gf O总是大于 零,因此氮化物在热力学上不稳定,易分解。 9 (1) Industry: 液态空气低温分馏; (2) Laboratory: NH4Cl + NaNO2 = NaCl + NH4NO2 NH4NO2 = N2 + 2H2O 制 备
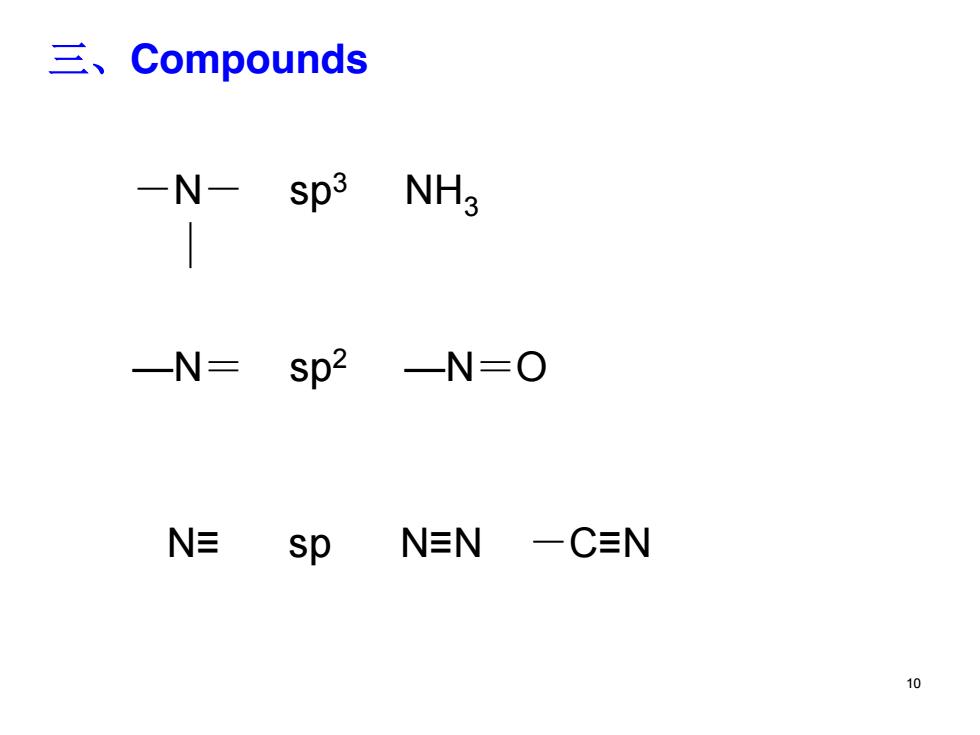
三、Compounds -N-sp3 NHg -N=sp2 -N=O N sp NEN 一CN 0
三、Compounds -N- sp3 NH3 ~ —N= sp2 —N=O N≡ sp N≡N -C≡N 10