
中国绅学我术大学 University of Science and Technology of China 第2章 化学热力学基础与化学平衡 Chapter 2 The Basis of Chemical Thermodynamics Chemical Equilibrium
第2章 化学热力学基础与化学平衡 Chapter 2 The Basis of Chemical Thermodynamics & Chemical Equilibrium

本章重点 >状态函数与热力学平衡态: >热力学第零定律与温度 >热力学第一定律:U,W,Q,H,热化学 >热力学第二/三定律:S,G >化学平衡:△,Gm,平衡常数,影响因素(T,p等)
本章重点 状态函数与热力学平衡态; 热力学第零定律与温度 热力学第一定律:U,W,Q,H,热化学 热力学第二/三定律:S,G 化学平衡:rGm,平衡常数,影响因素(T, p等)

§2.1化学热力学的体系与状态 一、化学热力学的特点和范围 >化学热力学 ·热力学:研究宏观物体的各种与热和温度有关的现象 及其相互联系与规律的一门学科 ·化学热力学:用热力学基本原理来研究化学及有关物 理现象,化学学科的一个重要分支 >化学反应的基本问题: ·反应能否发生? ·反应发生时的能量变化如何? ·反应能进行到什么程度?即什么情况下反应达到平衡? ·反应速率多大? ·反应机理如何?
§2.1 化学热力学的体系与状态 一、化学热力学的特点和范围 化学热力学 • 热力学:研究宏观物体的各种与热和温度有关的现象 及其相互联系与规律的一门学科 • 化学热力学:用热力学基本原理来研究化学及有关物 理现象,化学学科的一个重要分支 化学反应的基本问题: • 反应能否发生? • 反应发生时的能量变化如何? • 反应能进行到什么程度?即什么情况下反应达到平衡? • 反应速率多大? • 反应机理如何?

1.化学热力学的研究范围 >反应的能量变化关系: √热力学第一定律,能量守恒与转化定律在宏观热力学中 的具体表述 >反应的方向性和限度,化学平衡: √热力学第二定律, ·例:C(graphite)→C(diamond) 298K,p=1atm,反应不能进行(△Gme>0) p=1.52×109Pa,反应可能进行(△Gm≤0) ·例:甲烷偶联反应 2CH4→C2H6+H2 AGm(298K)=68.6 kJ mol-1 4CH +22C2H6+2H2O A,Gm(298K)=-320 kJ mol-1
1.化学热力学的研究范围 反应的能量变化关系: 热力学第一定律,能量守恒与转化定律在宏观热力学中 的具体表述 反应的方向性和限度,化学平衡: 热力学第二定律, • 例: C (graphite ) → C (diamond ) 298K ,p = 1 atm,反应不能进行( G m ө > 0 ) p = 1.52 × 10 9 Pa,反应可能进行( G m 0 ) • 例:甲烷偶联反应 2CH 4 → C 2 H 6 + H 2 r G m ө(298K) = 68.6 kJ mol 1 4CH 4 + O 2 → 2C 2 H 6 + 2H 2O r G m ө(298K) = 320 kJ mol 1

2.化学热力学的特点 研究对象:由大量质点组成的宏观集合体 ·讨论大量质点集合体的宏观性质及其相互关系 ·不依赖微观结构,而不涉及变化的微观进程和速率 ·以热力学三大定律为基础,只适用于平衡体系 3.局限性 ·对单个微观粒子(原子/分子)的性质无能为力 ·虽然其规律具有高度的可靠性和普适性,且不受对物 质微观结构认识的发展而影响;但是不能给出微观性 质和宏观性质之间的联系 >统计热力学:联系微观性质和宏观性质之间的桥梁
2. 化学热力学的特点 • 研究对象:由大量质点组成的宏观集合体 • 讨论大量质点集合体的宏观性质及其相互关系 • 不依赖微观结构,而不涉及变化的微观进程和速率 • 以热力学三大定律为基础,只适用于平衡体系 3. 局限性 • 对单个微观粒子(原子/分子)的性质无能为力 • 虽然其规律具有高度的可靠性和普适性,且不受对物 质微观结构认识的发展而影响;但是不能给出微观性 质和宏观性质之间的联系 统计热力学:联系微观性质和宏观性质之间的桥梁

二、系统和环境 1.定义: >系统(system):用边界把一部分物质与其余物质区分 开,则这部分被选定的物质(和空间)称为“系统” (或体系)。 √即热力学研究对象 √宏观集合体或空间,包括大量物质粒子 >环境(surroundings):与系统通过边界相隔开,并与 系统密切相关且影响所能及的周围部分物质或空间。 >边界(boundary):划分系统和环境的界面 √几何界面,不包含物质,不存在物理化学性质 √可根据处理实际问题的方便需要来人为选取
二、系统和环境 1.定义: 系统 (system):用边界把一部分物质与其余物质区分 开,则这部分被选定的物质(和空间)称为 “系统” (或体系)。 即热力学研究对象 宏观集合体或空间,包括大量物质粒子 环境 (surroundings) :与系统通过边界相隔开,并与 系统密切相关且影响所能及的周围部分物质或空间。 边界 (boundary):划分系统和环境的界面 几何界面,不包含物质,不存在物理化学性质 可根据处理实际问题的方便需要来人为选取
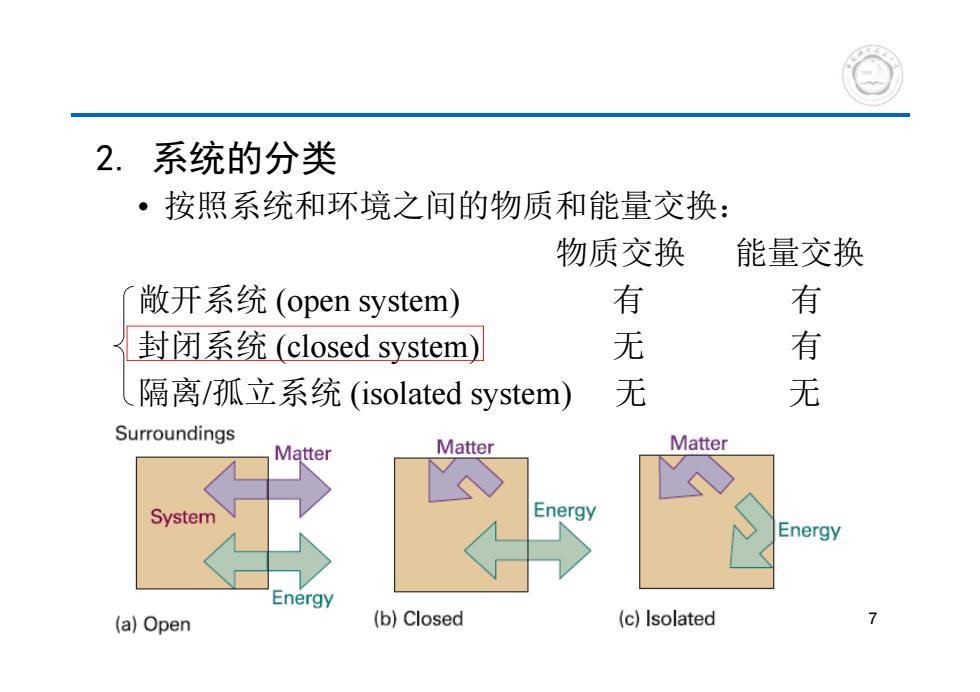
2.系统的分类 ·按照系统和环境之间的物质和能量交换: 物质交换 能量交换 敞开系统(open system) 有 有 封闭系统(closed system) 无 有 隔离/孤立系统(isolated system) 无 无 Surroundings Matter Matter Matter System Energy Energy Energy (a)Open (b)Closed (c)Isolated 7
7 2. 系统的分类 • 按照系统和环境之间的物质和能量交换: 物质交换 能量交换 敞开系统 (open system) 有 有 封闭系统 (closed system) 无 有 隔离/孤立系统 (isolated system) 无 无

>是否有绝对的孤立系统? ·自然界没有真正的孤立系统 ·孤立系统是热力学的抽象和思考问题的方法 系统+环境=孤立系统 >例如密闭容器中反应: Zn(s)+2HCl(aq)=ZnCl2(aq)+H2(g) ·开放系统(盐酸与Z反应的凝聚相),界面(液体表面) ·封闭系统(密闭容器),界面(容器壁) ·隔离/孤立系统(绝热刚性绝缘不透光的密闭容器)
是否有绝对的孤立系统? • 自然界没有真正的孤立系统 • 孤立系统是热力学的抽象和思考问题的方法 • 系统 + 环境 = 孤立系统 例如密闭容器中反应: Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g) • 开放系统(盐酸与Zn反应的凝聚相),界面(液体表面) • 封闭系统(密闭容器),界面(容器壁) • 隔离/孤立系统(绝热刚性绝缘不透光的密闭容器)

>按照含有物质的种类: 单组分系统:只有一种物质 多组分系统:由多种物质组成 >按照包含的相的数目: 「单相系统(均相系统) (多相系统 >相(phase):系统中物理和化学性质都相同的那一部分 物质,称为一个“相”。 √气体:通常能任意混合,所有气体为一个气相 √液体:按照互溶程度,可为单相、两相或三相等 √固体:一般一种固体物质为一个相 9
9 按照含有物质的种类: 单组分系统:只有一种物质 多组分系统:由多种物质组成 按照包含的相的数目: 单相系统(均相系统) 多相系统 相 (phase):系统中物理和化学性质都相同的那一部分 物质,称为一个“相”。 气体:通常能任意混合,所有气体为一个气相 液体:按照互溶程度,可为单相、两相或三相等 固体:一般一种固体物质为一个相

三、系统的性质、状态和过程 1.系统性质: >用来描述系统热力学状态的宏观可测量性质,也称热 力学变量。一般可分为两类: ·广度性质(extensive properties): √数值与系统数量成正比,具加和性,例如V,m,U √数学上为一次齐函数,f(x,y)=入·f(xy) 。i 强度性质(intensive properties): √数值与系统数量无关,无加和性,例如T,p,p √数学上为零次齐函数f(x,y)=f(x,y)=0·f(x,y) (注:若f(x,y)=2”·f(x,y),则fx,)为n次齐函数) 10
10 三、系统的性质、状态和过程 1. 系统性质: 用来描述系统热力学状态的宏观可测量性质,也称热 力学变量。一般可分为两类: • 广度性质 (extensive properties): 数值与系统数量成正比,具加和性 ,例如 V, m , U 数学上为一次齐函数, • 强度性质 (intensive properties): 数值与系统数量无关,无加和性,例如 T , p , 数学上为零次齐函数 (注:若 ,则 f (x, y) 为 n次齐函数) ( , ) ( , ) 1 f x y f x y ( , ) ( , ) ( , ) 0 f x y f x y f x y f ( x, y ) f ( x, y ) n