
7A 9 F 第十二章卤素 [He]2s22p5 fluorine 19.00 The Halogens C [Ne]3s23p5 chlorine 35.45 Br Fluorine Chlorine A4s23d104p5 bromine 79.90 F CI 53 Bromine lodine Astatine [Kr]5s24d105p5 iodine 126.9 Br At 85 At Xe6f145d10 astatine (210) ns2np5
第十二章 卤素 The Halogens Fluorine Chlorine F Cl Bromine Iodine Astatine Br I At ns2np5
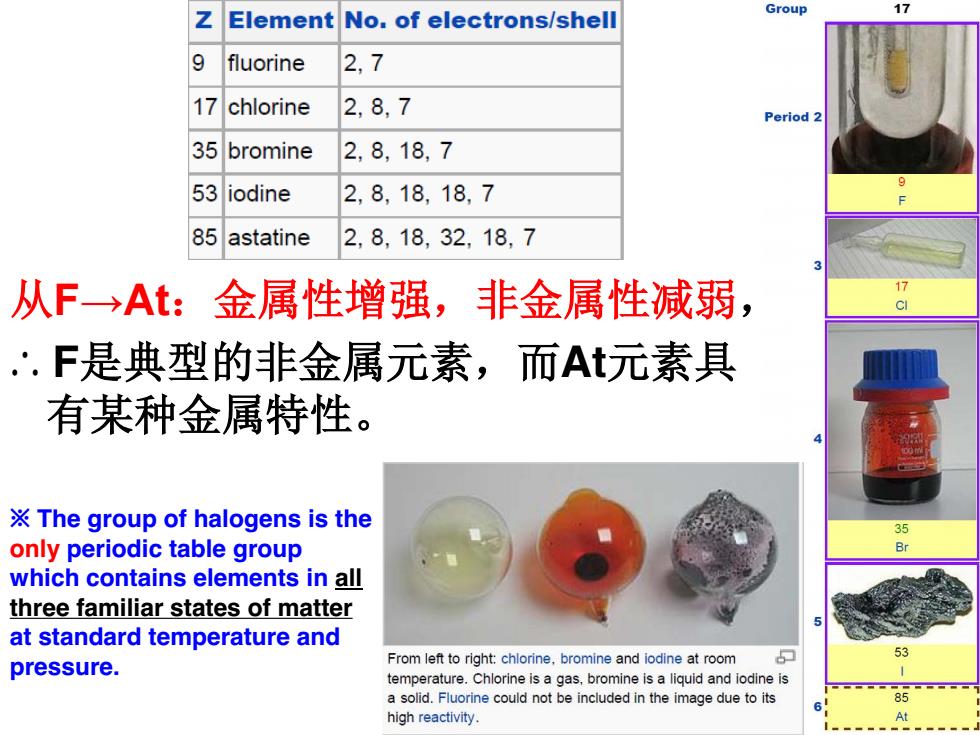
Z 17 Element No.of electrons/shell Group 9 fluorine 2,7 17 chlorine 2,8,7 Period 2 35 bromine 2,8,18,7 53 iodine 2.8,18.18.7 85astatine 2,8,18,32,18,7 从F→At:金属性增强,非金属性减弱, 17 c ∴.F是典型的非金属元素,而At元素具 有某种金属特性。 The group of halogens is the 3 only periodic table group which contains elements in all three familiar states of matter at standard temperature and 53 pressure. From left to right:chlorine,bromine and iodine at room temperature.Chlorine is a gas,bromine is a liquid and iodine is a solid.Fluorine could not be included in the image due to its high reactivity. At
从F→At:金属性增强,非金属性减弱, ∴ F是典型的非金属元素,而At元素具 有某种金属特性。 ※ The group of halogens is the only periodic table group which contains elements in all three familiar states of matter at standard temperature and pressure
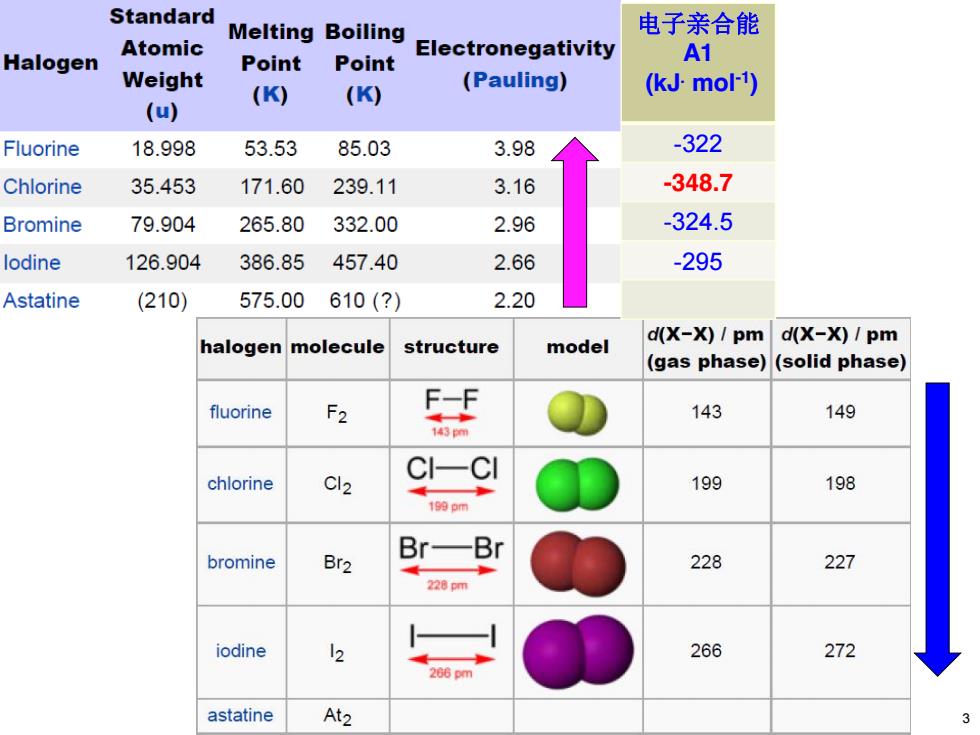
Standard Melting Boiling 电子亲合能 Atomic Halogen Electronegativity Point Point A1 Weight (K) (K) (Pauling) (kJ-mol-1) (u) Fluorine 18.998 53.53 85.03 3.98 -322 Chlorine 35.453 171.60 239.11 3.16 -348.7 Bromine 79.904 265.80 332.00 2.96 -324.5 lodine 126.904 386.85 457.40 2.66 -295 Astatine (210) 575.00 610(?) 2.20 d(X-X)/pm d(X-X)/pm halogen molecule structure model (gas phase)(solid phase) F2 F-F fluorine 143 149 143m chlorine Cl2 199 198 1的pm Br- bromine Br2 228 227 228 iodine 266 272 astatine At2
电子亲合能 A1 (kJ. mol-1) -322 -348.7 -324.5 -295 3

$12-1 Fluorine and its compounds 、氟的电负性为4.0,是电负性最大的 元素。 氟的化合物存在于人体中:主要在 牙中和骨头中;氟在地壳的存量为 0.072%,自然界中以萤石(fluorite, Liquid fuonne at cryogenic temperatures CaF2),冰晶石和氟磷灰石的矿物存在。 F的特殊性: > 主要氧化数:F无正氧化数 > 分解水:F2氧化H20 > 卤化物热力学稳定性:氟化物最稳定 卤化物配位数:氟化物最大 AsFa AsCla AsBra Aslg AsF5AsCl5(-50C分解) Fluorite PbF4PbCl4(R.T.分解)
一、氟的电负性为4.0,是电负性最大的 元素。 氟的化合物存在于人体中:主要在 牙中和骨头中;氟在地壳的存量为 0.072%,自然界中以萤石(fluorite, CaF2),冰晶石和氟磷灰石的矿物存在。 §12-1 Fluorine and its compounds F的特殊性: ¾ 主要氧化数: F 无正氧化数 ¾ 分解水:F2氧化H2O ¾ 卤化物热力学稳定性:氟化物最稳定 ¾ 卤化物配位数:氟化物最大 AsF3 AsCl3 AsBr3 AsI3 AsF5 AsCl5 (-50℃分解) PbF4 PbCl4 (R.T.分解) 4

二、The simple substance 1.F2的化学性质非常活泼: 除了He、Ne、Ar不与F2直接反应外,其它物 质基本都能与F2反应 例如: Si02+2F2=Sif4+02 2H20+2F2=4HF+02 Xe +2F2=XeF 2F2+2NaOH=2NaF+H2O+OF2个(不是酸酐!)
二、The simple substance 1. F2的化学性质非常活泼: 除了He、Ne、Ar不与F2直接反应外,其它物 质基本都能与F2反应 例如: SiO2 + 2F2 = SiF4 + O2 2H2O + 2F2 = 4HF + O2 Xe + 2F2 = XeF4 2F2 + 2NaOH = 2NaF + H2O + OF2 (不是酸酐!) 5

2.为什么F2的化学性质会如此活泼? (1)氟原子半径小,F2中孤电子对之间有较大的 排斥力,加之氟原子的价轨道中不存在d轨道, 它们之间不能形成d一pπ键,所以F一F键弱。 (2)在氟化物中,氟与其它元素形成的化学键非 常强,而且与氟原子反应的活化能低(≤4k小mo), 所以有F2参加的反应,不论在热力学还是在动力学 上都是有利的
2. 为什么F2的化学性质会如此活泼? (1) 氟原子半径小,F2中孤电子对之间有较大的 排斥力,加之氟原子的价轨道中不存在d轨道, 它们之间不能形成d—pπ键,所以F—F键弱。 (2) 在氟化物中,氟与其它元素形成的化学键非 常强,而且与氟原子反应的活化能低(≤ 4kJ·mol-1) , 所以有F2参加的反应,不论在热力学还是在动力学 上都是有利的。 6

3.制备(preparation): 氟化学在现代无机化学中占有相当重要的 地位。这一领域的奠基人是法国化学家Heni Moissan(1852-1907),他 The Nobel Prize in Chemistry 1906 Henri motssao 利用电解法成功地制得了单质 The Nobel Prize in Chemistry 1906 氟以及发明了摩氏电炉,因此 荣获1906年Nobel化学奖。 Henri Moissan Prize share:1/1 The Nobel Prize in Chemistry 1906 was awarded to Henri Moissan "in recognition of the great services rendered by him in his investigation and isolation of the element fluorine,and for the adoption in the service of science of the electric furnace called after him
3. 制备(preparation): 氟化学在现代无机化学中占有相当重要的 地位。这一领域的奠基人是法国化学家Henri Moissan(1852-1907),他 利用电解法成功地制得了单质 氟以及发明了摩氏电炉,因此 荣获1906年Nobel化学奖。 7

发现史 -化学元素发现史上,持续时间最长(100多年), 参与化学家人数最多,危险最大! >1774年瑞典化学家舍勒(Scheele C.W,1742~1786,氯的发现者)以 硫酸分解萤石时发现放出一种与盐酸(HC)很相似的气体,溶于水中得 到的酸与盐酸类同; >1789年法国化学家拉瓦锡(Lavoisier,1743~1794)认为这种新的酸和 盐酸一样,其中含有氧,他提出当中是由一个未知的酸基和氧的化合物 >1812年:法国安培(A.J.Ampere,1775~1836)指出:氢氟酸中存在 着一种未知的化学元素,正如盐酸中含有氯元素的关系一样,并建议把 它命名为“Fluor'”,词源来自拉丁文及法文,原意为“流动(fIow, fluere)”之意; >1813年,英国化学家戴维(H.Day)使用他分离元素的杀手锏一 电池,对发烟氢氟酸进行电解,试图获取元素状态的氟。戴维的努力 不但以失败告终,由于当时未明白氟化合物对人体的伤害,他因严重 氟中毒被迫停止研究,法国的盖吕萨克等人亦因吸入过量氟化氢(HF) descnbed (1529) 而中毒,亦退出了氟的争夺舞台; >1836年两名苏格兰人,爱尔兰科学院院士乔治.诺克斯(George Knox) 及托马士.诺克斯(Thomas Knox)兄弟,以萤石制作了很精巧的器皿, 他们在其中放置了氟化汞,并在加热的状态下以氯气处理。托马士因 氟中毒而受重创,乔治被送往意大利休养近三年才逐渐康复; >比利时化学家鲁耶特(Louyet P.,1818~1850)不因诺克斯兄弟的受伤 而决心延续他们的实验,他虽然步步为营地进行实验,但因长期接受 8 氟毒,且中毒太深,最终为科学殉身,享年32岁
发 现 史 - 化学元素发现史上,持续时间最长(100多年), 参与化学家人数最多,危险最大! (1529) ¾ 1774年瑞典化学家舍勒(Scheele C.W., 1742~1786,氯的发现者)以 硫酸分解萤石时发现放出一种与盐酸(HCl)很相似的气体,溶于水中得 到的酸与盐酸类同; ¾1789年法国化学家拉瓦锡(Lavoisier, 1743~1794)认为这种新的酸和 盐酸一样,其中含有氧,他提出当中是由一个未知的酸基和氧的化合物; ¾1812年:法国安培(A.J. Ampere,1775~1836)指出:氢氟酸中存在 着一种未知的化学元素,正如盐酸中含有氯元素的关系一样,并建议把 它命名为“Fluor”,词源来自拉丁文及法文, 原意为“流动 (flow, fluere)”之意; ¾ 1813年,英国化学家戴维(H. Davy)使用他分离元素的杀手锏-- 电池, 对发烟氢氟酸进行电解, 试图获取元素状态的氟。戴维的努力 不但以失败告终, 由于当时未明白氟化合物对人体的伤害, 他因严重 氟中毒被迫停止研究, 法国的盖. 吕萨克等人亦因吸入过量氟化氢(HF) 而中毒, 亦退出了氟的争夺舞台; ¾1836年两名苏格兰人, 爱尔兰科学院院士乔治.诺克斯(George Knox) 及托马士.诺克斯(Thomas Knox)兄弟, 以萤石制作了很精巧的器皿, 他们在其中放置了氟化汞, 并在加热的状态下以氯气处理。托马士因 氟中毒而受重创, 乔治被送往意大利休养近三年才逐渐康复; ¾比利时化学家鲁耶特(Louyet P., 1818~1850)不因诺克斯兄弟的受伤 而决心延续他们的实验, 他虽然步步为营地进行实验, 但因长期接受 氟毒, 且中毒太深, 最终为科学殉身, 享年32岁。 8

发现史 -化学元素发现史上,持续时间最长(100多年), 参与化学家人数最多,危险最大! >1850年法国自然博物馆馆长兼化学教授的弗累密(Fremy,E.,1814~1894)以电流 分解氟化钙(CaF2)、氟化银(AgF)及氟化钾(KF),阴极分别产生了金属钙、金属银及金 属钾,最引人注目的阳极似有气体放出,但因电解温度太高,当它出现时立即和周围的 物质(如电极及器皿等物件)化合,形成稳定的化合物,而且使电极绝缘,阻碍了电解的 进行,最终无法进行阳极物质的收集。之后他电解无水氟化氢,但未获得成功,后来他 证明类似诺克斯兄弟以氯处理氟化物的方法,由于实验条件的影响,结果只能得到氟化 氧(OF2),而不是氟。 >1869年英国化学家哥尔博士(Dr.Geroge Gore,1826~1908)电解氟化氢,可能曾产 生少量氟气,但和阴极产生的氢作用而发生爆炸,为了改善电极的性能,他曾选用碳、 铂、钯和金等,但最终仍被阳极释出的物质腐蚀,他在实验报告中提出:必须降低电解 的温度,以减弱氟元素的活泼性,分离始有成功之机。 >1886年弗累密的学生莫瓦桑(Moissan,H.,1852~1907)总结 其恩师弗累密电解氟化氢的失败经验,他采用液态氟化氢(HF,熔点 83C)作电解质,在这种不导电的物质中加入氟氢化钾(KHF2),使它 成为导电体。实验进行时,电解槽温度将降至-23°C。6月26日那天 开始进行实验,阳极放出了气体,他把气流通过硅时顿燃起耀眼的火 光,根据他的报告:被富集的气体呈黄绿色,氟元素终于被成功分离 了。 In 1906,two months before his death,Moissan received the Nobel Prize in chemistry for his fluorine isolation as well as the invention of the electric arc furnace(fluorine poisoning?)
发 现 史 - 化学元素发现史上,持续时间最长(100多年), 参与化学家人数最多,危险最大! ¾ 1850年法国自然博物馆馆长兼化学教授的弗累密(Fremy, E., 1814 ~ 1894)以电流 分解氟化钙(CaF2)、氟化银(AgF)及氟化钾(KF), 阴极分别产生了金属钙、金属银及金 属钾,最引人注目的阳极似有气体放出, 但因电解温度太高, 当它出现时立即和周围的 物质(如电极及器皿等物件)化合,形成稳定的化合物, 而且使电极绝缘, 阻碍了电解的 进行, 最终无法进行阳极物质的收集。之后他电解无水氟化氢,但未获得成功, 后来他 证明类似诺克斯兄弟以氯处理氟化物的方法, 由于实验条件的影响, 结果只能得到氟化 氧(OF2), 而不是氟。 ¾ 1869年英国化学家哥尔博士(Dr. Geroge Gore, 1826~1908)电解氟化氢, 可能曾产 生少量氟气, 但和阴极产生的氢作用而发生爆炸, 为了改善电极的性能, 他曾选用碳、 铂、钯和金等, 但最终仍被阳极释出的物质腐蚀,他在实验报告中提出:必须降低电解 的温度,以减弱氟元素的活泼性, 分离始有成功之机。 ¾ 1886年弗累密的学生莫瓦桑(Moissan, H., 1852 ~ 1907)总结 其恩师弗累密电解氟化氢的失败经验, 他采用液态氟化氢(HF, 熔点 -83oC)作电解质, 在这种不导电的物质中加入氟氢化钾(KHF2), 使它 成为导电体。实验进行时, 电解槽温度将降至-23°C。6月26日那天 开始进行实验, 阳极放出了气体, 他把气流通过硅时顿燃起耀眼的火 光, 根据他的报告: 被富集的气体呈黄绿色, 氟元素终于被成功分离 了。 In 1906, two months before his death, Moissan received the Nobel Prize in chemistry for his fluorine isolation as well as the invention of the electric arc furnace (fluorine poisoning?) 9

Fluorine 4.0 Tiger of Chemistry ELSEVIER Type here to search on Elsevier.com p Advanced Product Seare Books joumals Online tools Authors,editors reviewers About Elsevier Journal of Fluorine Chemistry The Joumal of Fluorine Chemistry contains original papers and shart communicetions describing both pure and applied research on the chemistry and applications of fluorine,and of compounds where fluorine. View full aims and soope Impact Factor: Journal News Most Downloade 1.719 Articles Organofluorine chemistry From Wikipedia,the free encyclopedia Organofluorine chemistry describes the chemistry of organofluorine compounds.organic compounds that contain the carbon-fluorine bond.Organofluorine compounds find diverse applications ranging from oil-and water-repellents to pharmaceuticals,refrigerants and reagents in catalysis.In addition to these applications,some organofluorine compounds are pollutants because of contributions to ozone depletion.global warming.bioaccumulation.and toxicity. The area of organofluorine chemistry often requires special techniques associated with the handling of fluorinating agents
10