
7。芳香烃 Aromatic hydrocarbons
7。芳香烃 Aromatic hydrocarbons

本章内容 7.1苯的结构 7.2芳香烃的分类和命名 7.3物理性质(自学) 7.4苯及其同系物的化学性质 7.5苯环上取代基的定位效应及规律 7.6定位效应在有机合成中的应用 7.7稠环芳烃
7.1 苯的结构 7.2 芳香烃的分类和命名 7.3 物理性质(自学) 7.4 苯及其同系物的化学性质 7.5 苯环上取代基的定位效应及规律 7.6 定位效应在有机合成中的应用 7.7 稠环芳烃 本章内容

苯型芳香烃 芳香烃 非苯型芳香烃 芳香烃:含有苯环(包括苯和苯的衍生物)或者结构和苯不 同,但性质与苯相似的一大类非苯芳香族化合物。 苯是最简单又最重要的芳烃,所以从苯开始学起
芳香烃:含有苯环(包括苯和苯的衍生物)或者结构和苯不 同,但性质与苯相似的一大类非苯芳香族化合物。 苯是最简单又最重要的芳烃,所以从苯开始学起。 芳香烃 苯型芳香烃 非苯型芳香烃 O .

71苯的结构 l.Kekule式 19世纪初,人们发现了这种物质; 1825年,法拉第Michael Faraday1791-1867)测定苯的 经验式为CH; 1833年,Eilhard Mitscherlich(1794-1863)确立苯的分子 式为C6H6 此后,人们对苯的物理性质和化学性质有较充分的认识 易取代,不易加成 实验事实 一取代产物只有一种 邻二取代产物只有一种
1. Kekule式 19世纪初, 人们发现了这种物质; 1825年, 法拉第(Michael Faraday1791-1867 )测定苯的 经验式为CH; 1833年, Eilhard Mitscherlich (1794-1863) 确立苯的分子 式为C6H6; 此后, 人们对苯的物理性质和化学性质有较充分的认识 7.1 苯的结构 实验事实 易取代, 不易加成 一取代产物只有一种 邻二取代产物只有一种

疑问:1.根据分子式,苯应是一个高度不饱和的烃,应表现出 不饱和烃的典型反应,易加成,而实验事实刚好相反; 2.一取代产物只有一种,说明6个H等同 1865年,Kekule首先提出苯的结构是C-C链首尾相连的环状 结构,环中三个单键、三个双键相间,每个碳和一个氢相连 简写为: 这种结构6个H等同,一取代产物只有一种;
疑问: 1. 根据分子式,苯应是一个高度不饱和的烃,应表现出 不饱和烃的典型反应,易加成,而实验事实刚好相反; 2. 一取代产物只有一种, 说明6个H等同 1865年, Kekule 首先提出苯的结构是C-C链首尾相连的环状 结构,环中三个单键、三个双键相间, 每个碳和一个氢相连 这种结构6个H等同,一取代产物只有一种; H H H H H H 简写为:
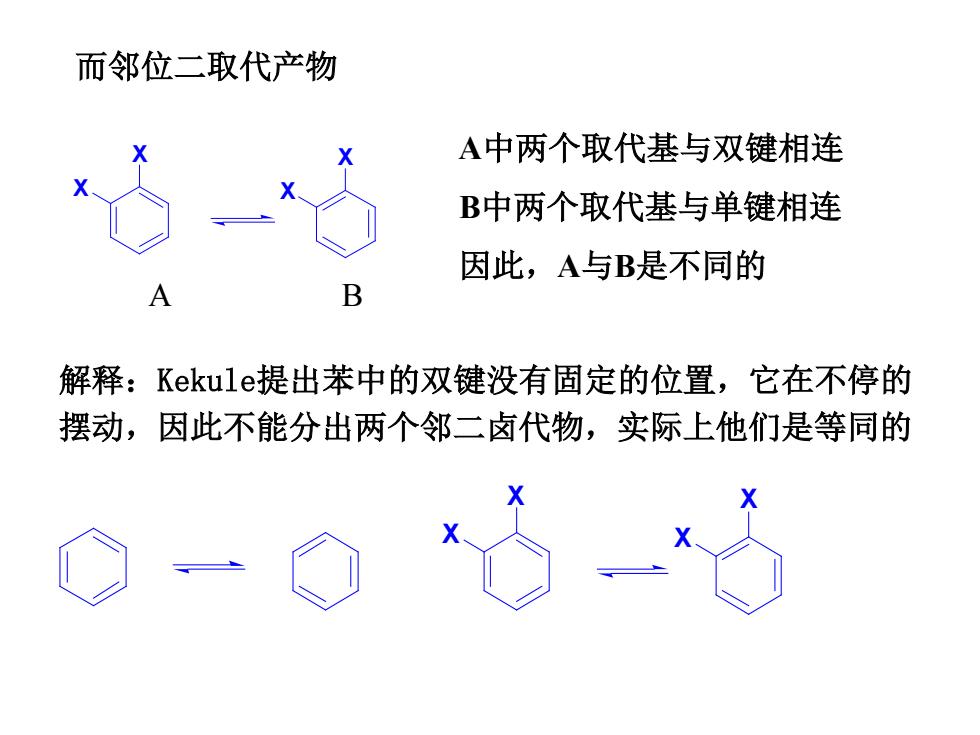
而邻位二取代产物 A中两个取代基与双键相连 B中两个取代基与单键相连 因此,A与B是不同的 B 解释:Kekule?提出苯中的双键没有固定的位置,它在不停的 摆动,因此不能分出两个邻二卤代物,实际上他们是等同的
而邻位二取代产物 A中两个取代基与双键相连 B中两个取代基与单键相连 因此,A与B是不同的 A B 解释:Kekule提出苯中的双键没有固定的位置,它在不停的 摆动,因此不能分出两个邻二卤代物,实际上他们是等同的 X X X X X X X X
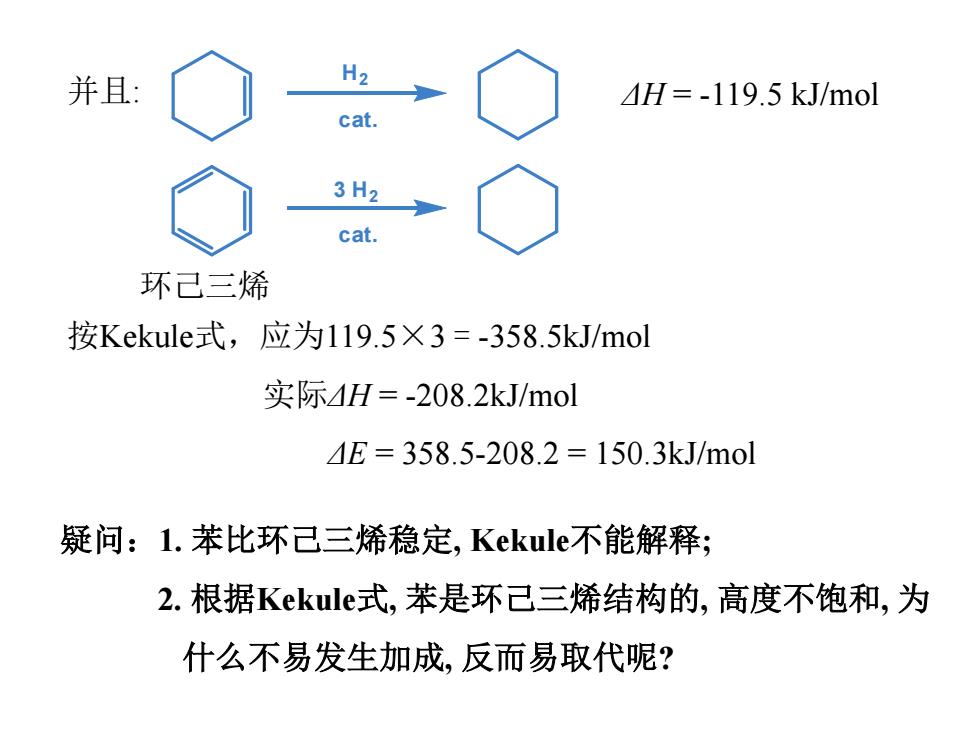
并且: H2 H=-119.5 kJ/mol cat. 3H2 cat. 环己三烯 按Kekule式,应为119.5×3=-358.5kJ/mol 实际4H=-208.2kJ/mol 4E=358.5-208.2=150.3kJ/mol 疑问:1.苯比环己三烯稳定,Kekule不能解释; 2.根据Kekule式,苯是环己三烯结构的,高度不饱和,为 什么不易发生加成,反而易取代呢?
并且: 按Kekule式,应为119.5×3 = -358.5kJ/mol 实际ΔH = -208.2kJ/mol ΔE = 358.5-208.2 = 150.3kJ/mol 疑问:1. 苯比环己三烯稳定, Kekule不能解释; 2. 根据Kekule式, 苯是环己三烯结构的, 高度不饱和, 为 什么不易发生加成, 反而易取代呢? cat. H2 3 H2 cat. ΔH = -119.5 kJ/mol 环己三烯
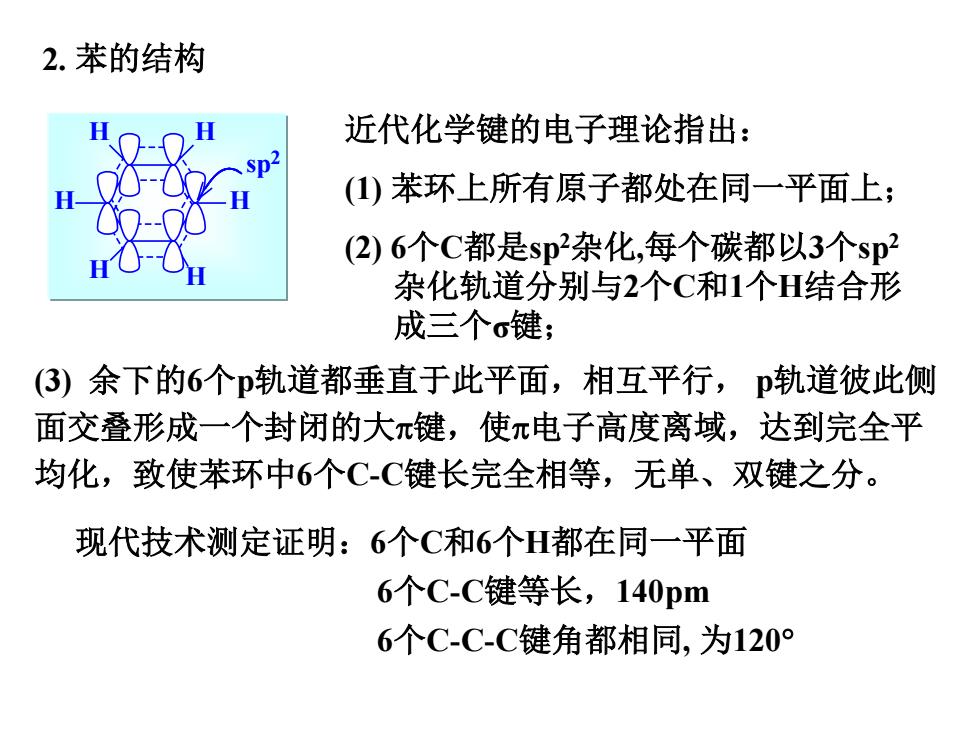
2.苯的结构 近代化学键的电子理论指出: ()苯环上所有原子都处在同一平面上; (2)6个C都是sp杂化,每个碳都以3个sp2 杂化轨道分别与2个C和1个H结合形 成三个σ键; (3)余下的6个p轨道都垂直于此平面,相互平行,p轨道彼此侧 面交叠形成一个封闭的大π键,使π电子高度离域,达到完全平 均化,致使苯环中6个C-C键长完全相等,无单、双键之分。 现代技术测定证明:6个C和6个H都在同一平面 6个C-C键等长,140pm 6个C-C-C键角都相同,为120°
2. 苯的结构 sp2 H H H H H H 近代化学键的电子理论指出: (1) 苯环上所有原子都处在同一平面上; (2) 6个C都是sp2杂化,每个碳都以3个sp2 杂化轨道分别与2个C和1个H结合形 成三个σ键; 现代技术测定证明:6个C和6个H都在同一平面 6个C-C键等长,140pm 6个C-C-C键角都相同, 为120° (3) 余下的6个p轨道都垂直于此平面,相互平行, p轨道彼此侧 面交叠形成一个封闭的大π键,使π电子高度离域,达到完全平 均化,致使苯环中6个C-C键长完全相等,无单、双键之分

根据分子轨道理论:苯分子中6个C的2pz轨道组成6个π分子轨道 能级图: 三个节面 餐要 二个节面(简并轨道) 一个节面(简并轨道:能 量相同的轨道) 无节面
根据分子轨道理论: 苯分子中6个C的2pz轨道组成6个π分子轨道 能级图: 无节面 一个节面(简并轨道:能 量相同的轨道) 二个节面(简并轨道) 三个节面 E

解释: 1.氢化热低:苯分子中形成一个闭合的大π键,π电子云高 度离域,体系能量降低而稳定。 2.易取代,不易加成:因为加成反应会破坏大π键,使稳定 的苯转变为不稳定的1,3-环己二烯,故难进行;π电子云利于 亲电试剂的进攻,取代反应不会破坏大π键而易进行
解释: 1. 氢化热低:苯分子中形成一个闭合的大π键, π电子云高 度离域,体系能量降低而稳定。 2. 易取代,不易加成:因为加成反应会破坏大π键,使稳定 的苯转变为不稳定的1,3-环己二烯,故难进行;π电子云利于 亲电试剂的进攻,取代反应不会破坏大π键而易进行