
普通高等教育“十五”国家级规划教材 十*五 基础有机化学 (第三版)下册 邢其毅裴伟伟 徐瑞秋裴坚 AcO O OH NH 日 OH 高等教育出版社 Higher Education Press

目 录 第14章羧酸衍生物酰基碳上的亲 14.15.2脂肪酸和胎肪醇的来源.+.638 核取代反应. .599 14.15.3油指硬化,于性油.639 14.】羧酸衍生物的站构 *599 14.15.4肥皂和合成洗涤剂.640 14.2酸酸生物的物理性质 4+.600 14.15.5稀脂和生物膜(细胞膜 .64 羧酸衍生物的反应 ,602 14.16城 n642 14.3酰基碳上的亲核取代反应.602 14.17碳酸的衍生物 14.3.1酰基上来核取代反应的概述 +602 14.17.1 光气 .643 酸衍生物的水解 形成 14.17.2尿素(脲)*.*.*. ,643 14.3.2 复习本章的指导提纲. .648 酸酸. *604 14.3.3骏酸衍生物的醇解 一形成酯·609 英汉对照洞汇.648 14.34骏酸衍生物的氨(胶)解 一形成 第15章碳负离子 缩合反应 .+.650 酰胺 612 15.】氧碳酸的概金和a氧的酸性.650 14.4羧酸材生物与有机金属化合物的 15.1.1 。氢的酸性 +,650 反点t。+,+4+ 615 15.1.2架基化合物a氢的活性分析 .65 14.5羧酸生物的还原 .。617 15.2的式和烯醇式的互变异构. 654 14.5. 用能化氧化法还原 617 15.2】酮式和烯醇式的存在. 14.5.2用金属氢化物还原 618 15.2.z 醇化的反成机理 656 14.5.3酯用金属钠还原 620 15.2.3烯醇负离子的两位反应性能*·657 14.6酰卤的。南代 .623 15.2.4不对称明的烯醇化反应. 658 14.7 酰亚胺的酸性 缩合反应 660 14.8烯酮的反应 】5.3缩合反应简述. 660 14.9 Reformatsky反应 627 15,4醛编合反应.+.661 14.10酯的热裂. 628 15.41羟能缩合反应的机理 661 14.10.1 酯的热裂· 15.4.2羟醛缩合反应的分类 662 14.10.2黄原酸前的热裂. 630 15.5胺甲基化反应. 669 粉酸行生物的制各. 631 15.6 Robinse0n增反应. .672 酰卤的制备 631 15.7 酯缩合反应 675 14.12酸酐和烯朝的制备. 632 15.7,1南缩合反应 675 14.12.1酸研的制备+ 632 15,7,2混合酯缩合反应**+。677 14.12.2烯的制备. 633 15.7.3分子内的脂缩合反痘.679 14.13酯的制备 15.7.4解与商的编合反应 681 14.14酰胺和睛的制备. 6535 15.8碳负离子的经基化,酰基化反应.68 油脂蜡碳酸的衍生物 636 15.8.1的烃基化,酰基化反应 683 14.15 油脂 酮的烃抹化酰基化反应 14.15.1胎防酸.637 15.8.3醛的烃基化反应 690

录 15.8.4日-W某化合物的经某化 17.13含氨化合物的还原. 774 酷基化反应 .690 17.14茶、酮的还原()化.776 15.9日-二基化合物在有机合成中 17.15 从骏酸及其衍生物制脑 778 的应用4.tt.695 复习本章的指导提钢.783 15.10 Perkin反a. ,699 英汉对照词汇+.++.784 15.1 I Knoevenagel反应 700 第18章 含氨芳香化合物 芳香亲核 15.12 Darzen反应+ 702 取代反应.785 15.13安息香缩合反应. .704 (一)芳香硝基化合物. 复习本辛的指导提钢.709 .78写 18.1芳香硝基化合物的结构 4.+4785 71 18.2芳香硝基化合物的物理性质.785 第16章周环反应 712 18.3芳香硝基化合物的重要化学性质.78 16.1 周环反应和分子轨道对称守恒 18.3.1还原反应. .786 原理 712 18.3.2芳香亲核取代反应(1)Sw2Ar 16.2前线轨道理论 .713 16.2.】前线轨道理论的藏念和中心 18.4芳香萌基化合物的制备和用 792 思想 713 (二)芳香胺. 16.2.2电环化反应 *714 18.5芳香胺的氧化 793 16.2.3环加成反应 .720 18.6 芳香胺芳环上的亲电取代反应 .794 16.2.4迁移反 73】 18.了联莱胺重持 4.797 16.3能量相关理论 739 18.8重意化反克 44+4.799 16.4芙香过滩态理论 。741 18.9重氯盐芳环上的取代反应 800 复习本章的指导提纲 746 18.g.1 Sandmeyer反应和Gattermann 英汉对照词江 746 反应芳香自由基取代反应 第17章胺. 7A8 800 17.1 候的分类 7A 18.9.2 重盐的水解芳香亲核取代反应 17.2的结构 749 (1)Sw1Ar机理 *.802 17,3胺的物理性质 750 18.9.3 Schiemann反应Sw1Ar机理*·803 胺的反应 752 18.94芳香化合物的芳基化芳香自由 17.4胺的成盐反应 四纵续盐的应用·752 基取代反风(Ⅱ 80 17,4.1肢的碱性 752 18.10重氯盐的还原. .807 17.42胺与酸的成盐反应 18.11重氨盐的偶联反应 809 17.4.3四级铵盐及其相转移儒化作用.756 (三)苯炔 813 17.5四级候域和H0mannǐ伶反应,758 18.12装块的结构, .813 l7.6胺的酰化Hinsberg反应 763 1813块的制.814 17.7 胺的氧化和COpe消除 76 18.14 的反应 815 17.8胺与亚硝酸的反应 766 18.15芳香亲核取代反应(Ⅲ)莱块中间 17.9重氧甲坑 768 依机理。: 胺的制备 771 复习表章的指导提纲 R22 17.10氧或按的坑基化 771 英汉对照汇 823 17.11 Gabriel合成法 772 第19章酚和醒 824 17.12 用醇制备. (一)酚 824

Ⅲ 19.1酚的结构 824 20.2.1态环屉核的角名,。872 19.2酚的物理性质.825 20.2.2杂环母核的编号 +44873 酚及其衍生物的反应. 827 杂环化合物的结构和性质.875 19.3酸性+, 82 20.3呋喃、塞纷、此咯的结构和物理 19.4 成醚反应和Claisen重排 83d 性质 815 19.5 成酯反应和Fries重排 20.3.1结构 19.6酚芳环上的一般亲电取代反应 835 之0.32物性质876 19.6.1卤化· 83 20.4失,塞呀、咯的反应 87 19.6,2 83 20.4.1质子化反应 877 19.5.3销化* 837 20.4.2芳香亲电数代反成 878 196.4亚消其化,. 839 20.4.3加成反应 .,883 19.6.5 Friedel-Crafts反应 .840 20.5 吡啶的结构和物理性质 l9.7 Reimer-Tiemann反应 20.6此啶的反空 889 19.8 Kolbe-Schmitt反应, 843 20.6.1芳香亲电取代反应 889 19.9芳香醚的Birch还原 845 206.2 芳香亲核取代反应 892 19.10 苯酚与甲醛的缩合 酚 20.6.3氧化反应4*4 894 树脂 444.846 20.6.4还原反刷 R05 19.11三氟化铁试验.849 20.6.5侧链。-H的反应 895 19.12 Bucherer反应 849 20.7吡咬N-氧化物的反应 896 19.13 二酚和间苯三酚的特 20.8陛的结构和物理性质. 899 反应· 850 20.9坐的反应 900 龄的制备 852 20.9.1碱性. 900 19.14 元酚的制备 852 20.9.2芳香亲电取代反应+. 901 19.15多元酚的制备 855 20.10二嗪的反应 《二)碑 857 20.10.1氯上的质子化和烷基化反应. 90g 19.16的结构 857 20.10.2若弄亲电取代反应 906 对苯醌及其行生物的反应 859 20.10,3芳香亲核取代反应. 907 19.17 加成反应 20.10.4氧化 19.17,1熊基的亲核加成 859 20.10.5侧销g-1H的反应: 908 19.17,2与碳碳双续的亲电加成 96 20.1】五元杂环并体系的芳香亲电 19.17.3对苯醒的1,4 加成反应 取代反应 914 19.17.4 与双烯体的环加成反由 863 20.12六元杂环幕并体系的反应.914 19.18对荒醒的还盾, 864 20.12.1碱性 。g14 19.19的取代反应 866 20.12.2 氧化反应 914 醌的制备. 866 20.12.3芳香亲电收代反应+.4 915 19.20理的制冬. R66 20.12,4芳香亲核取代反应.916 复习本章的指子提铜 869 20.12.5侧徒。-H反应 917 英汉对江 870 20.12.6还原 918 第20章杂环化合物 871 杂环化合物的制备 918 20.1 杂环化合物的分 20.13 20.2 杂环化合物的命名 .4872 20.14吡定环系的合成.920

W 录 20.151.2-唑和1,3-唑环系的合成,922 21.18淀粉和糖原. ,067 2016二嗪环系的合成923 21.19葡聚格 ·969 20.17 引噪环系的合成 92 21.20 糖类的代谢举 4*970 20.18喹啉和异唾啉环系的合成. 927 复习本章的描导提铜 .g75 20.19蝶岭和噪岭环系的合或. .929 英汉对照调汇, .976 复习本章的指导提铜 93 第22章 氨基酸多肽蛋白质 英议对词汇 933 臨和核酸 4978 第21章单糖、寡糖和多糖 935 (一)氨港酸 *978 (一)单糖 935 22.1急基酸的结构、名称及其物理 21.1单糖的站构和命名 ,935 性盾 4978 21.11单精的分类,链式结构和命名.935 氨基酸的反应. 4.4.979 21.1.2 能萄的变旋现象,某些性质及 22.2意基酸的性质 环形结构 ,937 9 22.2.】酸碱性和等电点 981 单辅的反应,. 22.2.2 与茚三酮反应 98 21.2 赫的递增反应 94 22.2.3形成氨基酸金国盐。 *984 21.3糖的递降反应 ,942 氨基酸的制备 985 21.3.1Woh降 4.942 22.3 氯基酸的合成 98 21.3.2Ruf递降 22.3.15 trecker法 985 21.4单糖的差向构化.944 22.3.2 Hell-Volhard-Zelinski 21.5形成楼群. 44 澳化法 985 21.6单糖的氧化. 946 22.3.3 Gabriel法. 21.6.I用Fehling试剂、Tollens试剂和 22.3.4丙二酸附法 ++986 Benedict试剂氧化 946 (一)多肚 988 21.6.2用0水氧化 一形成酸 .946 22.4 多肤的命名和结构 988 21.63 电解氧化 946 22.5多胜合成: +990 21.6.4用硝酸氧化. 947 22.5.1氢基的保护 21.6.5用高映酸氧化 948 25.2 激基的保打 21.7单的还原 99 948 22.5.3侧链的保护.*. 992 21.8 形成苷 94 22.5.4接肽的方法 903 葡萄糖结构的测定· 950 22.6多肽结构的测定 997 21.9 箭简糖碳架的测定 950 (三)蛋白质 1001 21.10 葡葡糖立体结枸的测定 951 22,7蛋白质的分子形状. +4.1001 21.11葡萄城环形结地的测宝 953 (四)酶 1004 21.12葡菊糖的构享分析. 054 22.8酵的命名、分类和组成 1004 21.13 些重要的单糖 955 22.9酶的催化功能. .1008 22.91酶催化的专一性和的活性 21.14双楼. 960 中心 1008 21.15 棉子 963 22.9.2在酶健化下的蛋白质分解及 21.16环状柳持 963 氨基酸代谢. .1010 (三)多糖. 965 (五)核酸 *.1014 21.17 纤维素和半纤雄素 965 22.10核酸的组成和结构

22.11DNA的合成和遵传的关系.1020 复习本章的指导提, .4441090 22.12RNA与蛋白质的生物合成.1020 英汉对照词汇 .1090 复习本章的指导提纲.1022 第25章新型有机合成方法 .1091 英汉对照词汇 .102 25.1 Heck反应 .1091 第23章萜类化合物、甾族化合物和 25.2 Bergman环化反应 1094 生物 1025 25.3 Myers-Saito环化反应. 1096 (一)苍类化合物 .1025 25.4 McMurry反应.1097 23.1花类化合物的生物合成: .1025 25.5 Sharpless环氧化反应、双羟基化 23.2 萜类化合物的结构组成和分美 1028 反应和不对称氢整基化反应.1100 23.3花类化合物的实例. 102g 25.5.1 Sharpless环氧化反应 .4.1100 23.3.】单背**.+ 1029 25.5.2 Sharpless烯烃不对称双羟基化 23.3.2半 1033 反应4.110】 23,3.3双新,三和四. 25.5.3 Sharpless烯烃不对称氨羟基化 (二)留族化合物 1035 反应 1102 23.4 酒族化合物的基本骨架和构 25.6 Suzuki-Miyaura反应 1103 1105 象式. 1035 25.7Son0 gashira反应*. 23.5镯族化合物的实例. 1036 25.8 Takai反应.1107 2351胆周醇。 .1036 25.9 Corey-Bakshi-Shibata反应或 23.5.2麦角固醇及维生素 1038 Corey-Bakshi-Shibata体系.1108 23.5.3淄族性藏素.*.1039 25.10烯经分解反克.】109 23.5.4其它具有生理作用的笛族 25.11组合化学 .111 化合物 1040 25.11.1组合化学4.4.1111 (三)生物碱 .1042 25.11.2组合化学研究的核心思想和基本 23.6生折藏的溢义,来源及结构测定1042 原理 112 23.7生物的命名,分类及简介 .101 25.11.3组合化学技术.1113 23.7.1苯乙胺体系生物碱. .1044 25.1山.4组合化学的应用.1113 23.7.2四氢世略及入氢吡啶环系 25.1.5组合化学的发展与展望.1114 生物碱: 1044 第26章有机材料、合成高分子和超 23.7.31跌环系生物碱. 104 分子 116 23.7.4座琳、异咋琳环系生物碱.1049 26.1有机共轭材料*. .1116 23.7.5环系生物碱. 。1052 26.1.】导电岛分子材料.1116 复习本章的指提 1055 26.1.2有机电致发光二极管 1120 英汉对照词汇.*+.1055 26.1.3有机太阳能电池. 112 第24音有机合成基础 .1057 26.1.4基于共轭聚合物的化学传 24.1 有机合成的要求和驱动力 2器44446,1129 24.1.1有机合成的要求*·1058 26.2 超分子体 .1131 24.1,2有机合成的驱动力.1058 第27章期刊、文献和网络检索.1134 24.2有机合成设计的基本版念 .1062 27.1期刊.113列 24.3逆合成分析的基本思路和实 27.1.1原始性搠刊. .113 分析44,4 tt年1068 27.1.2综述性期刊. .1137 24.4 天然产物全合成实例简介.1084 27.1.3新闻动态期刊 .】137

27.2 书 +41137 一科学引文素引网络饭Web of 27.2.1 百科全书与大型参考书 ,1137 11A 27.2.2从书 +.4+1138 27.5.3专利网站. 1145 27.2.3教科书,专若,字典与手册 .1139 27.5.4 Beilstein Crossfire和CA网络版 27.3 Beilstein有机化学大全 1139 (SciFinder Scholar)1147 27.4文摘索引期刊 1140 推荐参考书目· 1163 27.5网络拉素* 1141 索引 .1164 2.5.1期刊. 1141 27.5.2 scI(s ience Citation Index1995
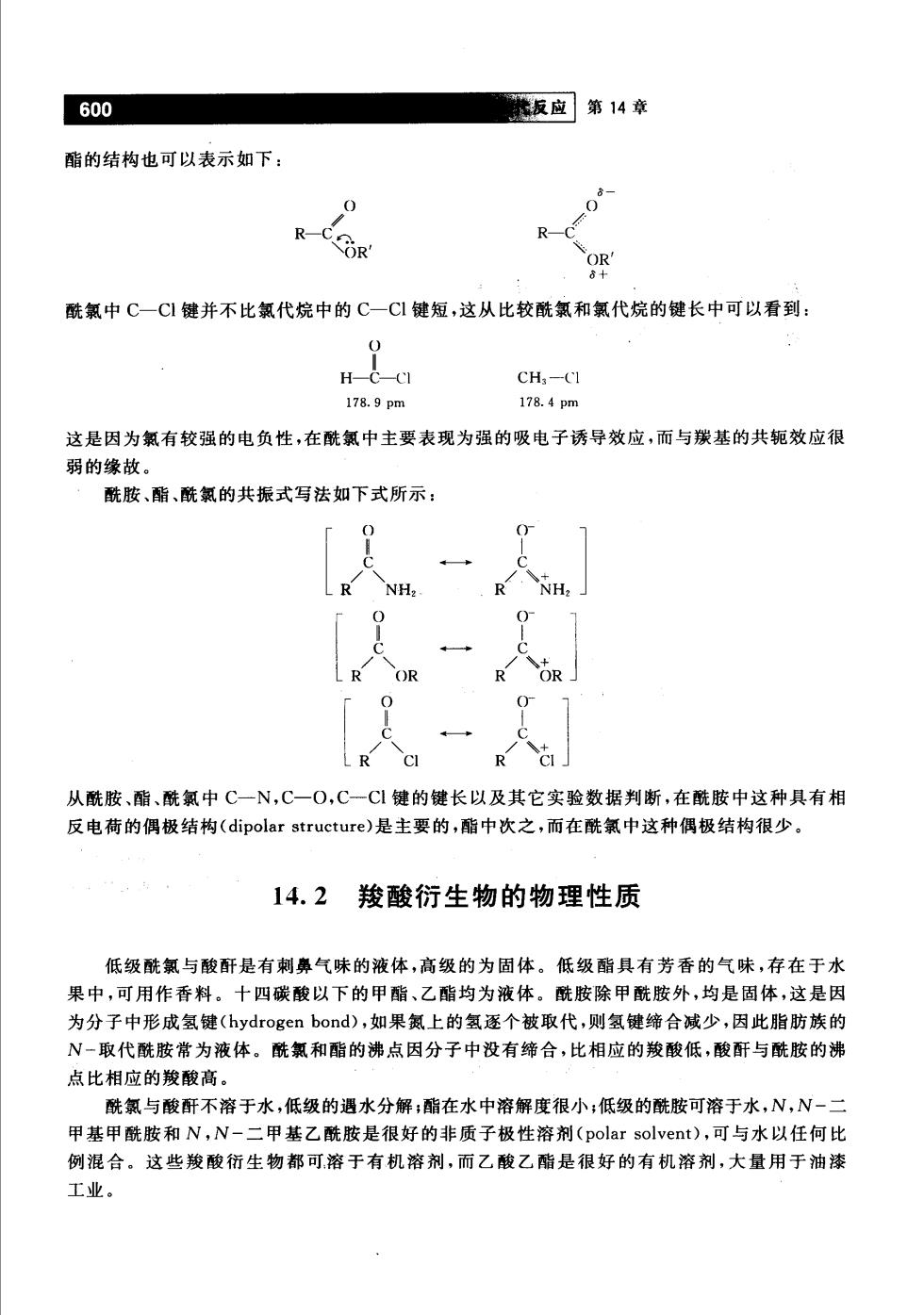
600 板应第14章 酯的结构也可以表示如下: 0 0 R-COR R 酰氯中C一C1键并不比氯代烷中的C一CI键短,这从比较酰氯和氯代烷的键长中可以看到: H-C-CI CH,-CI 178.9pm 178.4pm 这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很 弱的缘故。 酰胺、酯、酰氯的共振式写法如下式所示: R 从酰胺、酯、酰氯中C一N,C一O,C一C1键的键长以及其它实验数据判断,在酰胺中这种具有相 反电荷的偶极结构(dipolar structure).是主要的,酯中次之,而在酰氯中这种偶极结构很少。 14.2羧酸衍生物的物理性质 低级酰氯与酸酐是有刺鼻气味的液体,高级的为固体。低级酯具有芳香的气味,存在于水 果中,可用作香料。十四碳酸以下的甲酯、乙酯均为液体。酰胺除甲酰胺外,均是固体,这是因 为分子中形成氢键(hydrogen bond),如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的 N一取代酰胺常为液体。酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸 点比相应的羧酸高。 酰氯与酸酐不溶于水,低级的遇水分解:酯在水中溶解度很小:低级的酰胺可溶于水,N,N-二 甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子极性溶剂(polar solvent),可与水以任何比 例混合。这些羧酸衍生物都可溶于有机溶剂,而乙酸乙酯是很好的有机溶剂,大量用于油漆 工业
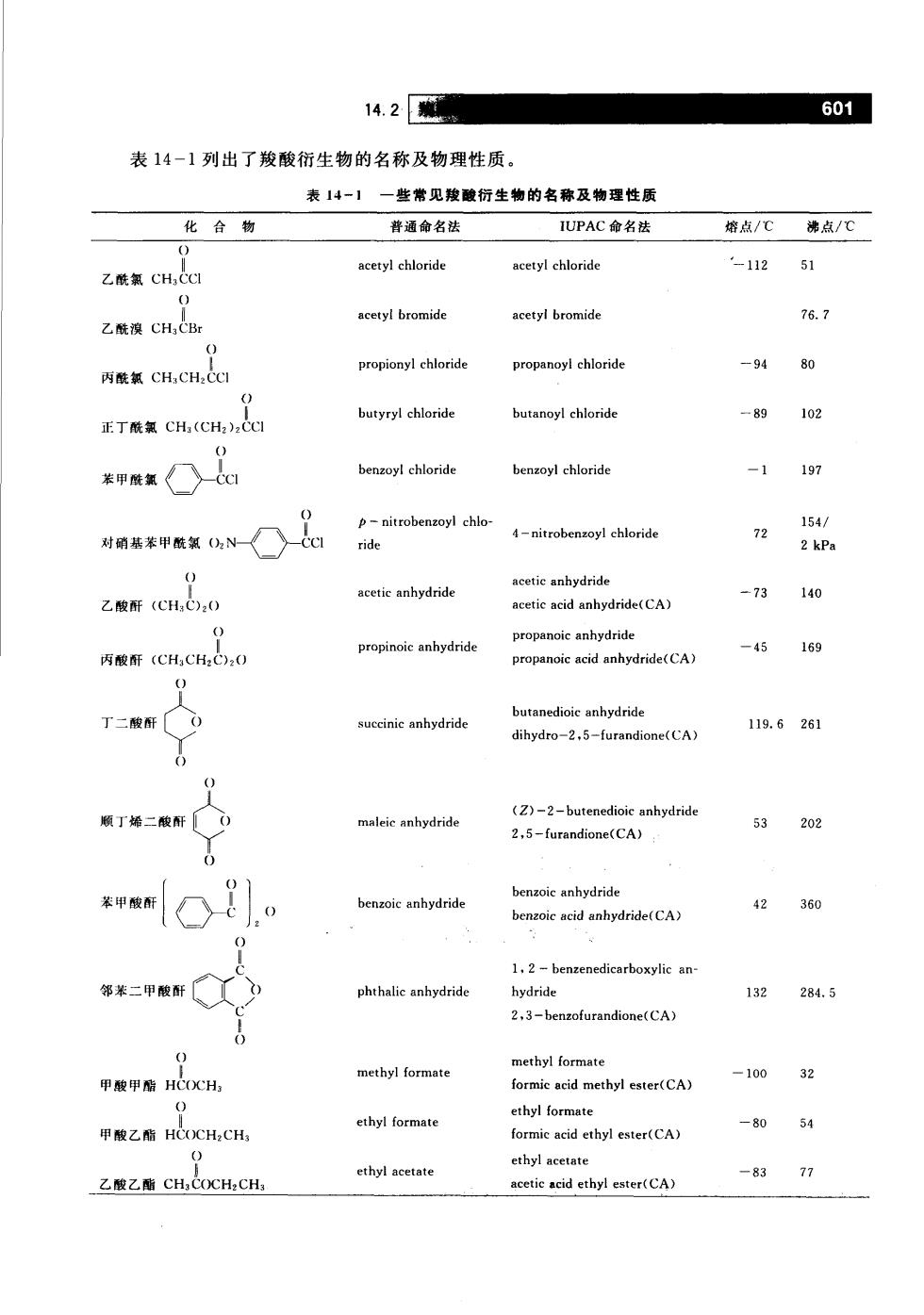
14.20 601 表14-1列出了羧酸衍生物的名称及物理性质。 表14-】一些常见羧酸衍生物的名称及物理性质 化合物 普通命名法 IUPAC命名法 增点/℃沸点/C 乙酰氧CH,CCI -112 乙酰澳CH,CBr acetyl bromide acetyl bromide 76.7 propanoy chloride -94 80 丙酰氯CH,CH:CCI butyryl chloride butanoyl chloride 正T酰氯CH,(CH2,C -89102 benzoyl chloride benzoyl chloride -1197 4-nitrobenzoyl chloride 72 154/ 2 kPa acetic anhydride 乙酸酐(CH,C,0 acetic anhydride acetic acid anhydride(CA) -73140 propanoic anhydride propinoic anhydride -45 丙酸酐(CH,CH,C:0 propanoic acid anhydride(CA) 169 0 butanedioic anhydride 丁二酸( succinic anhydride 119.6261 dihydro-2,5-furandione(CA) 0 额丁烯二酸酐〔 (Z-2-butenedioic anhydride 53 202 2,5-furandione(CA 0 benzoic anhydride benzoic anhydride benzoic acid anhydride(CA) 42360 1,2-benzenedicarboxylic an- 邻苯二甲酸酐 phthalic anhydride hydride 132284.5 2,3-benzofurandione(CA) 甲酸甲酯HCOCH, methyl formate methyl formate formic acid methyl ester(CA) -10032 ethyl formate -8054 cthyl acetate 乙酸乙酯CH,CCH,CH ethyl acetate acetie acid ethyl ester(CA) -8377

602 反应第14章 续表 化合物 普通命名法 IUPAC命名法 熔点/℃佛点/℃ amyl acetate pentyl acctate cetcdpentyl esteCA) -78142 乙酸戊酯CH,CO(CH),CH 米甲ZOa ethyl benzoate ethyl benzoate benzoic acid ethyl ester(CA) -34213 CH, 甲基丙烯酸甲酯CH:=CCOXOXCH, methyl methacrylate mebe) 100 甲酰胺HCNHz formamide formamide 2.5200分解 乙酰胺CH,CNH: acetamide 81 2 丙酰腋CH,CH,CNH, propionamide propanamide 79 213 N,N-dimethyl for- N,N-二甲基甲酰胺HCN(CH N.N-dimethyl formamide 153 苯甲阮酸dNH benzamide benzamide 130290 乙腈CH,CN acetonitrile acetonitrile 苯甲骑☐一N benzonitrile benzonitrile -10 70 羧酸衍生物的反应 羧酸衍生物的反应有很多共同之处,其反应机理也大致相同,只是在反应活性上有所差别, 下面首先讨论一些共有的性质,然后分别讨论各自独特的反应。关于酯缩合的内容参见15.7。 14.3酰基碳上的亲核取代反应 4.3.1酰基碳上亲核取代反应的概述 羧酸衍生物的亲核取代反应可表达如下: RC-W十:Nu化别R-C-Nu+W: 反应的结果是酰基碳上的一个基团被亲核试剂所取代,因此这类反应称之为酰基碳(acyl