
21世纪化学规划教材 基础课系列 基础有机化学 (第4版)习题解析 裴伟伟裴坚编著 赛北系太等出版社

前 言 本书是与邢其毅、裴伟伟、徐瑞秋、裴坚等编芳的《基础有机化学(第!版)配套的习题集.既可以与教材 配套使用.也可以单独使用 编写本配套习题集旨在协助读者在学习过程中深入了解有机化学反应的基本规律,巩固所学习的知识点 和内容检验自己的学习效果。实际上,做习题是训练学生各种能力的有效途径之一,不仅能促进思考,还能 指出不足甚至找到专业知识的空白。解题重在想考、推理和分析,它的基本价值在于解决问题过程的智力训 练因此,使用习题集的最好方法是先自已解题,再去核对答案,或者对已作了努力而仍未解决的问题去寻求 解释 本习题巢共27章,各章由内容提要和习题解析两部分组成。“内容提要“的编排与第!版教材的章节 致,用极简的语言突出概述教材中的基本概念和知识点·以帮助学习者复习概念、梳理思路、掌握知识的重点 和要点。“习题解析“包括习题和答案,所有的习题与教材的习题基本一致,分两类一类是基本题,旨在帮助 学生理解所学的基本知识,大多放在教材章节各内容层次中:另一类是综合训练题,大多集中在教材章末。随 着有机化学学科的快速发展,有机化学的教学目的已不仅仅是简单的知识传输和接受,还应让学习者了解有 机化学的发展脉络、当前的研究重点和后续的发展方向因此,本书中也包含了若干与科研相关的习题·使学 习者能更为准确地去理解科学发展的规律,使从事科学研究的工作者能更为清楚每一个时代的科学家们思考 可题和解决问题的方式。 本书第1一13章由裴伟伟编写,第1~27章由裴坚编写。本书在录人过程中得到了许多北大化学院本 科生的帮助,第14一27章的习题答案由柳晗宇,陆作雨等同学帮助完成.在此特表感谢。此外.本书的责任编 辑郑月娥副编审为此书的出版做了许多细致的工作,感谢她为本书出版付出的艰辛芳动 本书雄免会有疏漏和不当之处.敏请读者批评指正。 编者 2017年12月于北京大学化学学院

日 录 第1章绪论. 第2章有机化合物的分类表示方式命名 0.4.”47 第3章立体化学.25 第4章烷烃自由基取代反应 .42 第5章紫外光谱红外光谱核磁共振和质谱 52 第6章 卤代烃饱和碳原子上的亲核取代反应B消除反应. 第7章醇和酷. 100 第8章烯烃快烃加成反应(一). 126 第9章共轭烯烃周环反应. 156 第10章醛和丽加成反应(二) 180 第11章羧酸. 212 第12章 羧酸衍生物酰基碳上的亲核取代反应 229 第13章缩合反应 . 253 第14章脂肪胺. 282 第15章苯芳烃芳香性 308 第16章芳环上的取代反应 321 第17章烷基茶衍生物酚醌 . 31 第18章 含氮芳香化合物芳快 362 第19章杂环化合物. 380 第20章 桔类化合物 106 第21章氨基酸、多肽、蛋白质以及核酸 . 423 第22章脂类,萜类和甾族化合物. 135 第23章氧化反应 451 第24章重排反应 457 第25章过渡金属催化的有机反应 46e 第26章有机合成与逆合成分析 471 第27章化学文献与网络检索 479

第1章 绪 论 基础有机化学课程是高等学校化学及相关专业的重要基础课之一,它主要介绍有机化学的 基本概念和基本原理,有机化合物的基本反应、基本合成方法及其结构测定。通过学习·使读者 能运用所学知识解决一些有机化学的问题,并逐步掌握有机化学研究中分析问题和解决问题的 思路和方法,为今后更深入的专业学习打下良好的基础。本章概述有机化学的定义、有机化合物 的特点和结构要点、化学键的概念和类别、酸碱理论。 内容提要 1.1 有机化学和有机化合物的特性 有机化学是研究碳化合物的化学。它的产生和发展与人类的生活,生产有密切的关系。有 机化合物具有分子组成复杂、容易燃烧、熔点低、难溶于水、反应速率比较慢和副反应较多等 特点。 1.2 结构概念和结构理论 有机化学的结构概念和结构理论是在不断探索与思考中逐渐建立起来的。它的主要内容 有:(1)碳原子是四价的:(2)碳原子不但能与其他原子结合成键,还能自相结合成键:(3)分子 不是原子的简单堆积,而是通过复杂的化学结合力按一定的顺序结合起来的,这种原子之间的相 互关系及结合方式即为化合物的分子结构:(4)碳原子具有四面体模型,有机分子具有一定的立 体形象。 13化学键 将分子中的原子结合在一起的作用力称为化学键。有三种典型的化学键:离子键、共价键和 金属键,(1)依靠正、负离子间的静电引力形成的化学键是离子键:(2)两个或多个原子通过共 用电子对而形成的化学键是共价键,共价键有方向性和饱和性·共价键有键长、键能和键角: (3)金属原子的价电子脱离原子核的束缚,变为自由电子,自由电子与金属正离子互相吸引,使原 子紧密堆积起来形成金属晶体,这种使金属原子结合成金属品体的化学键称为金属键,金属键无 方向性和饱和性

1.4酸碱的概念 有下列酸碱理论:(1)酸碱电离理论。其要点是:凡在水溶液中能电离并释放出H的物质 叫酸:能电离并释放出OH的物质叫碱。(2)酸碱的溶剂理论。其要点是:能生成和游剂相同 的正离子者为酸,能生成和溶剂相同的负离子者为碱。(3)酸碱的质子理论其要点是:酸是质 子的给予体,碱是质子的接受体。(4)酸碱的电子理论。其要点是:酸是电了的接受体,碱是电 子的给予体。(⑤)软硬酸碱理论。其要点是:体积小、正电荷数高、可极化性低的中心原子称为 要酸,反之为软酸:将电负性高、可极化性低、难被氧化的配位原子称为硬碱·反之为软碱。并提 出“硬亲硬,软亲软”的经验规则。 习题解析 匀题①写出符合下列分子式的链形化合物的同分异构体。 (i)C.Hie (ii)C H1 答①CH符合链烷烃的通式C,H,所以分子式为C,H的所有链形烷烃均符合题意要求。共 有2个同分异构体,结构简式如下: CH-CHCH 1L, (CH%符合链形单烯烃的通式C,H·所以分子式为CH的所有链形单烯烃均符合题意要 求,共有6个同分异构体,结构简式如下: HC H CH;CH2CH2CH=CH2 CH; CH: HCHC=C CH.CILC=CH 习题②用伞形式表达下列化合物的两个立体异构体 CI CHs (i)D-C-CHs (ii)HO-C-COOH (iii)Br-C-C-CH2OH Br 答题中每一个化合物均含有一个手性碳原子,因此每个化合物均可写出·对对映体,即有两个立体 异构体: (i)DD (ii)OH HO Hon.cmne-H 习题3写出下列分子或离子的一个可能的1,ws结构式,若有孤对电子,请用黑点标明 0 (HSO.(CHCHs (CH (iv)CH=CH (v)NH (vi)

部 HH 0 H Ho H-C-C-H H-C-H H-C=C-H H-N-H H-C-N-H H-N-C-C-6-H HH H (ii) (iv) (vi) (vii) 习题根据八隅规则,在下列结构式上用黑点标明所有的孤对电子。 (i)HOCOCH o a 答0 (n) (ni) .y NN: 习题15 下列化合物中,哪些是离子化合物?哪些是极性化合物?哪些是非极性化合物? KBr.I.CH,CH,.CH,Br.CH.OH 答 KBr是离子化合物,CHBr、CH,(OH是极性化合物.l,CH,CH是非极性化合物 回题16结合教材表13中的数据回答下列问题: ()下列化合物中,编号所指三根CH键的键长是否相等?为什么? CH-CCH ()下列化合物中,编号所指碳碳键的键长是否相等?为什么? CH.PCHCH-CH-CCH ()卤甲烷中,碳氟键与碳碘键的键长为什么不同? (v)氯甲烷和氯乙烷中,碳氯键的键长是否相等?为什么? 答()箭头所指三根C一H键的键长不相等。因为碳原子的杂化轨道中s成分的含量越多,该碳原 子的电负性越大。电负性大的碳原子对电子的吸引强,相应的C一H键键长会短一些。因此这 三根碳氢键的键长顺序为:②>①>③。 ()箭头所指五根碳碳健的键长不相等。①是碳碳参键一根C一Cσ键和两根C。一C。健 ①是碳碳双键,一根C一C中σ键和一根C,一C,π键,②③⑤虽然均为碳碳单键.但碳原子成 键的杂化轨道不同,⑤为Cw一Ca键.②为C一(σ键.③为Cp一Cwσ键。由于键级不同 和形成。键的杂化轨道不同,所以它们的键长不相等。这五根碳碳键的键长顺序为:①<①<⑤ <)<③. ()由于氟原子的电负性大于碘原子的电负性,且氟原子的半径小于碘原子的半径,所以在肉甲 皖中.(一1鞋的建长大于(一F键的键长 (v)不相等。氯乙烷的C一C1键键长比氯甲烷的短。因为氯甲烷的碳原子形成一根C(1键和 三根C一H键,而氯乙烷中的碳原子形成一根CC键、两根CH键和一根C(H键由于 甲基的给电子效应,使得C(I键具有更大的极性,碳、氯两个原子靠得更近

可题7 在下列化合物中,有几个即杂化的碳原子?有几个p杂化的碳原子:有几个杂化的碳原子? 最多有几个碳原子共平面?最多有几个碳原子共直线?哪些原子肯定处在:两个互相垂直的平面中? CH2=C=CH-CH-CH:-C=C-CH; CHaCH3 答有5个s即杂化的碳原子,2个sp杂化的碳原子,3个sp杂化的碳原子。最多行8个碳原子共平 面。最多有4个碳原子共直线。联烯部分,】号碳原子所连的两个氢原子和3号碳原子所连的一 个碳原子和一个氢原子肯定处于两个互相垂直的平面上。 HC=C=CH-CH-CH2-c=C-CH 匀题18 )将下列各组化合物中有下划线的键按键解离能由大到小排列成序。 0 (i)CH CH2-H CH;CH2CH-H ○-Hc-H ()F -a4=1○-ct-ouCa-N:《○eN (i)CH-H CHCHa-F (CH):CH-CI CH=CHCH-OH CH,-1 CH:=CH-CN 答0○-H>H00-H,cH,9I H;C m○aw>r,○atom>○-aiN4,○-u 习题1-9 G-CC-C-CHC-OMC 按酸碱的质子论,下列化合物哪些为酸?哪些为碱?哪些既能为酸,又能为碱? H:S NH,SO H;O HCIO NH,HSO. F HCN 答H0,HCIO,HCN为酸:H,S,NH,H,N、HSO,既能为酸,又能为碱:S万F为碱 习题D按酸碱的电子论,在下列反应的化学方程式中,哪个反应物是酸?哪个反应物是碱” NH+H0→NH+HO (Hs+F→H,S mc8a·Am ·+AIc HaC (w)CH,0CgH+BH,→ 0→BH (wi)Cu0+sO2→Cus0 CoHs 答(i)H,O是酸,H,N是碱: (i)H是酸,HS是碱: (m)HC1是酸,○N是碱: (iv)AIC1,是酸,CH,C()CI是碱: (v)BH是酸,CH,OC,H是碱 (vi)SO2是酸,Cu()是碱。 可题1D略
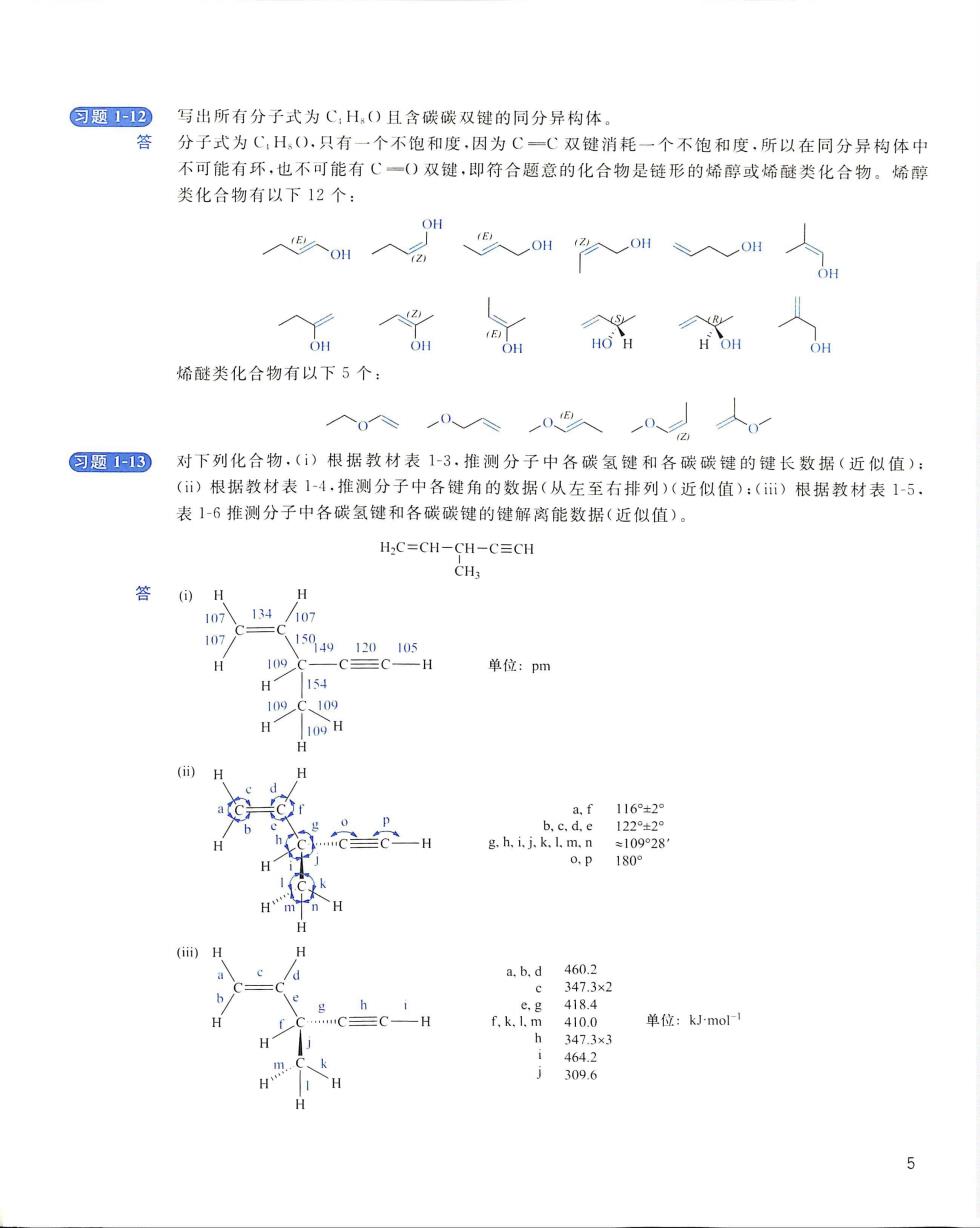
回题2写出所有分子式为C,H,()且含碳碳双键的同分异构体 分子式为C:H,().只有一个不饱和度,因为C一C双键消耗一个不饱和度,所以在同分异构体中 不可能有环,也不可能有C一()双键,即符合题意的化合物是链形的烯醇或烯醚类化合物。烯醇 类化合物有以下12个: 烯醚类化合物有以下5个: 匀题113 )对下列化合物.()根据教材表1-3,推测分子中各碳氢键和各碳碳键的键长数据(近似值): ()根据教材表1-4.推测分子中各键角的数据(从左至右排列)(近似值):()根据教材表1-5, 表1-6推测分子中各碳氢键和各碳碳键的键解离能数据(近似值) H:C=CH-CH-C=CH CHi 答 H 107入134/07 H 109 -C三C -H 单位:pm H H H b.e af H PRLAE H分H H a.b.d H 4100 单位:kJ-mol 3096 H 5

匀题9回答下列问题: ()在下列反应中,H,SO,是酸还是碱?为什么? HONO2 +2H2S04H:O*2HSO +NO: 0 (Gi)为什么CH,NHz的碱性比CH,CNH,强? ()下列常用溶剂中,哪些可以看做Lewis碱性溶剂?为什么? ) CH)CHOH CH.CH-OCH.CH CH,cCH,CH.SCI HCN(CII 新成烷环己烷甲醇 乙醚 丙酮 :甲基甲酰胺 (DMF) (iv)在下列反应中,哪个反应物是Lewis酸?哪个反应物是I.cwis碱 1+ ○+2B购→ 答()H:S0,是酸,因为它在反应中提供H。 (G①由于在CH,NH,中,CH,具有给电子诱导效应和给电子超共轭效应,而在CH,CN中.CH,C具 有吸电子诱导效应和吸电子共轭效应,因此CH,NH:中的氮原子比CH,N,中的氨原子提供孤对 电子的能力更强,也即CHNH:具有更强的碱性。 (曲)Lwis酸碱电子理论认为:凡是能给出电子对的分子,离子或原子团都是碱,所以在所提供 的溶剂中,甲醇、乙醚,丙酮、二甲亚砜、二甲基甲酰胺、吡啶均可看做碱性溶剂。 (iv)在上面的反应中,Br,是Lewis酸,苯是Lewis碱。 6

第2章 有机化合物的分美 表示方式命名 有机化合物数日繁多.掌握有机化合物的分类,系统命名及其表达方式是学习有机化合物的 第一步。 内容提要 21有机化合物的分类 有机化合物有两种主要的分类方法。按碳架分类,各类化合物的关系如下: C开链化合物(脂肪族化合物) 有机化合物 「脂环族化合物 碳环化合物 芳香族化合物 ,环状化合物 { 按官能团分类,有机化合物可分为:烷烃(母体·无官能团),烯烃、炔烃、卤代烃、醇、酚、硫醇 硫酚、醚、醛、酮、磺酸、羧酸酰卤,酸酐,酯,酰胺、胺,亚胺、硝基化合物,亚硝基化合物、晴等。 2.2 有机化合物的表示方式 分子中,原子的连接次序和键合性质叫构造。表达分子构造的化学式叫构造式。构造式有 L,©ws结构式蛛网式,结构简式和键线式四种表达方式。不仅表示分子中各原子的连接次序和 键合性质,还表示原子在空间排列的化学式称为立体结构式,有伞形式,锯架式,Newman投影式 和Fischer投影式。其中表达伞形式的规定是:处于纸面上的键用实线表示.用虚楔形线表示伸 向纸面里的键,用实楔形线表示伸向纸面外的键。 23有机化合物的同分异构体 在有机化学中,具有相同分子式而具有不同结构的现象称为同分异构现象。具有相同分子 式而结构不同的化合物互称为同分异构体,也称为结构异构体,同分异构体可以划分成各种类