
中国绅学我术大学 University of Science and Technology of China 第3章 酸碱理论与电离平衡 Chapter 3 The Theories of Acids Bases and lonization Equilibrium
第3章 酸碱理论与电离平衡 Chapter 3 The Theories of Acids & Bases and Ionization Equilibrium

本章重点 >酸碱概念和理论: ·离子论,质子论,溶剂论,电子论 >弱酸弱碱的电离平衡 ·公式推导,合理近似 >同离子效应和缓冲溶液 ·多重平衡 >盐的水解 2
本章重点 酸碱概念和理论: • 离子论,质子论,溶剂论,电子论 弱酸弱碱的电离平衡 • 公式推导,合理近似 同离子效应和缓冲溶液 • 多重平衡 盐的水解 2

§3.1酸碱理论(Theories of Acids&Bases) 一、离子理论(Ionic Theory) >Arrhenius酸碱的离子理论 The Nobel Prize in Chemistry 1903 the extraordinary services he has rendered to the advancement of chemistry by his electrolytic theory of dissociation 定义: S.A.Arrhenius √酸碱是一种电解质,它们在水溶液中会离解 (1859-1927)) √酸:电离出的阳离子全是氢离子的物质 碱:电离出的阴离子都是氢氧根离子的物质 ·优点:能简明地解释水溶液中的酸碱反应 :酸碱强度 的标度很明确 缺点:把酸碱限制在水溶液中,碱限制于氢氧化物中
一、离子理论 (Ionic Theory) Arrhenius 酸碱的离子理论 • The Nobel Prize in Chemistry 1903 • 定义: 酸/碱是一种电解质,它们在水溶液中会离解 酸:电离出的阳离子全是氢离子的物质 碱:电离出的阴离子都是氢氧根离子的物质 • 优点:能简明地解释水溶液中的酸碱反应;酸碱强度 的标度很明确 • 缺点:把酸碱限制在水溶液中,碱限制于氢氧化物中 §3.1 酸碱理论 (Theories of Acids & Bases) S. A. Arrhenius (1859-1927) the extraordinary services he has rendered to the advancement of chemistry by his electrolytic theory of dissociation 3

二、质子理论(Proton Theory) 1.Bronsted和Lowryi酸碱质子理论(1923年) >定义:An acid is any species that can donate a proton, while a base is any species that can accept a proton ·质子酸:凡是能释放出质子(H)的物种(分子或离子) √分子酸:H,SO4,HCl,CH3COOH,H2C2O4 √阴离子酸:HSO4,HC2O4 √阳离子酸:NH4,HO+,C6HNH3 ·质子碱:凡是能接受质子的物种(分子或离子) √分子碱:NH3,N2H4,NHOH √阴离子碱:OH,S2,CH,COO √阳离子碱:NH+ 4
二、质子理论 (Proton Theory) 1. Brnsted和Lowry酸碱质子理论 (1923年) 定义:An acid is any species that can donate a proton, while a base is any species that can accept a proton. • 质子酸:凡是能释放出质子(H+)的物种 (分子或离子) 分子酸:H2SO4,HCl,CH3COOH, H2C2O4 阴离子酸:HSO4,HC2O4 阳离子酸:NH4+,H3O+,C6H5NH3+ • 质子碱:凡是能接受质子的物种 (分子或离子) 分子碱:NH3,N2H4,NH2OH 阴离子碱:OH,S2,CH3COO 阳离子碱:N2H5+ 4

2.共轭酸碱对(Conjugate acid-base pairs) A(酸)÷B(碱)+H(质子) 。 弱酸共轭强碱,弱碱共轭强酸 NH+NH2+H+ [Fe(H2O)6]3+=[Fe(OH)H2O)s]2++H [CH NH][CH NH2]+H+ ·Practice Exercise: What is the conjugate base of each of the following acids: HCIO4,H2S,PH4*,HCO;,H2O What is the conjugate acid of each of the following bases: CN-,SO2-,HCO3,H2O 5
2. 共轭酸碱对 (Conjugate acid-base pairs) A (酸) B (碱) + H+ (质子) • 弱酸共轭强碱,弱碱共轭强酸 NH4+ NH3 + H+ [Fe(H2O)6]3+ [Fe(OH)(H2O)5]2+ + H+ [CH3NH3]+ [CH3NH2] + H+ • Practice Exercise: What is the conjugate base of each of the following acids: HClO4,H2S,PH4+,HCO3,H2O What is the conjugate acid of each of the following bases: CN,SO42,HCO3,H2O 5

常见共轭酸碱对 酸 化学式 K9(25C 共轭碱 氢碘酸 H ~1011 氢溴酸 HBr ~109 Br 高氯酸 HCIO4 ~107 CIO 盐酸 HCI ~107 CI- 氯酸 HCIO; ~103 C103 硫酸 H2SO ~102 HSO 水合氢离子 HO* 1 H20 硫酸氢根离子 HSO- 1.0×10-2 S042- 六水合铁()离子 [Fe(H2O)6]3+ 7.7×10-3 [Fe(OH)(H2O)s]2+ 铵离子 NH 5.6×10-10 NH3 过氧化氢 H202 2.0×10-12 H02 水 H20 1.0×10-14 OH-
酸 化学式 Ka (25 C) 共轭碱 氢碘酸 HI 1011 I 氢溴酸 HBr 109 Br 高氯酸 HClO4 107 ClO4 盐酸 HCl 107 Cl 氯酸 HClO3 103 ClO3 硫酸 H2SO4 102 HSO4 水合氢离子 H3O+ 1 H2O 硫酸氢根离子 HSO4 1.0 102 SO42 六水合铁(III)离子 [Fe(H2O)6]3+ 7.7 103 [Fe(OH)(H2O)5]2+ 铵离子 NH4+ 5.6 1010 NH3 过氧化氢 H2O2 2.0 1012 HO2 水 H2O 1.0 1014 OH 常见共轭酸碱对

3.质子传递解释化学反应 >酸碱反应概念扩大到气相、液相、 电离和水解等反应 H (1)气相酸碱反应: HCI(g)+NH3(g) NHCI(s) neutralization reaction A1 B2 A2 B1 H+ (2)液相离解反应: H,0+H,0H0+OH auto ionization H HAc+Ac acid ionization H ·base ionization NH+H,0~NH时+OH H (3)水解反应: Ae+H0、HAe+OH Ko=Kw/Ka=Kh ·hydrolysis reaction NH+H,0。→NH+H,OK=Kw/K,=K
3. 质子传递解释化学反应 酸碱反应概念扩大到气相、液相、电离和水解等反应 (1) 气相酸碱反应: • neutralization reaction (2) 液相离解反应: • auto ionization • acid ionization • base ionization (3) 水解反应: • hydrolysis reaction _ HAc + H2O H3O+ + Ac Ka H+ _ H2O + H2O H3O+ + OH Kw H+ _ Ac + H2O HAc + OH _ H+ Kb = Kw / Ka = Kh _ NH3 + H2O NH4 + OH Kb H+ + 7 + H+ NH4 + H2O NH3 + H3O+ Ka = Kw / Kb = Kh

4.特点: ·质子论中不存在盐的概念(离子酸、离子碱) 酸碱是共轭的:弱酸共轭强碱,弱碱共轭强酸 ·酸碱强度的相对性:酸碱和溶剂释放质子和接受质子 的能力综合决定 >优点: ·扩大了酸碱和酸碱反应的范围 ·水溶液中,质子论的酸强度标度与Arrhenius理论一致 >缺点: ·不能说明无质子溶剂(SO3、N2O4)中的酸碱反应 酸的定义与Arrhenius:理论中并没有变化 8
4. 特点: • 质子论中不存在盐的概念 (离子酸、离子碱) • 酸碱是共轭的:弱酸共轭强碱,弱碱共轭强酸 • 酸碱强度的相对性:酸碱和溶剂释放质子和接受质子 的能力综合决定 优点: • 扩大了酸碱和酸碱反应的范围 • 水溶液中,质子论的酸强度标度与Arrhenius理论一致 缺点: • 不能说明无质子溶剂 (SO3、N2O4)中的酸碱反应 • 酸的定义与Arrhenius理论中并没有变化 8
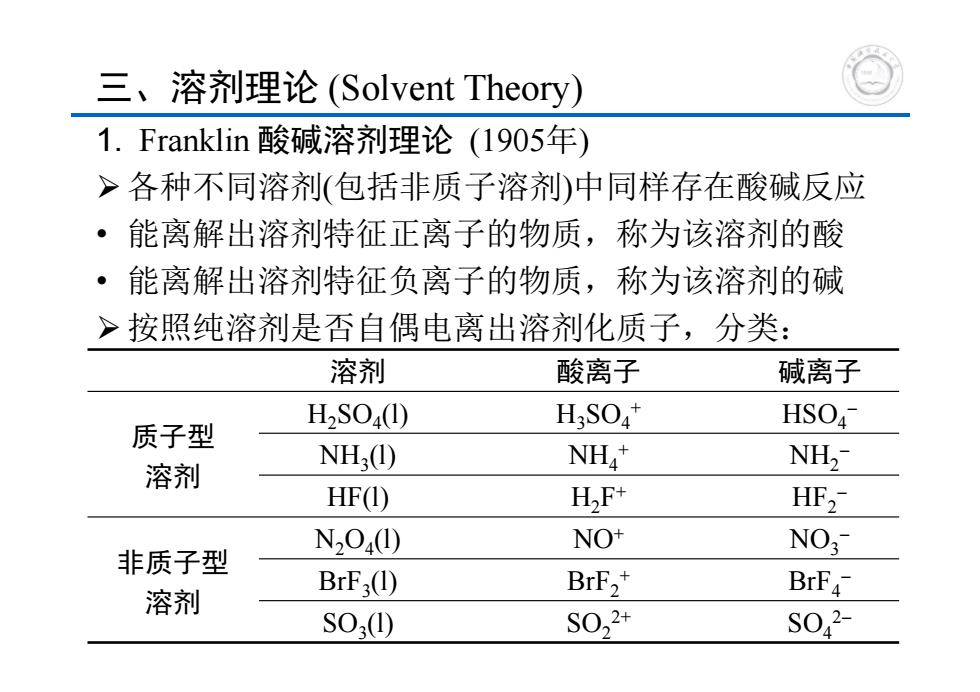
三、溶剂理论(Solvent Theory) 1.Franklin酸碱溶剂理论(1905年) >各种不同溶剂(包括非质子溶剂)中同样存在酸碱反应 ·能离解出溶剂特征正离子的物质,称为该溶剂的酸 ·能离解出溶剂特征负离子的物质,称为该溶剂的碱 >按照纯溶剂是否自偶电离出溶剂化质子,分类: 溶剂 酸离子 碱离子 H2S04(①) H:SO* HSO 质子型 NH(1) NH NH2 溶剂 HF(1) H,F+ HF2 N204(I) NO+ NO; 非质子型 BrF3(1) BrF2+ 溶剂 BrF S0,①) S022+ S042-
三、溶剂理论 (Solvent Theory) 1. Franklin 酸碱溶剂理论 (1905年) 各种不同溶剂(包括非质子溶剂)中同样存在酸碱反应 • 能离解出溶剂特征正离子的物质,称为该溶剂的酸 • 能离解出溶剂特征负离子的物质,称为该溶剂的碱 按照纯溶剂是否自偶电离出溶剂化质子,分类: 9 溶剂 酸离子 碱离子 质子型 溶剂 H2SO4(l) H3SO4+ HSO4 NH3(l) NH4+ NH2 HF(l) H2F+ HF2 非质子型 溶剂 N2O4(l) NO+ NO3 BrF3(l) BrF2+ BrF4 SO3(l) SO22+ SO42

2.优点:将酸碱扩大到非水体系 >典型的中和反应: 水溶剂:H,O++OH=2HO ·非水体系: NH(①)中:一元酸NH4+,一元碱NH2,二元碱NHP-,三元碱N3- NHNO+NaNH,NaNO+2NH3 BiN 3NHCI BiCl,+4NH3 CH,COOH()中:HClO4+CH COONa=NaCIO4+CHCOOH COC2中:[COC][AICl4]+KCI=K[AICL4]+COCL2 S02I)中:S0Cl2+Cs2S03=2CsC1+2S02 >缺点:不能解释不电离的溶剂及无溶剂的酸碱 10
2. 优点:将酸碱扩大到非水体系 典型的中和反应: • 水溶剂:H3O+ + OH = 2H2O • 非水体系: NH3(l)中:一元酸NH4+,一元碱NH2,二元碱NH2,三元碱N3 NH4NO3 + NaNH2 = NaNO3 + 2NH3 BiN + 3NH4Cl = BiCl3 + 4NH3 CH3COOH(l)中: HClO4 + CH3COONa = NaClO4 + CH3COOH COCl2(l)中: [COCl] [AlCl4] + KCl = K[AlCl4] + COCl2 SO2(l)中: SOCl2 + Cs2SO3 = 2CsCl + 2SO2 缺点:不能解释不电离的溶剂及无溶剂的酸碱 10