
金属的电化学腐蚀及防腐 原电池原理的应用 高材0305关银燕
金属的电化学腐蚀及防腐 原电池原理的应用 高材0305 关银燕

金属腐蚀的分类 ·化学腐蚀: 金属表面与介质如气体或非电解质液体等 因发生化学作用而引起的腐蚀,称为化学 腐蚀。 化学腐蚀作用进行时无电流产生
金属腐蚀的分类 • 化学腐蚀: 金属表面与介质如气体或非电解质液体等 因发生化学作用而引起的腐蚀,称为化学 腐蚀。 化学腐蚀作用进行时无电流产生

电化学腐蚀: 金属表面与介质如潮湿空气或电解质溶液等,因 形成微电池,金属作为阳极发生氧化而使金属发 生腐蚀。这种由于电化学作用引起的腐蚀称为电 化学腐蚀。 电化学腐蚀作用进行时有电流产生
•电化学腐蚀 : 金属表面与介质如潮湿空气或电解质溶液等,因 形成微电池,金属作为阳极发生氧化而使金属发 生腐蚀。这种由于电化学作用引起的腐蚀称为电 化学腐蚀。 电化学腐蚀作用进行时有电流产生
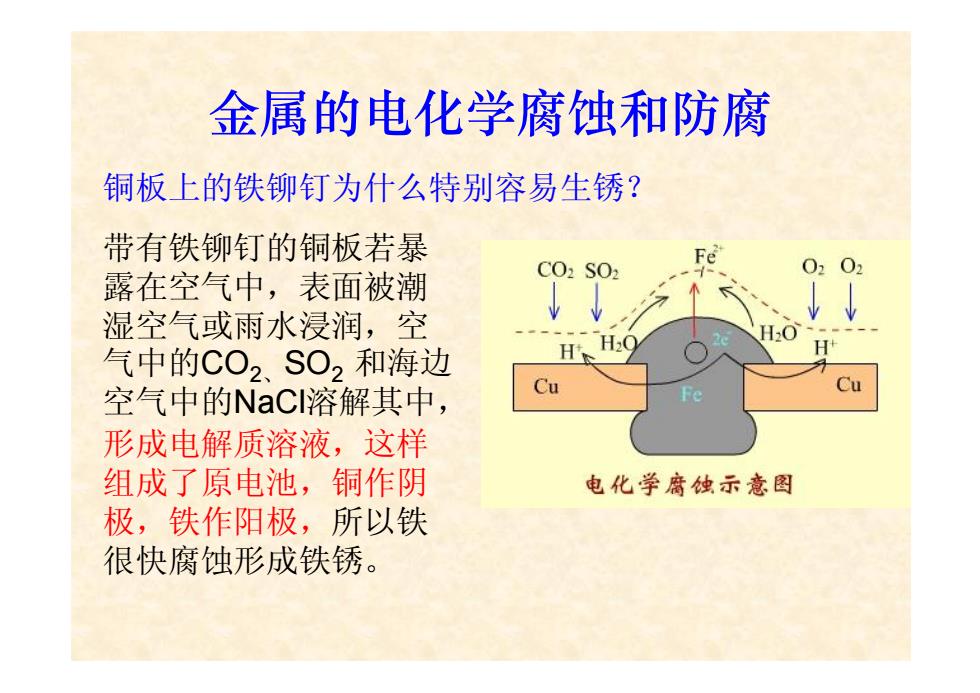
金属的电化学腐蚀和防腐 铜板上的铁铆钉为什么特别容易生锈? 带有铁铆钉的铜板若暴 Fe 0202 露在空气中,表面被潮 CO2 SO 湿空气或雨水浸润,空 0 气中的CO2,SO2和海边 空气中的NaC溶解其中, Cu 形成电解质溶液,这样 组成了原电池,铜作阴 电化学腐蚀示意图 极,铁作阳极,所以铁 很快腐蚀形成铁锈
金属的电化学腐蚀和防腐 铜板上的铁铆钉为什么特别容易生锈? 带有铁铆钉的铜板若暴 露在空气中,表面被潮 湿空气或雨水浸润,空 气中的CO2、 SO2 和海边 空气中的NaCl溶解其中, 形成电解质溶液,这样 组成了原电池,铜作阴 极,铁作阳极,所以铁 很快腐蚀形成铁锈

铁的腐蚀 ·铁锈的组成 ·腐蚀时发生的反应 ·防腐方法
铁的腐蚀 • 铁锈的组成 • 腐蚀时发生的反应 • 防腐方法

铁锈的组成 铁在酸性介质中只能氧化成二价铁: Fe(s)→Fe2++2e 二价铁被空气中的氧气氧化成三价铁,三价铁在水溶液中 生成Fe(OH)3沉淀Fe(OH)3沉淀又可能部分失水生成Fe 203。 所以铁锈是一个由Fe2+,Fe3+,Fe(OHD,Fe,O,等化合物 组成的疏松的混杂物质。 @
铁锈的组成 铁在酸性介质中只能氧化成二价铁: 2+ Fe(s) Fe 2e ® + - 二价铁被空气中的氧气氧化成三价铁,三价铁在水溶液中 生成Fe(OH)3沉淀 Fe(OH)3沉淀 又可能部分失水生成Fe 2O3。 所以铁锈是一个由 等化合物 组成的疏松的混杂物质。 2+ 3+ F 3 2 3 e ,Fe ,Fe(OH) ,Fe O

腐蚀的反应 ·阴极: (1)析氢腐蚀 酸性介质中H在阴极上还原成氢气析出。 H+e→2H,(g)E(H*H,)=- RT In 设4=1ar=107, 则H)=0.413V 铁阳极氧化,当a(Fe2)=106时认为已经发生腐蚀, 00=-0617N E(FeFe)=ES (FeFe)-RTIn1 这时组成原电池的电动势为0.204V。 是自发电池。 PDF
腐蚀的反应 • 阴极: (1)析氢腐蚀 2 + + + H 2 2 H 1 2 H e H (g) (H |H ) ln RT a E F a - + ® = - 酸性介质中 H + 在阴极上还原成氢气析出。 铁阳极氧化,当 a(Fe 2+ 6 ) =10- 时认为已经发生腐蚀, 2+ 2+ 6 1 (Fe |Fe) (Fe |Fe) ln 10 0.617V RT E E zF - = - = - $ 设 2 + , 则 7 H H a a 1, 10- = = + 2 E(H |H ) = -0.413 V 这时组成原电池的电动势为0.204V,是自发电池。 PDF

(2)耗氧腐蚀 如果既有酸性介质,又有氧气存在,在阴极上发生消耗氧的 还原反应: 02(g)+4H+4e→2H,0 E(O:H,O.H)=g:RTIn1 4F do,dre E=1.229V 设ao,=1,a=10,则E(02H,0,H)=0.816V 这时与EFe2F®)(-0.617N)阳极组成原电池的 电动势为1433V。显然耗氧腐蚀比析氢腐蚀严 重得多
(2)耗氧腐蚀 + 2 + 2 2 + 2 2 4 O H O (g)+4H 4e 2H O 1 (O |H O,H ) ln 4 RT E E F a a - + ® = - $ E =1.229 V $ + 2 + 2 7 O H 2 a a 1, 10 , E(O |H O,H ) 0.816V - 设 则 = = = 如果既有酸性介质,又有氧气存在,在阴极上发生消耗氧的 还原反应: 这时与 (-0.617V)阳极组成原电池的 电动势为 。显然耗氧腐蚀比析氢腐蚀严 重得多。 2+ E(Fe |Fe) 1.433 V

防腐方法: ·非金属防腐:在金属表面涂上油漆、搪瓷、 塑料、沥青等,将金属与腐蚀介质隔开。 ·金属保护层:在需保护的金属表面用电镀 或化学镀的方法镀上Au,Ag,Ni,Cr,Zn, Sn等金属,保护内层不被腐蚀
防腐方法: • 非金属防腐:在金属表面涂上油漆、搪瓷、 塑料、沥青等,将金属与腐蚀介质隔开。 • 金属保护层:在需保护的金属表面用电镀 或化学镀的方法镀上Au,Ag,Ni,Cr,Zn, Sn等金属,保护内层不被腐蚀

(3)电化学保护 1.保护器保护 将被保护的金属如铁作阴 极,较活泼的金属如Zn作牺牲性阳极。阳极 腐蚀后定期更换。 2.阴极保护外加电源组成一个电解池, 将被保护金属作阴极,废金属作阳极。 3.阳极保护用外电源,将被保护金属接阳 极,在一定的介质和外电压作用下,使阳极 钝化
(3)电化学保护 1.保护器保护 将被保护的金属如铁作阴 极,较活泼的金属如Zn作牺牲性阳极。阳极 腐蚀后定期更换。 2.阴极保护 外加电源组成一个电解池, 将被保护金属作阴极,废金属作阳极。 3.阳极保护 用外电源,将被保护金属接阳 极,在一定的介质和外电压作用下,使阳极 钝化