
化学反应焓、熵、自由能与温度关系 一、原理 组分B的恒压摩尔热容(单位JKmo)与温度T(单位K)的关系式通常可写成: Cm=dn+bx10+c1+dx10 (1) 恒压下化学反应格与温度的关系是: d△,且=ACpn=∑y,Cm&2 恒压下化学反应熵变与温度的关系是: ds.sc (3) 若已知T温度时的恒压反应格为△,H(T),则T,温度时的恒压反应焓△,H.(T2)可 以通过对(2)式积分得到: △,H(T)=△,Hn(C)+ACpdT A,H.()+Σva-T+Σbx10-6-T+5Σy,c×10*g-T) (4) 若已知T1温度时的恒压反应熵为△,S(亿),则T2温度时的恒压反应痛△,S(T)可 以通过对(2)式积分得到: 5.()..r 4.+2a,2+2A-260t- 59 由△,Hn(T)和△,S(T2),可以得到乃时的反应摩尔Gibbs自由能变△,Gn(T2):
化学反应焓、熵、自由能与温度关系 一、原理 组分 B 的恒压摩尔热容(单位 J·K -1 ·mol-1)与温度 T(单位 K)的关系式通常可写成: (1) 恒压下化学反应焓与温度的关系是: = D = å D B p m B p m B r m C C dT d H , n , , (2) 恒压下化学反应熵变与温度的关系是: dT T C d S p m r m D , D = (3) 若已知 T1温度时的恒压反应焓为 ( ) Dr Hm T1 ,则 T2温度时的恒压反应焓 ( ) Dr Hm T2 可 以通过对(2)式积分得到: ò D = D + D 2 1 2 1 , ( ) ( ) T T r m r m p m H T H T C dT = ( ) ( ) ( ) ÷ ÷ ø ö ç ç è æ - ´ - D + - + ´ - + ´ - å å å å - - 2 1 5 3 1 3 2 2 6 1 2 2 3 1 2 1 1 1 10 10 3 1 10 2 1 ( ) T T d H T a T T b T T c T T B B B B B B B B B B r m B B n n n n ……………………..(4) 若已知 T1 温度时的恒压反应熵为 ( ) T1 S Dr m ,则 T2 温度时的恒压反应熵 ( ) T2 S Dr m 可 以通过对(2)式积分得到: ò D D = D + 2 1 , 2 1 ( ) ( ) T T p m r m r m dT T C S T S T = ( ) ( ) ÷ ÷ ø ö ç ç è æ - ´ - D + + - + ´ - + å å å å - 2 2 5 2 1 2 2 6 2 1 1 2 1 2 1 1 1 2 10 10 2 1 ( ) ln T T d b T T c T T T T S T a B B B B B B B B r m B B B B n n n n (5) 由 ( ) Dr Hm T2 和 ( ) T2 S Dr m ,可以得到 T2时的反应摩尔 Gibbs 自由能变 ( ) DrGm T2 : 3 6 2 5 2 , , 10 10 10 - - - C p m B = aB + bB ´ T + c B ´ T + d B ´ T

AG.(T)=△H(T2)-TAS.(T2)(6) 二、流程图 △,H.(T2)计算程序可以同T2温度下的△,S.(T),△,G(T2)计算过程合并在一起, 流程图如下, AH.(T).AS() 用式3.5计垃 AS.(G) 读入 aa.ba.ca.da 用式3.6i计宣 AG.(G) 出结果 T2温度下△,H.()、△S(T)、△,G.(T)计算程序流程图 三、练习 1.反应 C2H,OH(g)+HCI(g)=C2H;Cl(g)+H2O(g) 摩尔热容与温度T(K)之间关系式子为: Cpm=a+bx10-T+cx10-T2+dx10T- 反应式中各个组分的常数a,b,c,d以及△Hne(298K)AS.(298K)如下表(2.1),求 反应在373K时标准压力下的△H⊙(373K).△S⊙(373K,△Gm(373K)
( ) DGm T2 = ( ) DHm T2 -T ( ) T2 SD m (6) 二、流程图 ( ) Dr Hm T2 计算程序可以同 T2温度下的 ( ) T2 S Dr m , ( ) DrGm T2 计算过程合并在一起, 流程图如下. T2温度下 ( ) Dr Hm T2 、 ( ) T2 S Dr m 、 ( ) DrGm T2 计算程序流程图 三、 练习 1. 反应 C H OH(g) HCl(g) C H Cl(g) H O(g) 2 5 + = 2 5 + 2 摩尔热容与温度 T(/K)之间关系式子为: 反应式中各个组分的常数 a,b,c,d 以及DrHm y(298K) DrSm y(298K)如下表(2.1),求 反应在 373K 时标准压力下的DrHm y(373K), DrSm y(373K), DrGm y(373K)。 3 6 2 5 2 , 10 10 10 - - - C p m = a + b ´ T + c ´ T + d ´ T
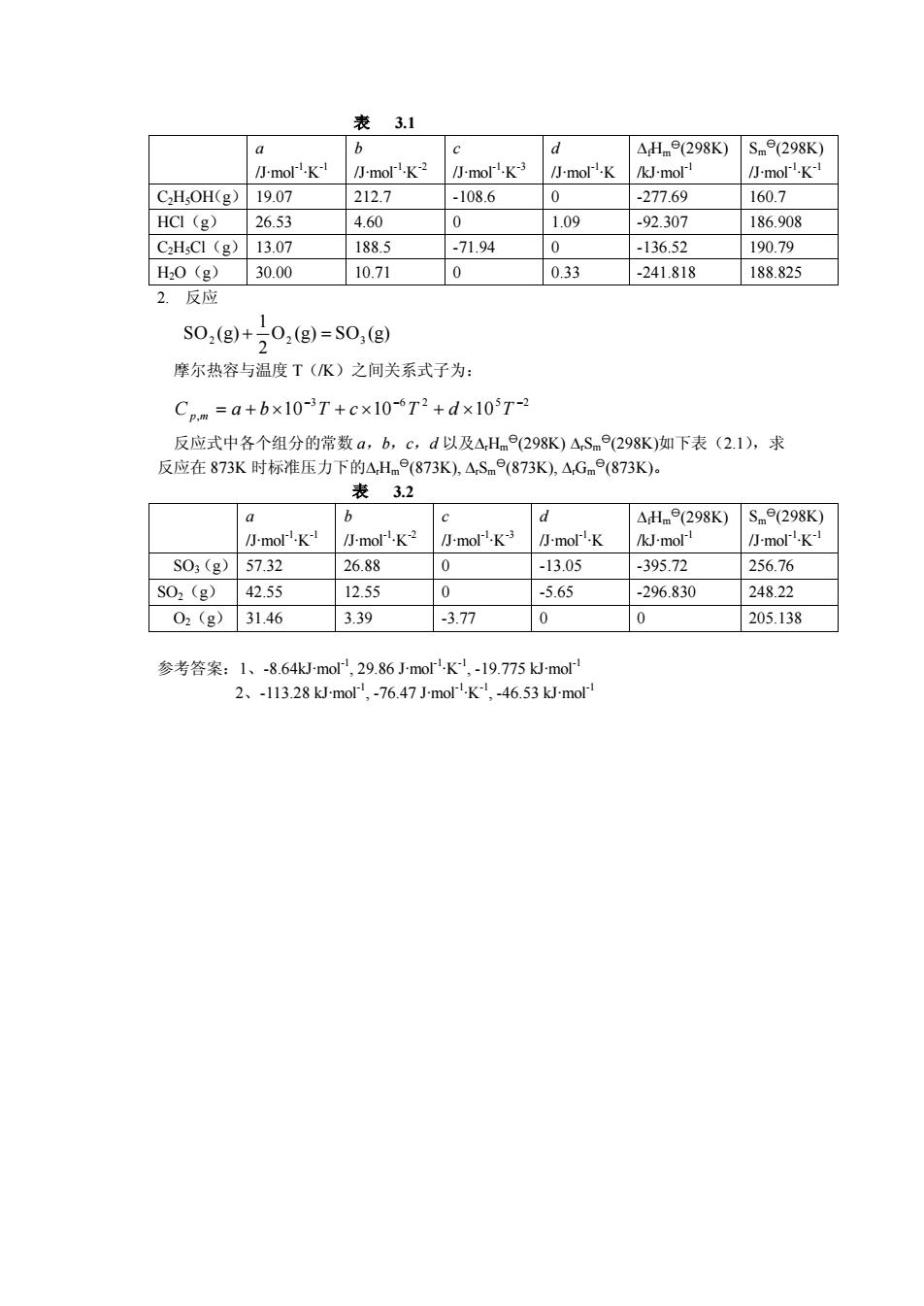
表3.1 a 6 c △Hme(298K) Sm(298K) 小molK- 小molK2 小moK3 小molK /kJ-mol 小molK C2HsOH(g) 19.07 212.7 -108.6 0 -277.69 160.7 HCI (g) 26.53 4.60 0 1.09 -92.307 186.908 C2HsCl (g) 13.07 188.5 -71.94 0 -136.52 190.79 H0(g) 30.00 10.71 0 0.33 241.818 188.825 2.反应 S02(g)+502(g)=S0(g) 摩尔热容与温度T(K)之间关系式子为: Cpm=a+b×10-3T+c×10-6T2+d×105T-2 反应式中各个组分的常数a,b,c,d以及△Hme(298K)△Sme(298K)如下表(2.1),求 反应在873K时标准压力下的△Hm9(873K),△Sm9(873K),△Gme(873K)。 表 3.2 a b d △Hme(298K) Sm9(298K) 小moll-K-l 小molK-2 小molK-3 小moK /kJ-mol 小moK- SO3(g) 57.32 26.88 0 -13.05 -395.72 256.76 SO2(g) 42.55 12.55 0 -5.65 -296.830 248.22 02(g) 31.46 3.39 -3.77 0 0 205.138 参考答案:1、-8.64Jmol,29.86 J-morK,-19.775 kJ-mol 2、-113.28 kJ-mol,-76.47 J-mol.K,-46.53kJmo
表 3.1 a /J·mol-1 ·K -1 b /J·mol-1 ·K -2 c /J·mol-1 ·K -3 d /J·mol-1 ·K DfHm y(298K) /kJ·mol-1 Sm y(298K) /J·mol-1 ·K -1 C2H5OH(g) 19.07 212.7 -108.6 0 -277.69 160.7 HCl(g) 26.53 4.60 0 1.09 -92.307 186.908 C2H5Cl(g) 13.07 188.5 -71.94 0 -136.52 190.79 H2O(g) 30.00 10.71 0 0.33 -241.818 188.825 2. 反应 O (g) SO (g) 2 1 SO (g) 2 + 2 = 3 摩尔热容与温度 T(/K)之间关系式子为: 反应式中各个组分的常数 a,b,c,d 以及DrHm y(298K) DrSm y(298K)如下表(2.1),求 反应在 873K 时标准压力下的DrHm y(873K), DrSm y(873K), DrGm y(873K)。 表 3.2 a /J·mol-1 ·K -1 b /J·mol-1 ·K -2 c /J·mol-1 ·K -3 d /J·mol-1 ·K DfHm y(298K) /kJ·mol-1 Sm y(298K) /J·mol-1 ·K -1 SO3(g) 57.32 26.88 0 -13.05 -395.72 256.76 SO2(g) 42.55 12.55 0 -5.65 -296.830 248.22 O2(g) 31.46 3.39 -3.77 0 0 205.138 参考答案:1、-8.64kJ·mol-1, 29.86 J·mol-1 ·K -1 , -19.775 kJ·mol-1 2、-113.28 kJ·mol-1 , -76.47 J·mol-1 ·K -1 , -46.53 kJ·mol-1 3 6 2 5 2 , 10 10 10 - - - Cp m = a + b ´ T + c ´ T + d ´ T