
5.5滴定误差
5.5 滴定误差

滴定误差(一) 意义 化学滴定法是以指示剂改变颜色来指示 终点的.而滴定终点不一定和化学计量点 相符。两者差异造成的误差称滴定误差 或终点误差。 正确选择指示剂和准确辨别指示剂的颜 色过渡,可减少滴定误差,提高分析的 准确度。 0000000
滴定误差(一) 意义 • 化学滴定法是以指示剂改变颜色来指示 终点的. 而滴定终点不一定和化学计量点 相符。两者差异造成的误差称滴定误差 或终点误差。 • 正确选择指示剂和准确辨别指示剂的颜 色过渡,可减少滴定误差,提高分析的 准确度

滴定误差(二) 滴定误差TE可由滴定终点的pH值计算出标准 溶液加入量不足时剩余被滴定物质占原有物质 的比例,或过量的标准溶液占理论加入量的比 例求得。 TE=士 nB×100% n B 式中: n'B是滴定终点时被测B物质的余量 (或B标准溶液过量的量),np是被测B物质 的总量(或B标准溶液理论加入量),单位为 摩尔,。用余量计算时取负号,用过量时取正号。 00000000000000000
滴定误差(二) • 滴定误差TE可由滴定终点的 pH 值计算出标准 溶液加入量不足时剩余被滴定物质占原有物质 的比例,或过量的标准溶液占理论加入量的比 例求得。 100% ' = B n B n TE 式中: n ' B 是滴定终点时被测B物质的余量 (或 B标准溶液过量的量),nB 是被测B物质 的总量(或B 标准溶液理论加入量),单位为 摩尔,用余量计算时取负号,用过量时取正号
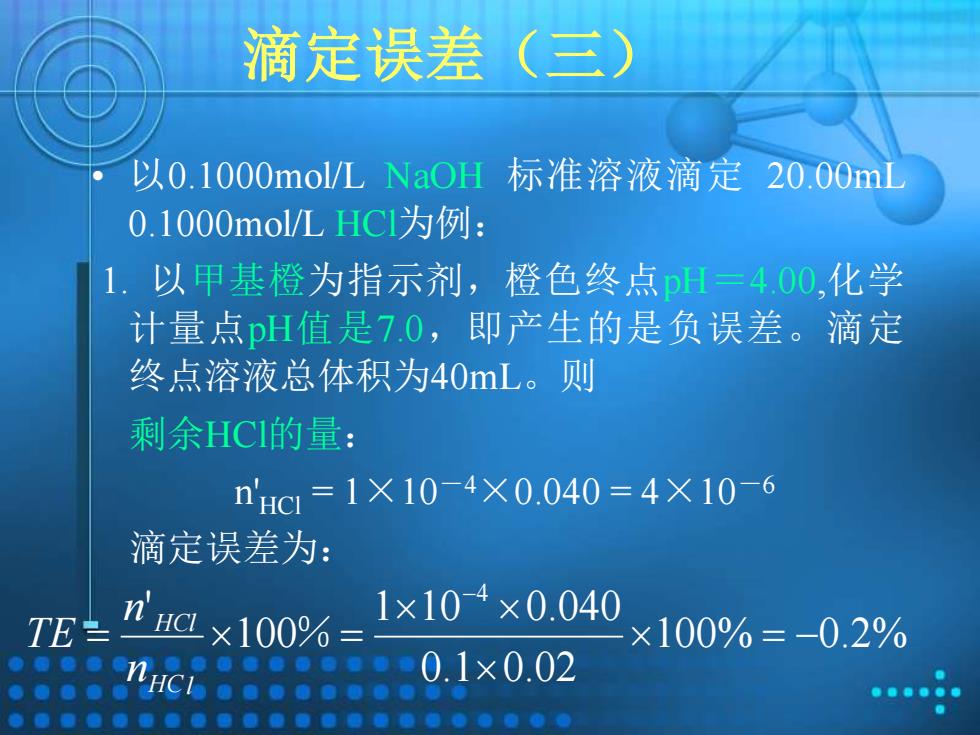
滴定误差 (三) 以0.1000mol/L NaOH 标准溶液滴定20.00ml 0.1000mol/LHC1为例: 1.以甲基橙为指示剂,橙色终点pH=400,化学 计量点诅值是7.0,即产生的是负误差。滴定 终点溶液总体积为40mL。则 剩余HCI的量: nHc=1×10-4×0.040=4×10-6 滴定误差为: H×100% 1×104×0.040 TE ×100%=-0.2% HCI 0.1×0.02
滴定误差(三) • 以0.1000mol/L NaOH 标准溶液滴定 20.00mL 0.1000mol/L HCl为例: 1. 以甲基橙为指示剂,橙色终点pH=4.00,化学 计量点pH值是7.0,即产生的是负误差。滴定 终点溶液总体积为40mL。则 剩余HCl的量: n'HCl = 1×10-4×0.040 = 4×10-6 滴定误差为: 100% 0.2% 0.1 0.02 1 10 0.040 100 ' 4 = − = = − % H Cl HCl n n TE

滴定误差(四) 2用酚酞为指示剂,则微红色终点时 9.00(即氢氧根浓度10-5molL);NaOH 标准溶液理论加入量为20.00L,化学计 量点pH=7.00,因而滴定误差为正,有: 7E=”01×100%=10-5x0.040 ×100%=0.02% nNaOH 0.1×0.020 由计算可见,选用酚酞滴定误差较甲基 橙小得多
滴定误差(四) 2.用酚酞为指示剂,则微红色终点时 pH= 9.00(即氢氧根浓度10-5 mol/L);NaOH 标准溶液理论加入量为20.00mL,化学计 量点pH=7.00,因而滴定误差为正,有: 100% 0.02% 0.1 0.020 10 0.040 100 ' 5 = = = − % NaOH NaOH n n TE 由计算可见,选用酚酞滴定误差较甲基 橙小得多

5.6酸碱滴定法的应用
5.6 酸碱滴定法的应用

5.6.1盐酸滴定混合碱的示意 (双指示剂酚酞、甲基澄法) NaOH V NaHCO, NaOH+Na CO. Na2CO V,>V2 V=V2 NaHC03+Na2C03 VI<V2
5.6.1 盐酸滴定混合碱的示意 (双指示剂酚酞、甲基橙法)

例6一 烧碱中NaOH和Na,CO,含量的测定(双指示 剂法)》 准确称取一定量试样,溶解后,先以酚酞为 指示剂,用HCI标准溶液滴定至红色刚消失, 记下用去HCI的体积V,(mL)。这时NaOH 全部被中和,而Na,CO仅被中和到NaHCO3, 向溶液中加入甲基橙,继续用HCI滴定至橙 红色,记下用去的HCI体积V,(mL)。显 然,V,是滴定NaHCO3所消耗HCI的体积
例6一 • 烧碱中NaOH和Na2CO3含量的测定(双指示 剂法) • 准确称取一定量试样,溶解后,先以酚酞为 指示剂,用HCl标准溶液滴定至红色刚消失, 记下用去HCl的体积V1(mL)。这时NaOH 全部被中和,而Na2CO3仅被中和到NaHCO3 ; 向溶液中加入甲基橙,继续用HCl滴定至橙 红色,记下用去的HCl体积V2(mL)。显 然,V2是滴定NaHCO3所消耗HCl的体积

例一(续) 出计量关系可知,Na,CO,被中和到 NaHCO,与NaHCO,被中和到H,CO,所消 耗HCI的体积是相等的。 由此可得: NacO%= 1/2xcHg×2YxMa,c0×100 m,×1000 NaoH%=)MOMX100 m,×1000
例一(续) • 由计量关系可知 , Na2CO3 被中和到 NaHCO3与NaHCO3被中和到H2CO3所消 耗HCl的体积是相等的。 由此可得: 100 1000 1/ 2 2 % 2 3 2 3 = s HCl Na CO m c V M NaCO 100 1000 ( ) % 1 2 − = s HCl NaOH m c V V M NaOH

5.6.2Na,CO3和NaHCO,混合物的分析 同样可采用以上方法,操作相同,此时 滴定Na,CO,所耗HCI体积为2V,而滴定 NaHCO,所耗HCI体积为(V2-V),据 此可计算它们的含量
5.6.2 Na2CO3和NaHCO3混合物的分析 • 同样可采用以上方法,操作相同,此时 滴定Na2CO3所耗 HCl体积为2V1,而滴定 NaHCO3所耗 HCl体积为(V2 -V1),据 此可计算它们的含量