
>化学分析: 利用化学反应及其计量关系来进行分析的 方法。 >仪器分析: 采用比较复杂或者特殊的仪器设备,通过 测量物质的某些物理或物理化学性质的参 数及其变化来确定物质的化学组成、成分 含量及化学结构的一类分析方法。 化学分析与仪器分析的关系?
➢化学分析: 利用化学反应及其计量关系来进行分析的 方法。 ➢仪器分析: 采用比较复杂或者特殊的仪器设备,通过 测量物质的某些物理或物理化学性质的参 数及其变化来确定物质的化学组成、成分 含量及化学结构的一类分析方法。 化学分析与仪器分析的关系?
获诺贝尔奖的仪器分析项目(1) ★W.H.Bragg&W.L.Bragg(英)物理奖1915 应用X射线研究晶体结构 ★F.W.Aston(英)化学奖1922 用质谱法发现同位素并应用于定量分析 ★F.Pregl(奥地利)化学奖1923 开创有机物质的微量分析法 ★F.Bloch&E.M.Purcell(美) 物理奖1952 发明核磁的测定方法 ★A.J.P.Martin&R.L.M.Syngc(英)化学奖1952 开创气相分配色谱分析法
获诺贝尔奖的仪器分析项目(1) ★ W.H.Bragg & W.L.Bragg (英) 物理奖 1915 应用X射线研究晶体结构 ★ F.W.Aston (英) 化学奖 1922 用质谱法发现同位素并应用于定量分析 ★ F.Pregl (奥地利) 化学奖 1923 开创有机物质的微量分析法 ★ F.Bloch & E.M.Purcell (美) 物理奖 1952 发明核磁的测定方法 ★ A.J.P.Martin & R.L.M.Syngc (英) 化学奖 1952 开创气相分配色谱分析法

获诺贝尔奖的仪器分析项目(2) ★J.Hegrovsky(捷)化学奖1959 开创极谱分析法 ★R.Yalow(美)生理医学奖1977 开创放射免疫分析法 ★K.M.Siegbahn(瑞典)物理奖1981 发展高分辨率电子光谱学并应用于化学分析 ★R.R.Ernst(瑞士)化学奖1991 发展高分辨核磁共振波谱学方法 ★A.Zewail(美籍埃及人)化学奖1999 利用激光闪烁研究化学反应
获诺贝尔奖的仪器分析项目 (2) ★ J.Hegrovsky (捷) 化学奖 1959 开创极谱分析法 ★ R.Yalow (美) 生理医学奖 1977 开创放射免疫分析法 ★ K.M.Siegbahn (瑞典) 物理奖 1981 发展高分辨率电子光谱学并应用于化学分析 ★ R.R.Ernst (瑞士) 化学奖 1991 发展高分辨核磁共振波谱学方法 ★ A.Zewail(美籍埃及人) 化学奖 1999 利用激光闪烁研究化学反应

第8章电位分析与离子选择性电极 8.1概述 8.2参比电极及其构成 8.3指示电极 8.4电位测定法 8.5电位滴定
第8章 电位分析与离子选择性电极 8.1 概述 8.2 参比电极及其构成 8.3 指示电极 8.4 电位测定法 8.5 电位滴定

8.1概述 1.定义 电位分析:通常是由指示电极、参比电极和待测溶液构成原电池,直接 测量电池电动势并利用Nernst公式来确定物质含量的方法。 2.分类: 直接电位法:测定原电池的电动势或电极电位,利用Nernst]方程直接 求出待测物质含量的方法。 电位滴定法:向试液中滴加可与被测物发生氧化还原反应的试剂,以 电极电位的变化来确定滴定终点,根据滴定试剂的消耗量间接计算待 测物含量的方法
8.1概述 1.定义 电位分析:通常是由指示电极、参比电极和待测溶液构成原电池,直接 测量电池电动势并利用Nernst公式来确定物质含量的方法。 2. 分类: 直接电位法:测定原电池的电动势或电极电位,利用Nernst方程直接 求出待测物质含量的方法。 电位滴定法:向试液中滴加可与被测物发生氧化还原反应的试剂,以 电极电位的变化来确定滴定终点,根据滴定试剂的消耗量间接计算待 测物含量的方法

8.2参比电极 定义:与被测物质无关、电位已知且稳定,称为参比电极。标准氢电极可用作 测量标准电极电位的参比电极。但因该种电极制作麻烦、使用过程中要使用氢 气,因此,在实际测量中,常用其它参比电极来代替。 一、甘汞电极(Calomel electrode) 定义:甘汞电极由汞、Hg2Cl,和已知浓度(0.1,3.5,4.6M0的KC溶液组成。 电极组成:Hg Hg2CI2,KCIM0川;如下图所示。 电极反应:HgCl2+2e=2Hg(0+2Ct 电极电位: 9=9,+ 059g”室=,+009 -lg- g0=p,+0.059g p 2 p=Po-0.0591g aa- 可见,电极电位与C的活度或浓度有关。当C浓度不同时,可得到具有不同电 极电位的参比电极。(注意:饱和甘汞电极指KC1浓度为4.60
8.2 参比电极 定义:与被测物质无关、电位已知且稳定,称为参比电极。标准氢电极可用作 测量标准电极电位的参比电极。但因该种电极制作麻烦、使用过程中要使用氢 气,因此,在实际测量中,常用其它参比电极来代替。 一、甘汞电极(Calomel electrode) 定 义:甘汞电极由汞、Hg2Cl2和已知浓度(0.1, 3.5, 4.6M)的KCl溶液组成。 电极组成:Hg Hg2Cl2 ,KCl(xM);如下图所示。 电极反应:Hg2Cl2 (s) + 2e == 2Hg(l) + 2Cl- 电极电位: 可见,电极电位与Cl-的活度或浓度有关。当Cl-浓度不同时,可得到具有不同电 极电位的参比电极。(注意:饱和甘汞电极指KCl 浓度为4.6M) − − + + = − = + = + = + Cl ' 0 2 Cl s p,Hg Cl 2 0 Hg 0 Hg Hg 0 0.059 l g a ( a ) K l g a 0.059 l g 2 0.059 a a l g 2 0.059 2 2 2 2 2 2
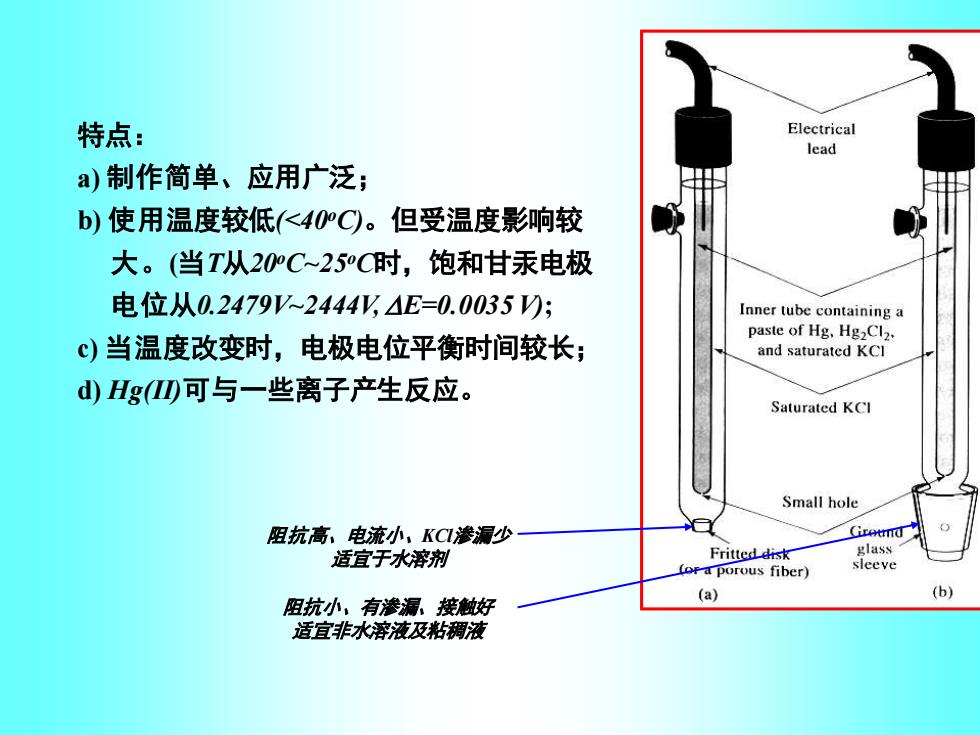
特点: Electrical lead a)制作简单、应用广泛; b)使用温度较低(<40C。但受温度影响较 大。(当T从20C~25C时,饱和甘汞电极 电位从0.2479V2444y4E=0.0035☑; Inner tube containing a c)当温度改变时,电极电位平衡时间较长; paste of Hg,Hg2Cl2. and saturated KCl d)Hg⑩可与一些离子产生反应。 Saturated KCl Small hole 阻抗高,电流小,KC1渗漏少 Giretmd 适宜于水溶剂 Fritted disk glass Lor a porous fiber) sleeve 阻抗小,有渗漏。接触好 (a) (b) 适宜非水溶液及粘稠液
特点: a) 制作简单、应用广泛; b) 使用温度较低(<40oC)。但受温度影响较 大。(当T从20oC~25oC时,饱和甘汞电极 电位从0.2479V~2444V,E=0.0035V); c) 当温度改变时,电极电位平衡时间较长; d) Hg(II)可与一些离子产生反应。 阻抗高、电流小、KCl渗漏少 适宜于水溶剂 阻抗小、有渗漏、接触好 适宜非水溶液及粘稠液

二、Ag/AgC电极 定义:该参比电极由插入用AgC1饱和的一定浓度(饱和KC溶 液)的KC1溶液中构成。 电极组成:Ag AgCL,cMKC 电极反应:AgCl+e=Ag+CL 电极电位:p=pg14-0.059 lg dcr 构 成:同甘汞电极,只是将甘汞电极内管中的(Hg,HgC12+饱和KC 换成涂有AgC的银丝即可。 特点: a可在高于60C的温度下使用; b)较少与其它离子反应(但可与蛋白质作用并导致与待测物界面的堵塞)
二、Ag/AgCl电极 定 义:该参比电极由插入用AgCl饱和的一定浓度(如饱和KCl溶 液)的 KCl 溶液中构成。 电极组成:Ag AgCl,(xM)KCl 电极反应:AgCl+ e == Ag + Cl- 电极电位: 构 成:同甘汞电极,只是将甘汞电极内管中的(Hg,Hg2Cl2+饱和KCl) 换成涂有AgCl的银丝即可。 特 点: a) 可在高于60oC的温度下使用; b) 较少与其它离子反应(但可与蛋白质作用并导致与待测物界面的堵塞) = + − − Cl o Ag Ag 0.059lg a /

三、参比电极使用注意事项 1)电极内部溶液的液面应始终高于试样溶液液面!(防止试样对内部 溶液的污染或因外部溶液与Ag+,Hg+发生反应而造成液接面的堵 塞,尤其是后者,可能是测量误差的主要来源) 2)上述试液污染有时是不可避免的,但通常对测定影响较小。但如果 用此类参比电极测量K+,Ct,Ag+,Hg+时,其测量误差可能会 较大。这时可用盐桥(不含干扰离子的KNO或NaSO)来克服
三、参比电极使用注意事项 1)电极内部溶液的液面应始终高于试样溶液液面!(防止试样对内部 溶液的污染或因外部溶液与Ag+ 、Hg2+发生反应而造成液接面的堵 塞,尤其是后者,可能是测量误差的主要来源) 2)上述试液污染有时是不可避免的,但通常对测定影响较小。但如果 用此类参比电极测量K+ 、Cl-、Ag+ 、Hg2+时,其测量误差可能会 较大。这时可用盐桥(不含干扰离子的KNO3或Na2SO4 )来克服

8.3指示电极 指示电极:电极电位随被测电活性物质活度变化的电极。 8.3.1金属一金属离子电极: (MM+) 电极反应: Mn++ne台M 电极电位: 0=0°M+1M+ 0.0592 2 lg a y 要 求:paM"+M>0,如C,Ag,H等;其它元素,如2n,Cd,In,T S,虽然它们的电极电位较负,因氢在这些电极上的超电位较大,仍可 做一些金属离子的指示电极
8.3 指示电极 指示电极:电极电位随被测电活性物质活度变化的电极。 8.3.1 金属—金属离子电极: (M Mn+) 电极反应: 电极电位: 要 求:0 (M n+ /M)> 0, 如Cu, Ag, Hg 等;其它元素,如Zn, Cd, In, Tl, Sn, 虽然它们的电极电位较负,因氢在这些电极上的超电位较大,仍可 做一些金属离子的指示电极。 M ne M n+ + + = + + n n M M M o a z lg 0.0592 /