
第四章酸碱滴定法 4,1酸减平衡理论基础 4.2不同PH溶液中酸碱存在形式的分布情况 分布曲线 4.3酸碱溶液的PH计算 44酸减滴定终点的指示方法 45一元酸减滴定 46,多元酸混合酸多元碱的滴定 47酸减商定法应用示何 48西酸茶渔溶液配制和标端 4.9酸碱滴定法结果计算示例 410非水深租中的商定要求
1 第四章 酸碱滴定法 4.1 酸碱平衡理论基础 4.2 不同PH溶液中酸碱存在形式的分布情况—— 分布曲线 4.3 酸碱溶液的PH计算 4.4 酸碱滴定终点的指示方法 4.5 一元酸碱滴定 4.6 多元酸混合酸多元碱的滴定 4.7 酸碱滴定法应用示例 4.8 酸碱标准溶液的配制和标定 4.9 酸碱滴定法结果计算示例 4.10 非水溶剂中的酸碱滴定(不要求)

4.1酸碱平衡理论基础 4.1.1质子理论 酸 共轭碱 质子 Proton donor Proton acceptor Proton HAc Ac- + H中 NH NH3 + H中 HCO3 C032 + H 酸碱半反应 H6Y2+ HsY+ + H 通式:HA A + H 共轭酸 碱 + 质子 2
2 4.1 酸碱平衡理论基础 4.1.1 质子理论 酸 共轭碱 + 质子 Proton donor Proton acceptor Proton HAc Ac- + H+ NH4 + NH3 + H+ HCO3 - CO3 2- + H+ H6Y2+ H5Y+ + H+ 通式: HA A + H+ 共轭酸 碱 + 质子 酸 碱 半 反 应

例:HAc在水中的离解反应(p53) 半反应1: HAc Ac+H+ 半反应2:H++H20产 H3Ot+Ac 总反应:HAc+H20= Ac H3O 简写为: HAc Ac-+H+ 酸碱反应的实质是质子转移 3
3 例: HAc在水中的离解反应(p53) 半反应1: HAc Ac- + H+ 半反应2: H+ + H2O H3O+ + Ac- 总反应: HAc + H2O Ac- + H3O+ 简写为: HAc Ac- + H+ 酸碱反应的实质是质子转移
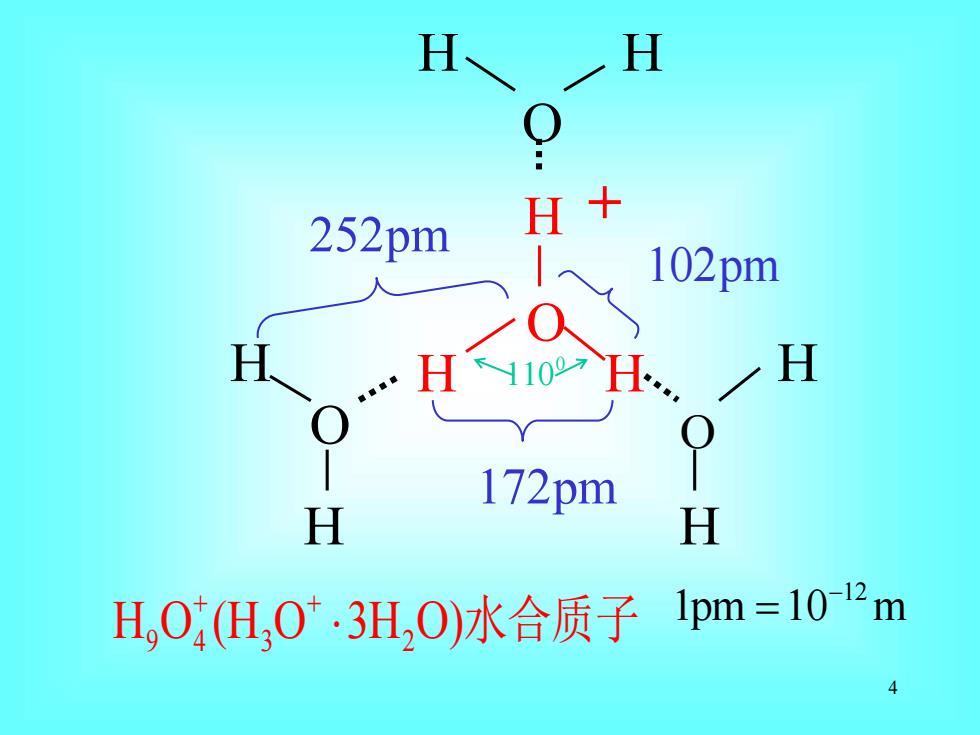
H H 252pm H+ >0 102pm H H110 H H 172pm H H H,O,(H,0.3H,O)水合质子1pm=102m
4 O H O H H O H H H H H H O 0 110 172pm 252pm 102pm + + H O (H O 3H O) 9 4 3 2 水合质子 12 1pm 10 m − = +
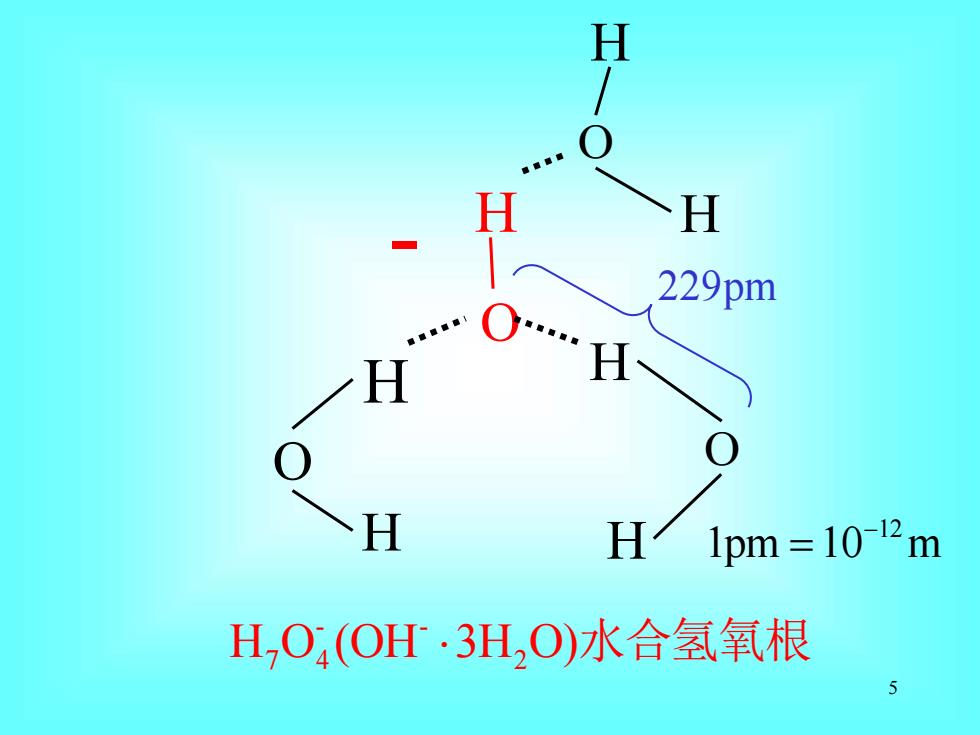
H H H 229pm H H H/1pm=102m H,O(OH·3H,O)水合氢氧根 5
5 H O H H O O O H H H H 229pm - - H O (OH 3H O) 7 4 2 水合氢氧根 12 1pm 10 m − = -
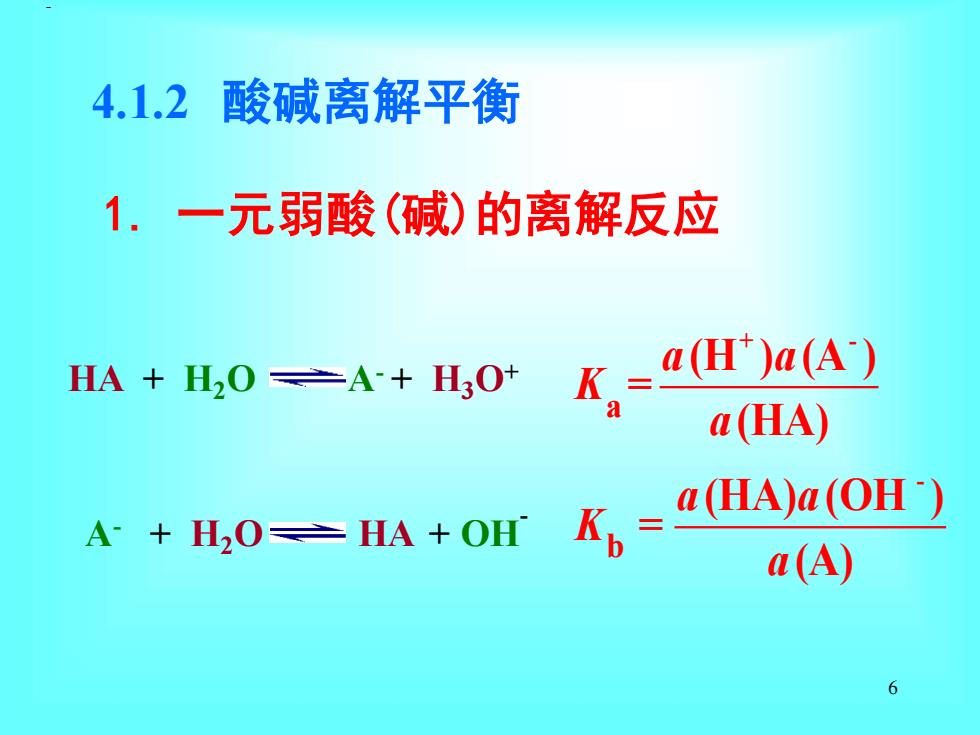
4.1.2i 酸碱离解平衡 1.一元弱酸(碱)的离解反应 HA+H0产A+H0】 K.=(H)a(A) a(HA) A+H20≥HA+OHf1 =4(HA)a(OH) a(A) 6
6 4.1.2 酸碱离解平衡 1. 一元弱酸(碱)的离解反应 + - - a b (H ) (A ) = (HA) (HA) (OH ) (A) a a K a a a K = a HA + H2O A- + H3O+ A- + H2O HA + OH- −

2.水的质子自递反应 H2O+H2OH3O++OH (25°C) Kw=a(H)a(OH)=1.0×1014 共轭酸碱对HA-A)的K,与K的关系为 K瓜,-aH.aOD-k (公) pKa pKp=pKw=14.00 7
7 H2O + H2O H3O+ + OH- (25°C) 14 00 p p p . K K K a b w + = = 14 w (H ) (OH ) 1.0 10 + - - K a a = = + a b w (H ) (A) (HA) (OH ) (HA) (A) a a a a K K K a a − = = 共轭酸碱对(HA-A)的Ka与Kb的关系为 2. 水的质子自递反应
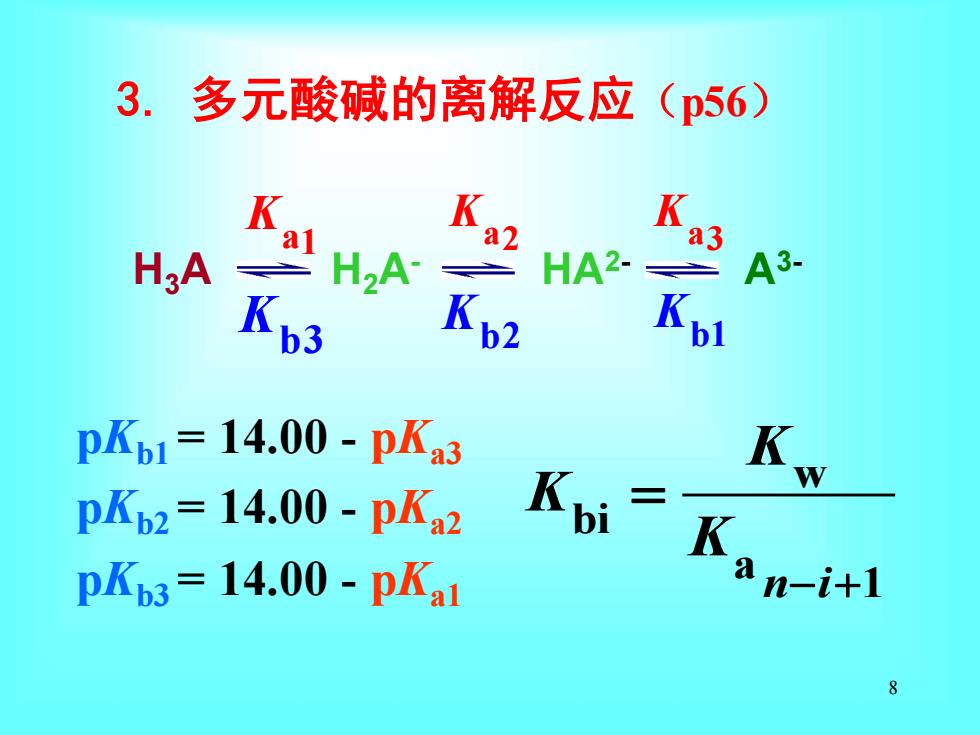
3.多元酸碱的离解反应(p56) Ka2 Ka3 H3A H2A HA2- A3- 飞3 Kp2 Kpl pKb1=14.00-pKa3 Kw pKb2=14.00-pKa2 pKb3=14.00-pKa1 8
8 pKb1 = 14.00 - pKa3 pKb2 = 14.00 - pKa2 pKb3 = 14.00 - pKa1 w bi a n i 1 K K K − + = 3. 多元酸碱的离解反应(p56) a1 K a2 K a3 K b1 K b2 K b3 K H3A H2A- HA2- A3-
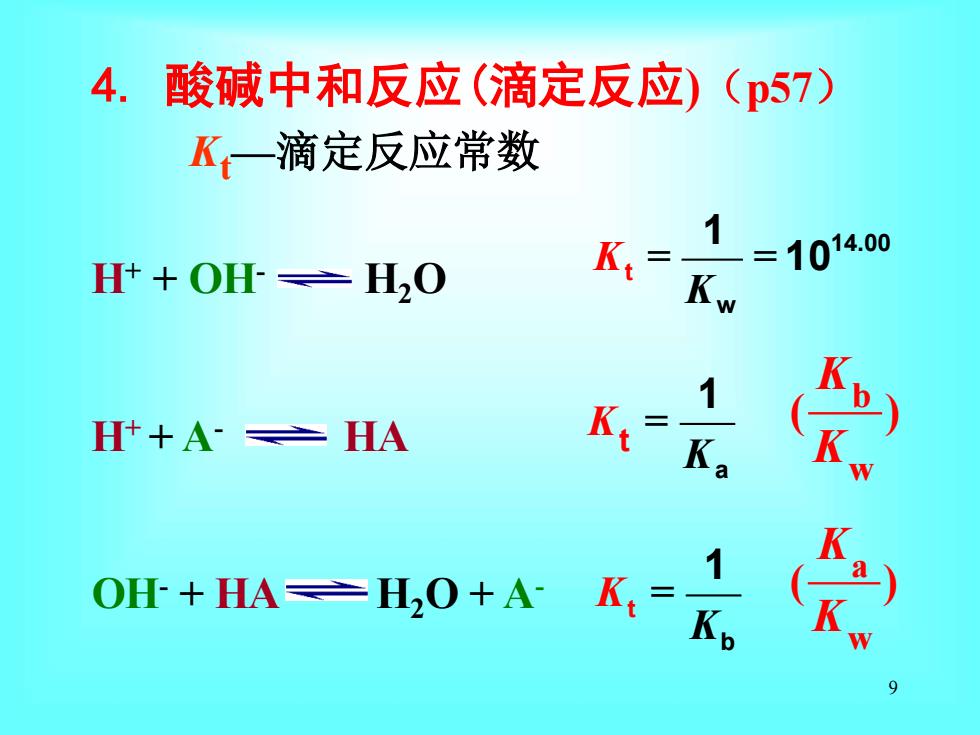
4.酸碱中和反应(滴定反应)(p57) K—滴定反应常数 Ht+O旺=H20 =10140 K:-Kw Ht+A:≥HA K Ka 0+=,0+冬太名
9 4. 酸碱中和反应(滴定反应)(p57) Kt—滴定反应常数 H+ + OH- H2O H+ + A- HA OH- + HA H2O + A- 1 t 4.00 w 1 K = = 10 K b w ( ) K K b t 1 K = K a t 1 K = K a w ( ) K K
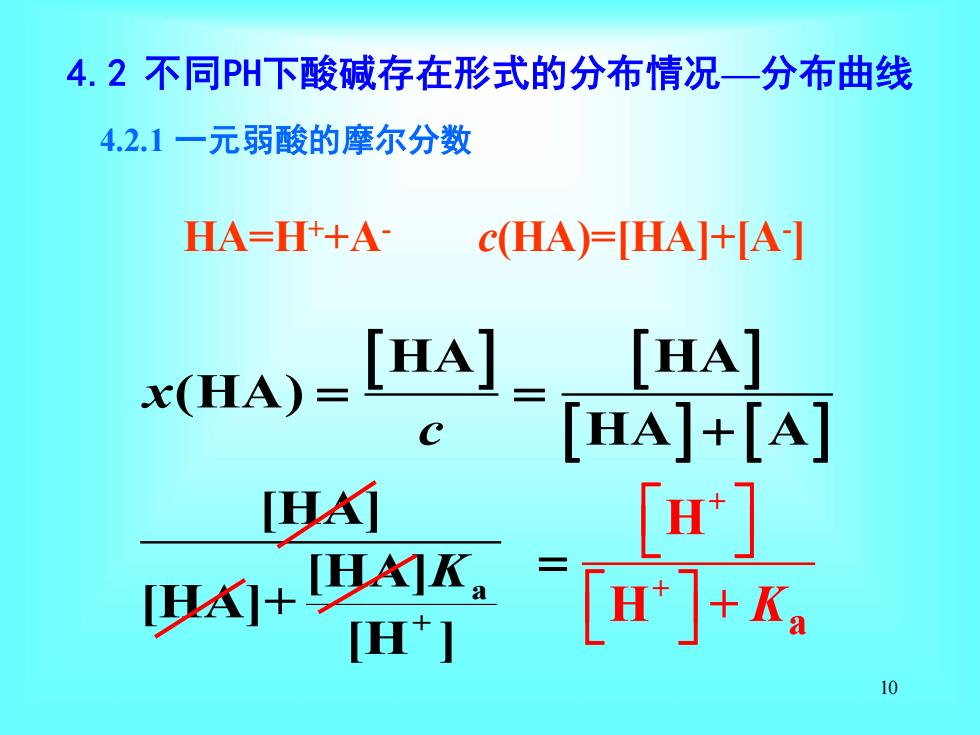
4.2不同PH下酸碱存在形式的分布情况一分布曲线 4.2.1一元弱酸的摩尔分数 HA=H++A- C(HA)=HA+A] [HA] [HA]+[A] 的 [H] [HAI+[HAIK, H*I H+Ka 10
10 a + HA HA (HA) HA A [HA] [HA] [HA]+ [H ] x c K = = + 4.2.1 一元弱酸的摩尔分数 4.2 不同PH下酸碱存在形式的分布情况—分布曲线 HA=H++A- c(HA)=[HA]+[A- ] + + a H H + K =