
5.4.2 强碱滴定弱酸
5.4.2 强碱滴定弱酸

NaOH滴定HAc 以0.1000mo/L NaOI滴定20.00mL 0.1000mol/LHAc为例,讨论强碱滴定弱 酸的滴定曲线和指示剂的选择。 0000000
NaOH滴定HAc • 以 0.1000mol/L NaOH 滴 定 20.00mL 0.1000mol/L HAc为例,讨论强碱滴定弱 酸的滴定曲线和指示剂的选择

1、滴定开始前 滴定前 溶液是0.1000mol/L的HAc溶液, 溶液中H+离子浓度为: [H*]=VcK,=V1.8x10x0.1000 =1.34×103mo1/ pH=2.87
1、滴定开始前 滴定前 溶液是0.1000mol/L的HAc溶液, 溶液中H+离子浓度为: pH = 2.87 [ ] 1.8 10 0.1000 5 = = + − a H cK 1.34 10 mol / L −3 =

2、滴定开始至化学汁量点前 溶液中未反应的HAc和反应产物Ac同时存在 组成一个缓冲体系。 一 般可以按如下计算:pH=pKa+lg(CAc-/CHAc 例如,当滴入NaOH溶液19.80mL时,有: 0.20 CHAC ×0.1000=5:03×10-4mol/Z 20.00+19.80 19.80 CAc- ×0.1000=4.97x10-2mol/L 20.00+19.80 代入上式得 H=4.74+1g[(4.97×10-2)/(5.03×104)1=6.73 ●
2、滴定开始至化学计量点前 溶液中未反应的HAc和反应产物Ac-同时存在, 组成一个缓冲体系。 一般可以按如下计算:pH = pKa + lg(cAc- -/cHAc) 例如,当滴入NaOH溶液19.80mL时,有: cHAc 0.1000 5.03 10 mol / L 20.00 19.80 0.20 −4 = + = cA c 0.1000 4.97 10 mol / L 20.00 19.80 19.80 −2 = + − = 代入上式得 : pH= 4.74 + lg[(4.97×10-2)/(5.03×10-4)] = 6.73

2、 滴定开始至化学计量点前(续) 同理,可以计算加入NaOH溶液为 19.98mL时,溶液的pH值为: pH=pKa+1g(CAe-/CHA) 0.02 CHAc ×0.1000=5.00×10-5mol/L 20.00+19.98 19.98 CAc- ×0.1000=5.00×102mol/Z 20.00+19.98 pH=7.74 此时,仅剩余0.02 ml HAc未反应。 000000000
2、滴定开始至化学计量点前(续) • 同理,可以计算加入NaOH溶液为 19.98mL时,溶液的pH 值为: pH = pKa + lg(cAc-/cHAc) c HAc 0.1000 5.00 10 mol / L 20.00 19.98 0.02 −5 = + = cA c 0.1000 5.00 10 mol / L 20.00 19.98 19.98 −2 = + − = 此时,仅剩余0.02ml HAc未反应。 pH=7.74

3、化学计量点时 已滴入NaOH20.00mL,此时全部HAc被中和 生成NaAc。由于Ac一是弱碱,根据它在溶液中的 离解平衡,可求得: [OH ]=ckp V0.0500×10-1471.8×103)=5.27×106 p0H=5.28 pH=8.72 可见,化学计量点的H值大于7,溶液显弱碱性
3、化学计量点时 已滴入NaOH 20.00mL,此时全部 HAc被中和, 生成 NaAc。由于Ac-是弱碱,根据它在溶液中的 离解平衡,可求得: 可见,化学计量点的pH值大于7,溶液显弱碱性。 b OH = cK − [ ] ( ) 1 4 5 6 0.0500 10 / 1.8 10 5.27 10 − − − = = pOH=5.28 pH=8.72

4、化学计量点后 由于过量的NaOH的存在,抑制了醋酸根 离子的离解,此时溶液的pH值主要取决于过 量的NaOH浓度,其计算方法与前相同。 例如,已滴入Na0H溶液20.02mL(过量0.02 mL),此时pH值可以计算如下: 0.02 [OH]= ×0.1000=50×10-5mol/Z 20.00+20.02 pOH=4.30 pH=9:7 如此逐一计算,可得一系列计算结果如下表所示: ●●●●●●
4、化学计量点后 由于过量的 NaOH 的存在,抑制了醋酸根 离子的离解,此时溶液的 pH 值主要取决于过 量的NaOH浓度,其计算方法与前相同。 例如,已滴入NaOH溶液20.02mL(过量0.02 mL),此时pH值可以计算如下: OH 0.1000 5.0 10 mol / L 20.00 20.02 0.02 [ ] − −5 = + = 如此逐一计算,可得一系列计算结果如下表所示: pOH=4.30 pH=9.7

用0.1000mol/1LNa0H滴定20.00ml0.1000mo/1 HAc计算数据列表 加入体积 中和百分数 过量体积 pH值 (mL) (mL) 0.00 0.00 2.87 18.00 90.00 5.70 19.80 99.00 6.73 19.98 99.90 7.74 20.00 100.0 8.72 20.02 100.1 0.02 9.70 20.20 101.0 0.20 10.70 22.00 110.0 2.00 11.70 00●● 40.00 200.0 20.00 12.50 00000000000000000000
表 加入体积 (mL) 中和百分数 过量体积 (mL) pH值 0.00 0.00 2.87 18.00 90.00 5.70 19.80 99.00 6.73 19.98 99.90 7.74 20.00 100.0 8.72 20.02 100.1 0.02 9.70 20.20 101.0 0.20 10.70 22.00 110.0 2.00 11.70 40.00 200.0 20.00 12.50 用0.1000mol/L NaOH 滴定20.00mL0.1000mol/L HAc 计算数据列表

强碱滴定弱酸滴定曲线(一) 从表和图中可以看出: 12 滴定前0.1000mo/L的HAc 10h 比等浓度的HCI pH值约 酚酞 大2个pH单位。这是由于 8 HAc的离解度要比等浓度 6 的HCI小的缘故。 HAc 滴定开始后,曲线的坡度比 滴定HCI时更倾斜,继续 HCI 滴入NaOH,由于NaAc的 生成,构成了缓冲体系, 10 20 30 40 溶液的pH值增加缓慢, VNaOH/mL 这一段曲线较为平坦。 0
5、强碱滴定弱酸滴定曲线(一) 从表和图中可以看出: 滴定前0.1000 mol/L 的HAc 比等浓度的HCl pH值约 大2个pH单位。这是由于 HAc的离解度要比等浓度 的HCl 小的缘故。 滴定开始后,曲线的坡度比 滴定HCl 时更倾斜,继续 滴入NaOH,由于NaAc的 生成,构成了缓冲体系, 溶液的 pH 值增加缓慢, 这一段曲线较为平坦
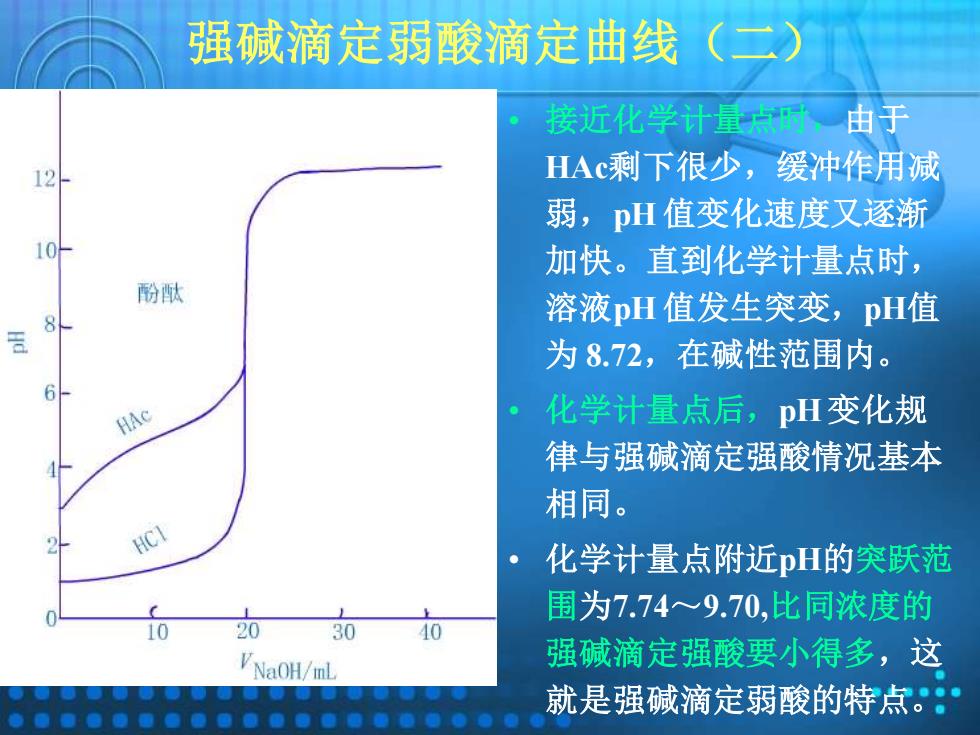
强碱滴定弱酸滴定曲线 (二) 接近化学计量点时由于 HAc剩下很少,缓冲作用减 弱,pH值变化速度又逐渐 加快。直到化学计量点时, 酚酞 溶液pH值发生突变,pH值 为8.72,在碱性范围内。 HAc 化学计量点后,pH变化规 律与强碱滴定强酸情况基本 相同。 HCI 化学计量点附近pH的突跃范 围为7.74~9.70,比同浓度的 10 20 30 40 VNaOH/mL 强碱滴定强酸要小得多,这 就是强碱滴定弱酸的特点。:
强碱滴定弱酸滴定曲线(二) • 接近化学计量点时,由于 HAc剩下很少,缓冲作用减 弱,pH 值变化速度又逐渐 加快。直到化学计量点时, 溶液pH 值发生突变,pH值 为 8.72,在碱性范围内。 • 化学计量点后,pH 变化规 律与强碱滴定强酸情况基本 相同。 • 化学计量点附近pH的突跃范 围为7.74~9.70,比同浓度的 强碱滴定强酸要小得多,这 就是强碱滴定弱酸的特点