
第十章伏安分析法(voltammetry) 10-1极谱分析的基本原理 10-2极谱定量分析 10-3极谱分析特点及其存在问题 10-4现代极谱 10-5极谱应用实例
第十章 伏安分析法(voltammetry) 10-1 极谱分析的基本原理 10-2 极谱定量分析 10-3 极谱分析特点及其存在问题 10-4 现代极谱 10-5 极谱应用实例

10-1极谱分析的基本原理 伏安法是以测定电解过程中电流-电压曲线(伏安曲 线)为基础的一大类电化学分析方法。它是一类应用广泛而 重要的电化学分析方法。极谱分析属于伏安法,它以滴汞电 极为工作电极,也称极谱法
10-1 极谱分析的基本原理 伏安法是以测定电解过程中电流-电压曲线(伏安曲 线)为基础的一大类电化学分析方法。它是一类应用广泛而 重要的电化学分析方法。极谱分析属于伏安法,它以滴汞电 极为工作电极,也称极谱法
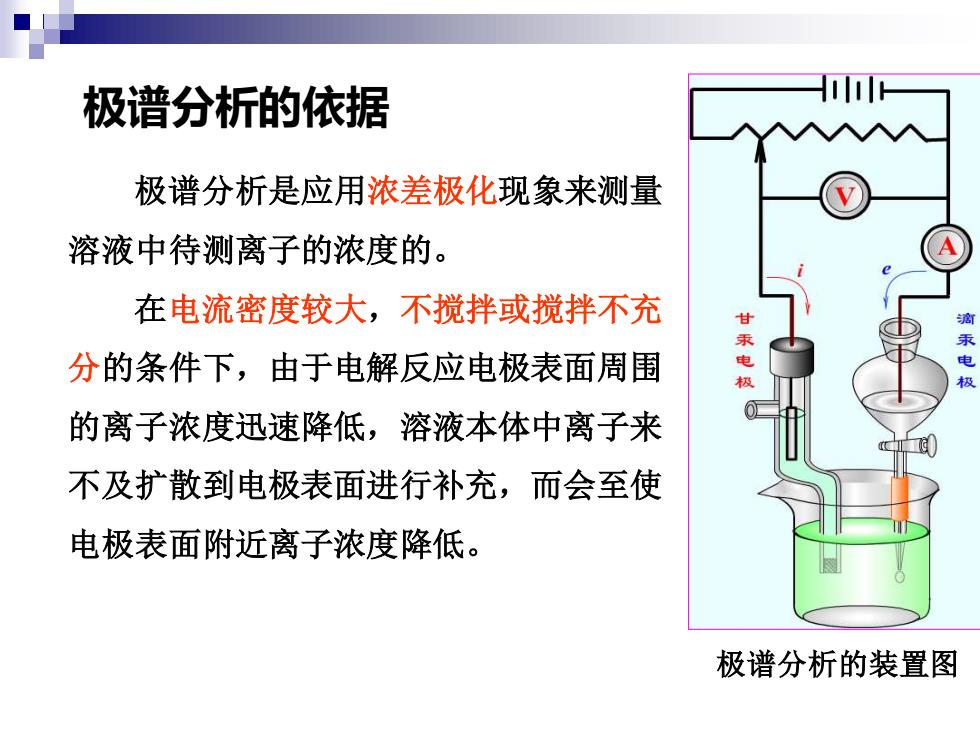
极谱分析的依据 极谱分析是应用浓差极化现象来测量 溶液中待测离子的浓度的。 在电流密度较大,不搅拌或搅拌不充 甘 分的条件下,由于电解反应电极表面周围 极 的离子浓度迅速降低,溶液本体中离子来 不及扩散到电极表面进行补充,而会至使 电极表面附近离子浓度降低。 极谱分析的装置图
极谱分析的依据 极谱分析的装置图 极谱分析是应用浓差极化现象来测量 溶液中待测离子的浓度的。 在电流密度较大,不搅拌或搅拌不充 分的条件下,由于电解反应电极表面周围 的离子浓度迅速降低,溶液本体中离子来 不及扩散到电极表面进行补充,而会至使 电极表面附近离子浓度降低

由于电极附近待测离子浓度的降低而使电极电位偏离原 来的平衡电位的现象称为极化现象。这种由于电解时在电极 表面的浓度差异而引起的极化现象称为浓差极化。 当外加电压较大时,电极表面周围的待测离子浓度会降 为零。此时电流不会随外加电压的变化而变化,而完全由待 测离子从溶液本体向电极表面的扩散速度决定,并达到一个 极限值,称为极限电流。这时有电流-离子浓度的关系,这 就是极谱分析的依据
由于电极附近待测离子浓度的降低而使电极电位偏离原 来的平衡电位的现象称为极化现象。这种由于电解时在电极 表面的浓度差异而引起的极化现象称为浓差极化。 当外加电压较大时,电极表面周围的待测离子浓度会降 为零。此时电流不会随外加电压的变化而变化,而完全由待 测离子从溶液本体向电极表面的扩散速度决定,并达到一个 极限值,称为极限电流。这时有电流-离子浓度的关系,这 就是极谱分析的依据

滴汞电极 在极谱分析中常用滴汞电极(如右图)。它 具有如下特点: 1)电极毛细管口处的汞滴很小,易形成浓差极化; 2)汞滴不断滴落,使电极表面不断更新,重复性好 。 (受汞滴周期性滴落的影响,汞滴面积的变化使 电流呈快速锯齿性变化); 3)氢在汞上的超电位较大; 4)金属与汞生成汞齐,降低其析出电位,使碱金属和 碱土金属也可分析
滴汞电极 在极谱分析中常用滴汞电极(如右图)。它 具有如下特点: 1)电极毛细管口处的汞滴很小,易形成浓差极化; 2)汞滴不断滴落,使电极表面不断更新,重复性好 。(受汞滴周期性滴落的影响,汞滴面积的变化使 电流呈快速锯齿性变化); 3)氢在汞上的超电位较大; 4)金属与汞生成汞齐,降低其析出电位,使碱金属和 碱土金属也可分析
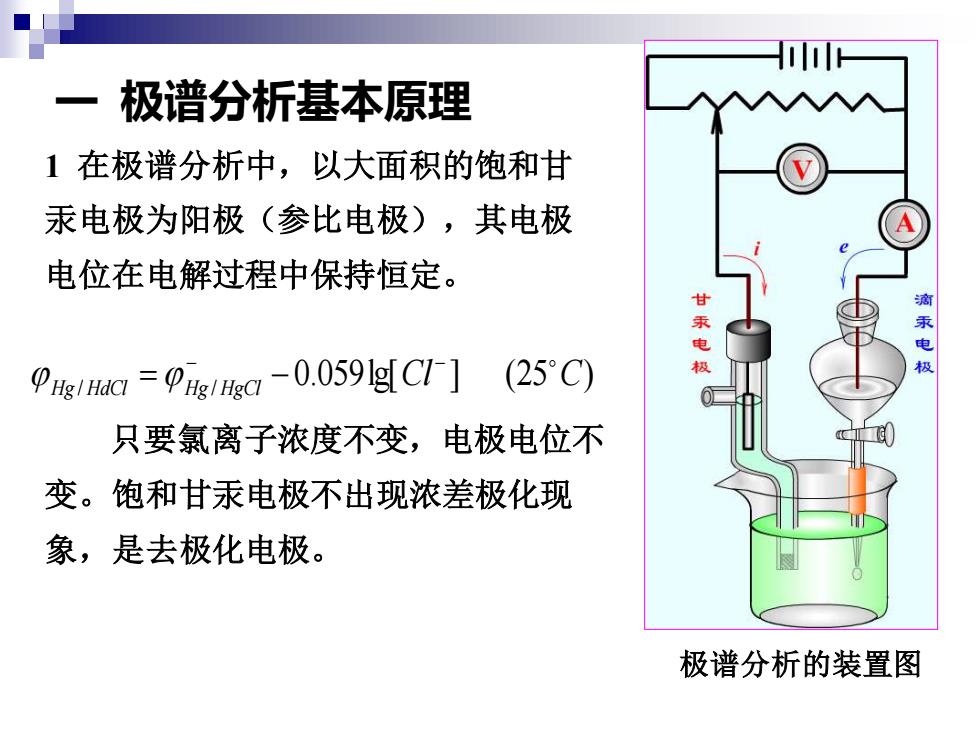
极谱分析基本原理 1在极谱分析中,以大面积的饱和甘 汞电极为阳极(参比电极),其电极 电位在电解过程中保持恒定。 滴 电 PIH=-0.0591g[CI-](25C) 极 只要氯离子浓度不变,电极电位不 变。饱和甘汞电极不出现浓差极化现 象,是去极化电极。 极谱分析的装置图
一 极谱分析基本原理 极谱分析的装置图 0.059lg[ ] (25 ) Hg / HdCl Hg / HgCl Cl C − − = − 1 在极谱分析中,以大面积的饱和甘 汞电极为阳极(参比电极),其电极 电位在电解过程中保持恒定。 只要氯离子浓度不变,电极电位不 变。饱和甘汞电极不出现浓差极化现 象,是去极化电极

2 以滴汞电极为阴极(工作电极),其电位完全由外加 电压控制。 由电路关系得:V外=p。-p。+迟 '外-外加电压 i-电流 p。-阳极电位 R-电路中电阻 p。-阴极电位 极谱分析中电流很小,故R项可忽略:V外=pa一p。 因φ(SCE)电位恒定,可作为参比标准,规定为pa=0, 则有: V外=-p。(对SCE)
2 以滴汞电极为阴极(工作电极),其电位完全由外加 电压控制。 由电路关系得: 极谱分析中电流很小,故iR项可忽略: V外 = a − c 阴极电位 阳极电位 电路中电阻 外 外加电压 电流 外 − − − − − = − + c a a c R V i V iR 因a (SCE) 电位恒定,可作为参比标准,规定为a=0 , 则有: V外 = - c (对SCE)
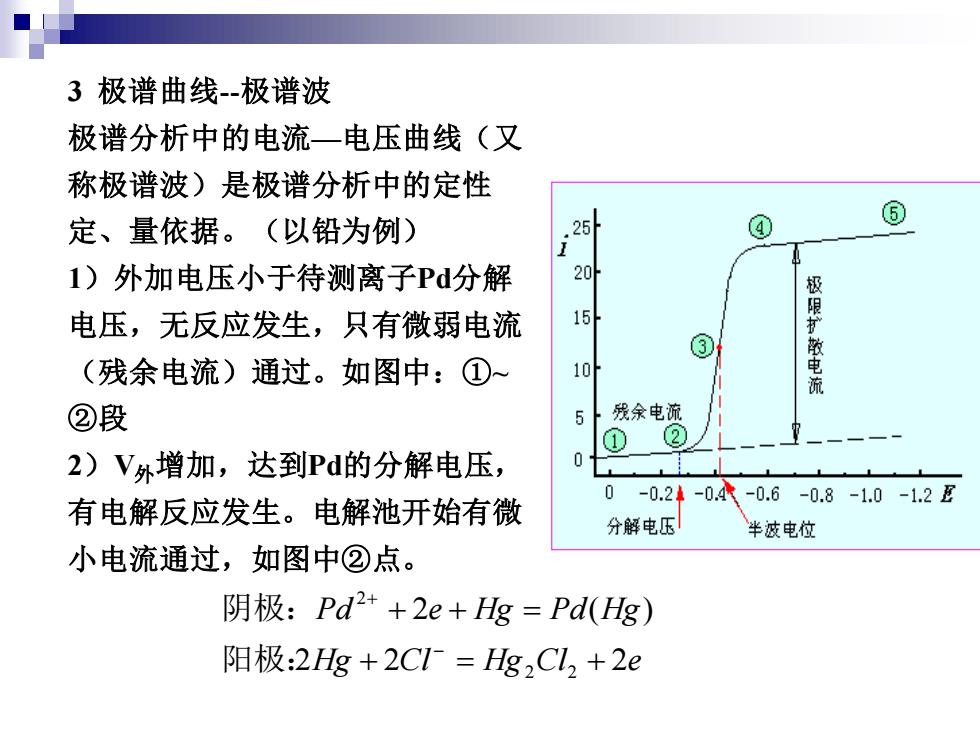
3极谱曲线-极谱波 极谱分析中的电流一电压曲线(又 称极谱波)是极谱分析中的定性 定、量依据。(以铅为例) ④ ⑥ 1)外加电压小于待测离子Pd分解 20 电压,无反应发生,只有微弱电流 限扩 ③ (残余电流)通过。如图中:① 10 教电 ②段 5 残余 ① ② 2)V外增加,达到Pd的分解电压, 0 0 -0.24 -0.4-0.6-0.8-1.0-1.2E 有电解反应发生。电解池开始有微 分解电压 半波电位 小电流通过,如图中②点。 阴极:Pd2++2e+Hg=Pd(Hg) 阳极:2Hg+2C1=Hg,Cl2+2e
3 极谱曲线-极谱波 极谱分析中的电流—电压曲线(又 称极谱波)是极谱分析中的定性 定、量依据。(以铅为例) 1)外加电压小于待测离子Pd分解 电压,无反应发生,只有微弱电流 (残余电流)通过。如图中:①~ ②段 2)V外增加,达到Pd的分解电压, 有电解反应发生。电解池开始有微 小电流通过,如图中②点。 Hg Cl Hg Cl e Pd e Hg Pd Hg 2 2 2 2 ( ) 2 2 2 + = + + + = − + 阳极: 阴极:

3)V外继续增大,电解反应加刷,电解池中电流也加剧,如 图中②~④段。此时,滴汞电极汞滴周围的P2+浓度迅速 下降而低与溶液本体中的Pd+浓度,于是溶液本体中Pd2+ 向电极表面扩散以是电解反应继续进行。这种P+不断扩 散,不断电解而形成电流称为扩散电流。这时在溶液本体 与电极表面之间形成一扩散层。 设扩散层内电极表面上Pd2+浓度为C0,扩散层外与 溶液本体中P2+浓度相同为C。则浓度梯度为: 电极表面 C-Co δ8 又因为:ir版x扩散速度x(C-C9 所以 扩散=k(C-C)
3)V外继续增大,电解反应加剧,电解池中电流也加剧,如 图中②~④段。此时,滴汞电极汞滴周围的Pd2+浓度迅速 下降而低与溶液本体中的Pd2+浓度,于是溶液本体中Pd2+ 向电极表面扩散以是电解反应继续进行。这种Pd2+不断扩 散,不断电解而形成电流称为扩散电流。这时在溶液本体 与电极表面之间形成一扩散层。 设扩散层内电极表面上Pd2+浓度为C0 ,扩散层外与 溶液本体中Pd2+浓度 相同为C。则浓度梯度为: ( ) ( ) 0 0 0 i k C C C C i C C x C = − − − = 扩散 扩散 电极表面 所以 又因为: 扩散速度 ( )

4)当V外增大到一定值时,C非常小相对C而言可忽略, 电流大小完全为溶液中待测离子浓度控制,如同中④⑤ 段,有:ia=kC i4一极限扩散电流 可见,极限电流与溶液中待测离子浓度呈正比。这是 极谱分析的定量基础。极谱图上的极限电流不完全由浓差 极化而得,它还包括残余电流(),因此极限电流减去 残余电流即得到极限扩散电流(id)。 极谱图上扩散电流为极限扩散电流一般时的滴汞电极 的电位为半波电位(E1/2)。当溶液的组成和温度一致时, 每种物质的半波电位是一定的,不随其浓度的变化而变化, 这是定性的依据
4)当V外增大到一定值时,C0非常小 相对C而言可忽略, 电流大小完全为溶液中待测离子浓度控制,如同中④~⑤ 段,有: −极限扩散电流 = d d i i k C 可见,极限电流与溶液中待测离子浓度呈正比。这是 极谱分析的定量基础。极谱图上的极限电流不完全由浓差 极化而得,它还包括残余电流(ir ),因此极限电流减去 残余电流即得到极限扩散电流(id )。 极谱图上扩散电流为极限扩散电流一般时的滴汞电极 的电位为半波电位(E1/2 )。当溶液的组成和温度一致时, 每种物质的半波电位是一定的,不随其浓度的变化而变化, 这是定性的依据