呼和浩特职业学院教案首页 课 题第三章固相析出分离技术 授课时间 3.20,3.25 授课对象 2013级生物技术及应用1、2班 授课学时 4 1.了解沉析分离技术的种类 教学目的2.熟悉盐析原理、影响因素及其应用 3.掌握结晶技术的操作及应用 熟悉盐析、有机溶剂沉析、等电点沉析、结晶法等常用沉 教学重点 析分离技术的影响因素及其应用 教学难点 结晶过程控制 教学方法 举例法,比较法,图示法,提问法,作业法,实验法等 (一)组织教学:点名、检查学生的出勤情况(5min) (二)味精生产为导向,导入新课:沉淀与结晶(15min)》 教学步骤 (三)开始讲解(盐析、有机溶剂沉析、等电点沉析、结 及 晶法概念,种类,特点,工艺控制,应用)(150min) 内容提要 (四)小结与思考题(8min) (五)结束本次,学生讨论(2min) 备注
呼和浩特职业学院教案首页 课 题 第三章 固相析出分离技术 授课时间 3.20,3.25 授课对象 2013 级生物技术及应用 1、2 班 授课学时 4 教学目的 1.了解沉析分离技术的种类 2.熟悉盐析原理、影响因素及其应用 3.掌握结晶技术的操作及应用 教学重点 熟悉盐析、有机溶剂沉析、等电点沉析、结晶法等常用沉 析分离技术的影响因素及其应用 教学难点 结晶过程控制 教学方法 举例法,比较法,图示法,提问法,作业法,实验法等 教学步骤 及 内容提要 (一)组织教学:点名、检查学生的出勤情况(5min) (二)味精生产为导向,导入新课:沉淀与结晶(15min) (三)开始讲解(盐析、有机溶剂沉析、等电点沉析、结 晶法概念,种类,特点,工艺控制,应用)(150min) (四)小结与思考题(8min) (五)结束本次,学生讨论(2min) 备注

导入新课: 教学提示 思考味精有规则的几何形状是怎么生产出来的?其它固体是怎么生产出来探究法 的? 第三章固相析出分离技术 口使溶质以固体形式从溶液中沉降析出的分离纯化技术称为固相析出 分离技术。 口固体形式有无定形态固体和品体 口结晶法:在固相析出过程中,析出物为晶体时称为结晶法。 口沉淀法:在固相析出过程中,析出物为无定形固体时则称为沉淀法 原理为重 目前常用的沉析分离技术: 点内容 ▣ 等电点沉淀法 变性沉淀法 口 盐析法 ◇ 有机溶剂沉淀法 反应沉淀法 重点 ◇ 结晶法等 第一节盐析 画图说明 一、盐析原理 盐析是利用不同物质在高浓度的盐溶液中溶解度的差异,向溶液中加入 定量的中性盐,使原溶解的物质沉淀析出的分离技术。 ©÷÷© 品 0"0器票0 2
2 导入新课: 思考-味精有规则的几何形状是怎么生产出来的?其它固体是怎么生产出来 的? 第三章 固相析出分离技术 使溶质以固体形式从溶液中沉降析出的分离纯化技术称为固相析出 分离技术。 固体形式有无定形态固体和晶体。 结晶法:在固相析出过程中,析出物为晶体时称为结晶法。 沉淀法:在固相析出过程中,析出物为无定形固体时则称为沉淀法 目前常用的沉析分离技术: 等电点沉淀法 变性沉淀法 盐析法 有机溶剂沉淀法 反应沉淀法 结晶法等 第一节 盐析 一、盐析原理 盐析是利用不同物质在高浓度的盐溶液中溶解度的差异,向溶液中加入 一定量的中性盐,使原溶解的物质沉淀析出的分离技术。 教学提示 探究法 原理为重 点内容 重点 画图说明

产生盐析的机理 教学提示 1、许多生物产品的分子表面具有很多亲水基团和疏水基团,这些基团按是 否带电荷又可分为极性基团和非极性基团。在溶液中,各种分子、离子之间 的相互作用决定了生物分子的溶解度。 同极相斥 产生盐析的一个原因是溶液加入高浓度中性盐后,盐离子与生物分子表 面的带相反电荷的离子基团结合,中和了生物分子表面的电荷,降低了生物 分子与水分子之间的相互作用,生物分子表面水化膜逐渐被破坏,当盐浓度 达到一定的限度时,生物分子之间的排斥力降到很小,此时生物分子很容易 相互聚集,在溶液中的溶解度降得很低,从而形成沉淀从溶液中析出。 2、产生盐析的另一个原因是大量盐离子自身的水合作用降低了自由水 的浓度,使生物分子脱去了水化膜,暴露出疏水区域,由于疏水区域的相互 作用,使其沉淀析出。 二、用盐的选择 能够产生盐析的盐种类很多,每种盐产生盐析效应的强弱不同。如蛋白 质等生物物质在水中的溶解度不仅与中性盐离子的浓度有关,还与离子所带 电荷数有关。一般认为半径小的高价离子在盐析时效应强,半径大的低价离 子效应则弱。选取盐析用盐应考虑盐析效应强、溶解度大且受温度影响尽可 能小、不影响生物分子的活性、不引入杂质、不给分离或测定带来麻烦、同 时来源丰富及经济等问题。 两类离子盐析效果强弱的经验规律,可供参考。 阴离子:柠檬酸根>酒石酸根>F>IO>HPO:>SO2->CHsCOO CI>CIO;>Br>NO:>CIO>>CNS: 排序为重 点内容 阳离子:Th“>AI>H>Ba2*>Sr2+>Ca2+>Cs>Rb>NH>K*>Na >1+ 盐析中常用的中性盐有(NH)SO4、NaSO4、NaCI、NaH:PO:等, 其中(H)S0,无论是在实验室还是在生产中都是最常用的,在大生产时基 本基本上是惟一可选择的,这是因为硫酸铵具有盐析效应强:溶解度大、受 温度影响小且溶解于水时不产生热量:沉淀后的硫酸铵能重新溶解并用透析、 超滤、层析等方法可除去:高浓度硫酸铵有抑菌作用:廉价、易得、废液可 肥田等特点。但硫酸铵在碱性环境中不能应用(pH>8.0中会释放氨),并有 一定的腐蚀性,应用时应充分考虑。 黑3
3 产生盐析的机理 1、 许多生物产品的分子表面具有很多亲水基团和疏水基团,这些基团按是 否带电荷又可分为极性基团和非极性基团。在溶液中,各种分子、离子之间 的相互作用决定了生物分子的溶解度。 产生盐析的一个原因是溶液加入高浓度中性盐后,盐离子与生物分子表 面的带相反电荷的离子基团结合,中和了生物分子表面的电荷,降低了生物 分子与水分子之间的相互作用,生物分子表面水化膜逐渐被破坏,当盐浓度 达到一定的限度时,生物分子之间的排斥力降到很小,此时生物分子很容易 相互聚集,在溶液中的溶解度降得很低,从而形成沉淀从溶液中析出。 2、产生盐析的另一个原因是大量盐离子自身的水合作用降低了自由水 的浓度,使生物分子脱去了水化膜,暴露出疏水区域,由于疏水区域的相互 作用,使其沉淀析出。 二、用盐的选择 能够产生盐析的盐种类很多,每种盐产生盐析效应的强弱不同。如蛋白 质等生物物质在水中的溶解度不仅与中性盐离子的浓度有关,还与离子所带 电荷数有关。一般认为半径小的高价离子在盐析时效应强,半径大的低价离 子效应则弱。选取盐析用盐应考虑盐析效应强、溶解度大且受温度影响尽可 能小、不影响生物分子的活性、不引入杂质、不给分离或测定带来麻烦、同 时来源丰富及经济等问题。 两类离子盐析效果强弱的经验规律,可供参考。 阴离子:柠檬酸根>酒石酸根>F ->IO3 - >H2PO4 ->SO4 2->CH3COO-> CI->CIO3 ->Br->NO3 ->CIO4 ->I ->CNS-; 阳离子:Th4+>AI3+>H+>Ba2+>Sr2+>Ca2+>Cs+>Rb+>NH4 +>K+>Na+ >Li+ 盐析中常用的中性盐 有(NH4)2SO4、Na2SO4、NaCl、NaH2PO4 等, 其中(NH4)2SO4 无论是在实验室还是在生产中都是最常用的,在大生产时基 本基本上是惟一可选择的,这是因为硫酸铵具有盐析效应强;溶解度大、受 温度影响小且溶解于水时不产生热量;沉淀后的硫酸铵能重新溶解并用透析、 超滤、层析等方法可除去;高浓度硫酸铵有抑菌作用;廉价、易得、废液可 肥田等特点。但硫酸铵在碱性环境中不能应用(pH>8.0 中会释放氨),并有 一定的腐蚀性,应用时应充分考虑。 教学提示 同极相斥 排序为重 点内容

教学提示 硫酸钠具有不含氮的优点,但溶解度较低,尤其在低温下。如在0℃时溶 解度为138gL,30℃时上升为326gL,增加幅度为137%:磷酸盐、柠檬酸 盐有缓冲能力强的优点,但溶解度低,易与某些金属离子生成沉淀,故硫酸 钠、磷酸盐、柠檬酸盐应用远不如硫酸铵广泛。 三、盐析的因素 (一)盐离子浓度 副板书 在低盐浓度时,盐离子能增加生物分子表面电荷,使生物分子水合作用 增强,具有促进溶解的作用,称盐溶现象。当盐浓度达一定值后,盐浓度升高 生物分子溶解度不断降低,产生了盐析作用,不同的生物分子,“盐溶”与“盐 析”的分界值不同。由此可知不同生物分子达“全部盐析”所用盐浓度也不 同。这一点为采用盐析技术分离纯化生物活性成分提供了可能性。 (二)生物分子种类 生物分子的分子结构不同,其分子表面亲水基团与疏水基团不相同,不副板书 同生物分子产生盐析现象所需中性盐的浓度(离子强度)亦不同。例如血浆 中的蛋白质,纤维蛋白原最易析出,硫酸铵的饱和度达到20%即可:饱和度 增加到28%~33%时,优球蛋白析出:饱和度再增加至33%~50%时,拟球 蛋白析出:饱和度大于50%时,白蛋白析出。 硫酸铵的饱和度是指饱和硫酸铵溶液的体积占混合后溶液总体积的百分 数。通常盐析所用中性盐的浓度不以百分浓度或摩尔浓度表示,而多用相对 饱和度来表示,也就是把饱和时的浓度看作1或100%,如1L水在25℃时溶 入了767g硫酸铵固体就是100%饱和,溶入383.5g硫酸铵称半饱和(50%或 0.5饱和度)。例如,一体积的含蛋白溶液加一体积饱和硫酸铵溶液时,饱和 度为50%或0.50,三体积的含蛋白溶液加一体积饱和硫酸铵溶液时,饱和度 为25%或0.25。 (三)生物分子浓度 溶液中生物分子的浓度对盐析的效果有很大的影响,当某种成分析出的 副板书 盐浓度一定时,溶液中生物分子的浓度越高,其他成分就会部分随着沉析的 成分一起析出,即所谓的共沉现象:
4 硫酸钠具有不含氮的优点,但溶解度较低,尤其在低温下。如在 0℃时溶 解度为 138g/L,30℃时上升为 326 g/L,增加幅度为 137%;磷酸盐、柠檬酸 盐有缓冲能力强的优点,但溶解度低,易与某些金属离子生成沉淀,故硫酸 钠、磷酸盐、柠檬酸盐应用远不如硫酸铵广泛。 三、盐析的因素 (一)盐离子浓度 在低盐浓度时,盐离子能增加生物分子表面电荷,使生物分子水合作用 增强,具有促进溶解的作用,称盐溶现象。当盐浓度达一定值后,盐浓度升高, 生物分子溶解度不断降低,产生了盐析作用,不同的生物分子,“盐溶”与“盐 析”的分界值不同。由此可知不同生物分子达“全部盐析”所用盐浓度也不 同。这一点为采用盐析技术分离纯化生物活性成分提供了可能性。 (二)生物分子种类 生物分子的分子结构不同,其分子表面亲水基团与疏水基团不相同,不 同生物分子产生盐析现象所需中性盐的浓度(离子强度)亦不同。例如血浆 中的蛋白质,纤维蛋白原最易析出,硫酸铵的饱和度达到 20%即可;饱和度 增加到 28%~33%时,优球蛋白析出;饱和度再增加至 33%~50%时,拟球 蛋白析出;饱和度大于 50%时,白蛋白析出。 硫酸铵的饱和度是指饱和硫酸铵溶液的体积占混合后溶液总体积的百分 数。通常盐析所用中性盐的浓度不以百分浓度或摩尔浓度表示,而多用相对 饱和度来表示,也就是把饱和时的浓度看作 1 或 100%,如 1L 水在 25℃时溶 入了 767g 硫酸铵固体就是 100%饱和,溶入 383.5g 硫酸铵称半饱和(50%或 0.5 饱和度)。例如,一体积的含蛋白溶液加一体积饱和硫酸铵溶液时,饱和 度为 50%或 0.50,三体积的含蛋白溶液加一体积饱和硫酸铵溶液时,饱和度 为 25%或 0.25。 (三)生物分子浓度 溶液中生物分子的浓度对盐析的效果有很大的影响,当某种成分析出的 盐浓度一定时,溶液中生物分子的浓度越高,其他成分就会部分随着沉析的 成分一起析出,即所谓的共沉现象; 教学提示 副板书 副板书 副板书

教学内容与设计: 教学提示 如果将溶液中生物分子稀释到过低的浓度,则需要加大反应容器并加入 更多的沉析剂,因此要得到理想的沉析效果,必须将生物分子的浓度控制在 一定的范围内。一般对于蛋白质溶液,其浓度为2%一3%比较合适。 (四)pH值 副板书 通常情况下,如果生物分子表面携带的净电荷(不论正电荷和负电荷) 越多,就会产生越强的排斥力,使生物分子不容易聚集,此时溶解度就很大。 提问:何 如果调整溶液的pH,在某一个临界的pH值处出现生物分子对外表现净电荷 谓等电 为零的情况,此时生物分子间的排斥力很小,生物分子很容易聚集后析出, 点 也就是说此时溶解度最低。这种情况下的pH值称为该生物分子的等电点 (p)。对特定的生物分子,有盐离子存在时的p与在纯粹水溶液中的pl会 有一定的偏差。在盐析时,如果要沉析某一成分,应将溶液的pH值调整到该 成分的等电点,如果希望某一成分保留在溶液中不析出,则应使溶液的pH值 偏离该成分的等电点。 (五)温度 多数物质的溶解度会受温度变化的影响。大多数情况下,在纯粹的水溶液或 副板书 低离子强度的溶液中。在一定的温度范围内,物质的溶解度会随温度的升高 而增加。但对于多数蛋白质、肽而言,在高盐浓度下,它们的溶解度反而会 随温度的升高而降低。只有少数蛋白质例外。如胃蛋白酶、大豆球蛋白,它 们在高盐浓度下的溶解度随温度上升而增加。而卵球蛋白的溶解度几乎不受 温度影响。在蛋白质的分级沉析时,温度变化引起各种蛋白质溶解度的变化 是不相同的,所以在不同温度下,逐渐增加盐浓度所引起的各种蛋白质分级 沉析顺序,也是有变化的。在实际操作中应十分注意。盐析一般可在室温下 进行,当处理对温度敏感的蛋白质或酶时,盐析操作要在低温下(如0℃~4℃) 进行。 四、盐析的应用 37min (一)盐析的操作 副板书 盐析的具体操作对分离效果影响很大。下面是最常用的中性盐硫酸铵的 盐析操作方法。 1、盐的处理硫酸铵使用时要求纯度较高,生产时为降低成本,一般选 用化学纯的硫酸铵,在使用前应进行预处理,可通过化学法将重金属除去(如 5
5 教学内容与设计: 如果将溶液中生物分子稀释到过低的浓度,则需要加大反应容器并加入 更多的沉析剂,因此要得到理想的沉析效果,必须将生物分子的浓度控制在 一定的范围内。一般对于蛋白质溶液,其浓度为 2%~3%比较合适。 (四) pH 值 通常情况下,如果生物分子表面携带的净电荷(不论正电荷和负电荷) 越多,就会产生越强的排斥力,使生物分子不容易聚集,此时溶解度就很大。 如果调整溶液的 pH,在某一个临界的 pH 值处出现生物分子对外表现净电荷 为零的情况,此时生物分子间的排斥力很小,生物分子很容易聚集后析出, 也就是说此时溶解度最低。这种情况下的 pH 值称为该生物分子的等电点 (pI)。对特定的生物分子,有盐离子存在时的 pI 与在纯粹水溶液中的 pI 会 有一定的偏差。在盐析时,如果要沉析某一成分,应将溶液的 pH 值调整到该 成分的等电点,如果希望某一成分保留在溶液中不析出,则应使溶液的 pH 值 偏离该成分的等电点。 (五)温度 多数物质的溶解度会受温度变化的影响。大多数情况下,在纯粹的水溶液或 低离子强度的溶液中。在一定的温度范围内,物质的溶解度会随温度的升高 而增加。但对于多数蛋白质、肽而言,在高盐浓度下,它们的溶解度反而会 随温度的升高而降低。只有少数蛋白质例外。如胃蛋白酶、大豆球蛋白,它 们在高盐浓度下的溶解度随温度上升而增加。而卵球蛋白的溶解度几乎不受 温度影响。在蛋白质的分级沉析时,温度变化引起各种蛋白质溶解度的变化 是不相同的,所以在不同温度下,逐渐增加盐浓度所引起的各种蛋白质分级 沉析顺序,也是有变化的。在实际操作中应十分注意。盐析一般可在室温下 进行,当处理对温度敏感的蛋白质或酶时,盐析操作要在低温下(如 0℃~4℃) 进行。 四、盐析的应用 37min (一)盐析的操作 盐析的具体操作对分离效果影响很大。下面是最常用的中性盐硫酸铵的 盐析操作方法。 1、盐的处理 硫酸铵使用时要求纯度较高,生产时为降低成本,一般选 用化学纯的硫酸铵,在使用前应进行预处理,可通过化学法将重金属除去(如 通入 H2S 后过滤),再将硫酸铵重结晶备用。 教学提示 副板书 提问:何 谓等电 点? 副板书 副板书

2、加盐的方法 教学提示 (1)直接加入固体硫酸铵法当需要较高的硫酸铵饱和度进行盐析,或不 副板书 希望增加处理样的体积时可采用该法。具体操作时,先将固体硫酸铵在低温 下研成细小的颗粒,边搅拌边缓慢向溶液中加入,避免出现局部浓度过高而 影响盐析效果以及生物活性成分的改变。 3、盐析操作注意事项 副板书 (1)盐析反应完全需要一定时间,一般硫酸铵全部加完后,应放置30min 以上才可进行固-液分离。 (2)经过一次分级得到的盐析沉淀,能否进行第二次盐析要靠试验确定。 (3)盐析操作时加入盐的纯度、加量、加入方法、搅拌的速度、温度及 pH等参数应严格控制。 (4)盐析时生物分子浓度要合适,应充分考虑共沉及稀释后收率、盐量 和固-液分离等问题。一般低浓度硫酸铵可采用离心分离,高浓度硫酸铵常用 过滤方法,因为高浓度硫酸铵密度太大,要使蛋白质完全沉降下来需要较高 的离心速率和较长的离心时间。 (5)盐析后溶液应进行脱盐,常用的办法有透析、凝胶过滤及超滤等。 (二)盐析的主要应用 盐析是最早使用的生化分离技术之一,由于易产生共沉作用,故其分辨 率不是很高,但配其他手段完全能达到很好的分离效果。由于成本低,操作 安全简单,对许多生物活性物质具有很好的稳定作用,常用于蛋白质、酶、 多肽、多糖、核酸等物质的分离纯化。蛋白质盐析的应用方法 蛋白质等生物分子在水中的溶解度与溶液中中性盐的离子强度有如下关 系(休格尔经验公式): logS=B-Ks.I 式中:S为蛋白质的溶解度,gL:B、Ks为盐析常数:I为离子强度。 式(4-3)是直线方程,但仅在一定的离子强度范围内适用。离子强度过 低或过高,都不呈线性关系。式中B值的大小取决于溶质的性质,不可能直 接测定,是假定在I=0时, 用外推法求出直线延长在纵轴的截距。故B值带有经验性质。Ks等于直线的 斜率的负值。 Ks值越大,B值越小,表示盐析能力越强
6 2、加盐的方法 (1)直接加入固体硫酸铵法 当需要较高的硫酸铵饱和度进行盐析,或不 希望增加处理样的体积时可采用该法。具体操作时,先将固体硫酸铵在低温 下研成细小的颗粒,边搅拌边缓慢向溶液中加入,避免出现局部浓度过高而 影响盐析效果以及生物活性成分的改变。 3、盐析操作注意事项 (1)盐析反应完全需要一定时间,一般硫酸铵全部加完后,应放置 30min 以上才可进行固-液分离。 (2)经过一次分级得到的盐析沉淀,能否进行第二次盐析要靠试验确定。 (3)盐析操作时加入盐的纯度、加量、加入方法、搅拌的速度、温度及 pH 等参数应严格控制。 (4)盐析时生物分子浓度要合适,应充分考虑共沉及稀释后收率、盐量 和固-液分离等问题。一般低浓度硫酸铵可采用离心分离,高浓度硫酸铵常用 过滤方法,因为高浓度硫酸铵密度太大,要使蛋白质完全沉降下来需要较高 的离心速率和较长的离心时间。 (5)盐析后溶液应进行脱盐,常用的办法有透析、凝胶过滤及超滤等。 (二)盐析的主要应用 盐析是最早使用的生化分离技术之一,由于易产生共沉作用,故其分辨 率不是很高,但配其他手段完全能达到很好的分离效果。由于成本低,操作 安全简单,对许多生物活性物质具有很好的稳定作用,常用于蛋白质、酶、 多肽、多糖、核酸等物质的分离纯化。蛋白质盐析的应用方法 蛋白质等生物分子在水中的溶解度与溶液中中性盐的离子强度有如下关 系(休格尔经验公式): IogS=β-Ks·I 式中: S 为蛋白质的溶解度,g/L;β、Ks 为盐析常数;I 为离子强度。 式(4-3)是直线方程,但仅在一定的离子强度范围内适用。离子强度过 低或过高,都不呈线性关系。式中β值的大小取决于溶质的性质,不可能直 接测定,是假定在 I =0 时, 用外推法求出直线延长在纵轴的截距。故β值带有经验性质。Ks 等于直线的 斜率的负值。 Ks 值越大,β值越小,表示盐析能力越强。 教学提示 副板书 副板书
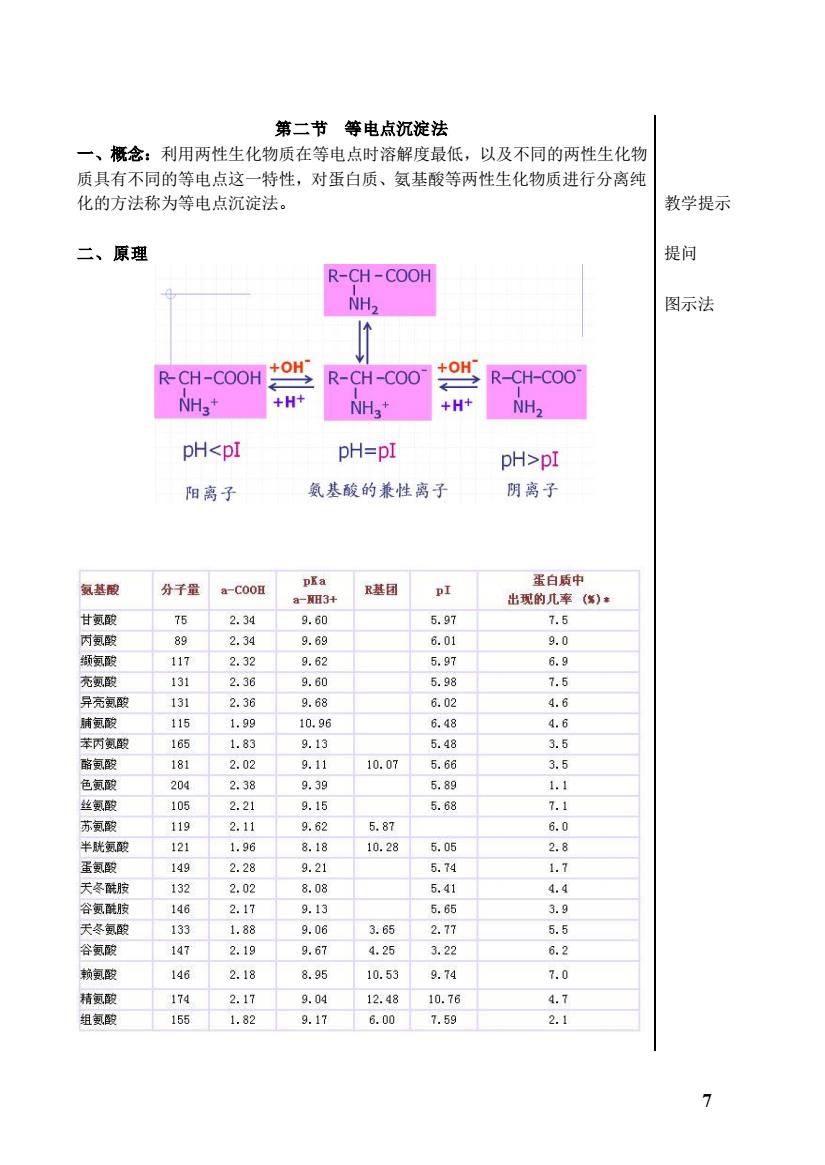
第二节等电点沉淀法 一、概念:利用两性生化物质在等电点时溶解度最低,以及不同的两性生化物 质具有不同的等电点这一特性,对蛋白质、氨基酸等两性生化物质进行分离纯 化的方法称为等电点沉淀法。 教学提示 二、原理 提问 R-CH-COOH NH, 图示法 R-CH-COOH +OH R-CH-COO R-CH-COO +H+ +H NH pHpI 阳离子 氨基酸的兼性离子 阴离子 氯基酸 分千量 a-COOH R基团 DI 75 89 2.4 131 860 阳 7.5 131 2.36 9.68 6.02 4.6 时氨 115 1.99 10.99 6.48 4.6 苯丙氨 1.83 9.13 5.48 3.5 2.02 9.11 10.07 566 3.5 2.38 9.39 5.89 1.1 丝氨酸 2.21 9.15 5.68 7.1 苏氨酸 9.62 5.87 半胱氨面 0.28 2.8 .74 5 4 2. 1 9.0 3.65 17 2.19 9.67 4.25 3.22 6.2 146 2.18 8.95 10.53 9.7 7.0 174 2.17 9.04 12.8 10.76 4.7 组氨致 1551.82 9.17 6.00 7.59 2.1
7 第二节 等电点沉淀法 一、概念:利用两性生化物质在等电点时溶解度最低,以及不同的两性生化物 质具有不同的等电点这一特性,对蛋白质、氨基酸等两性生化物质进行分离纯 化的方法称为等电点沉淀法。 二、原理 学生归纳总结: 盐析的原理、影响因素与应用 教学提示 提问 图示法

三、特点及应用 教学提示 优 日视柄花少 口引入杂质少 缺点 口分辨率差,并且许多生物分子的等电点又比较接近,是一种常用的分 离纯化方法。 应用举例: 如:工业上生产胰岛素时,在粗提液中先调P=8.0,去除碱性蛋白质,再 调pH=3.0,去除酸性蛋白质 提问 四、操作及影响因素 口盐离子的影响 口目的生物分子的稳定性 如:胰蛋白酶(P10.1),它在中性或偏碱的环境中部分降解失活,所以在实际 操作中避免pH超过5.0以上。 口生物分子在等电点附近的盐溶现象相当明显,所以必须控制离子强度 第三节有机溶剂沉析 一、有机溶剂沉析原理 向含有生化物质的水溶液中加入一定量亲水性的有机溶剂,能使生化物质 沉淀析出的分离技术称为有机溶剂沉析。其机理有二: (一)亲水性有机溶剂本身的水合作用降低了自由水的浓度,使溶质分子周 围的水化层变薄,导致脱水而相互聚集析出,也就是降低了溶质的溶解度。 (二)有机溶剂的介电常数比水小,加入有机溶剂后,整个溶液的介电常数 降低,带电的溶质分子之间库仑引力增强,使溶质分子相互吸引而聚集。 介电常数与静电引力的关系,可表示为: F=q1q2/Er 式中 一一为介电常数,由介质的性质决定,表示介质对带有相反电荷的微 粒之间的静电引力与真空对比减弱的倍数。在真空中定为1。 F- 一表示相距为r的两个点电荷q和q互相作用的静电引力,其中q,4和 r都是定值,F的大小则决定于e值
8 三、特点及应用 优点: 操作简单 试剂消耗量少 引入杂质少 缺点: 分辨率差,并且许多生物分子的等电点又比较接近,是一种常用的分 离纯化方法。 应用举例: 如:工业上生产胰岛素时,在粗提液中先调 Ph=8.0,去除碱性蛋白质,再 调 pH=3.0,去除酸性蛋白质 四、操作及影响因素 盐离子的影响 目的生物分子的稳定性 如:胰蛋白酶(Pi 10.1),它在中性或偏碱的环境中部分降解失活,所以在实际 操作中避免 pH 超过 5.0 以上。 生物分子在等电点附近的盐溶现象相当明显,所以必须控制离子强度。 第三节 有机溶剂沉析 一、有机溶剂沉析原理 向含有生化物质的水溶液中加入一定量亲水性的有机溶剂,能使生化物质 沉淀析出的分离技术称为有机溶剂沉析。其机理有二: (一)亲水性有机溶剂本身的水合作用降低了自由水的浓度,使溶质分子周 围的水化层变薄,导致脱水而相互聚集析出,也就是降低了溶质的溶解度。 (二)有机溶剂的介电常数比水小,加入有机溶剂后,整个溶液的介电常数 降低,带电的溶质分子之间库仑引力增强,使溶质分子相互吸引而聚集。 介电常数与静电引力的关系,可表示为: F=q1q2/εr 2 式中 ε——为介电常数,由介质的性质决定,表示介质对带有相反电荷的微 粒之间的静电引力与真空对比减弱的倍数。在真空中定为 1。 F——表示相距为 r 的两个点电荷 q1 和 q2 互相作用的静电引力,其中 q1,q2和 r 都是定值,F 的大小则决定于ε值。 教学提示 提问

二、沉析溶剂的选择 教学提示 (一)溶剂选择 副板书 沉析溶剂选择主要应考虑以下因素: 1、是否与水互溶,在水中是否有很大的溶解度: 2、介电常数小,沉析作用强。 3、对生物分子的变性作用小。 4、毒性小,挥发性适中。沸点过低虽有利于溶剂的除去和回收,但挥发 可先提问 学生 损失较大。乙醇,介电常数较低,沸点适中,无毒且沉析作用强等优点,广 泛用于蛋白质、核酸、多糖等生物高分子及核苷酸、氨基酸等沉析溶剂。 丙酮,介电常数较低,沉析作用大于乙醇。用丙酮代替乙醇作沉析剂 般可以减少用量,但其沸点较低、挥发损失大、对肝脏有一定毒性、着火点 低等缺点使得它的应用不及乙醇广泛。 甲醇,沉淀作用与乙醇相当,但对蛋白质的变性作用比乙醇、丙酮都小, 由于口服有强毒,限制了它的使用。 其他溶剂,如氯仿、二甲基甲酰胺、二甲基亚砜、2-甲基-2,4-戊二醇(MPD)、 乙睛等也可作沉析剂,但远不如乙醇、丙酮、甲醇使用普遍。 (二)溶剂浓度的计算 副板书 在进行沉析操作时,欲使溶液达到一定的有机溶剂浓度,需要加入的有机溶 剂的浓度 和体积可按下式计算: V=Vo(S2-S1)/(S3-S2) 式中 V一一需加入100%浓度有机溶剂的体积,mL: V。一一原溶液体积,mL: S1一一原溶液中有机溶剂的浓度,g/100mL: S2一一所要求达到的有机溶剂的浓度,g/100mL: S;一一指加入的有机溶剂浓度。 上式计算未考虑混溶后体积的变化和溶剂的挥发情况,实际上存在一定 的误差。有时侧重于沉析而不考虑分离效果。可用溶液体积的倍数:如加入1 倍、2倍、3倍原溶液体积的有机溶剂,来进行有机溶剂沉析。 9
9 二、沉析溶剂的选择 (一)溶剂选择 沉析溶剂选择主要应考虑以下因素: 1、是否与水互溶,在水中是否有很大的溶解度; 2、介电常数小,沉析作用强。 3、对生物分子的变性作用小。 4、毒性小,挥发性适中。沸点过低虽有利于溶剂的除去和回收,但挥发 损失较大。乙醇,介电常数较低,沸点适中,无毒且沉析作用强等优点,广 泛用于蛋白质、核酸、多糖等生物高分子及核苷酸、氨基酸等沉析溶剂。 丙酮,介电常数较低,沉析作用大于乙醇。用丙酮代替乙醇作沉析剂一 般可以减少用量,但其沸点较低、挥发损失大、对肝脏有一定毒性、着火点 低等缺点使得它的应用不及乙醇广泛。 甲醇,沉淀作用与乙醇相当,但对蛋白质的变性作用比乙醇、丙酮都小, 由于口服有强毒,限制了它的使用。 其他溶剂,如氯仿、二甲基甲酰胺、二甲基亚砜、2-甲基-2,4-戊二醇(MPD)、 乙腈等也可作沉析剂,但远不如乙醇、丙酮、甲醇使用普遍。 (二)溶剂浓度的计算 在进行沉析操作时,欲使溶液达到一定的有机溶剂浓度,需要加入的有机溶 剂的浓度 和体积可按下式计算: V=V0(S2—S1)/(S3—S2) 式中 V——需加入 100%浓度有机溶剂的体积,mL; V。——原溶液体积,mL; S1——原溶液中有机溶剂的浓度,g/lOOmL; S2——所要求达到的有机溶剂的浓度,g/lOOmL; S3——指加入的有机溶剂浓度。 上式计算未考虑混溶后体积的变化和溶剂的挥发情况,实际上存在一定 的误差。有时侧重于沉析而不考虑分离效果。可用溶液体积的倍数:如加入 1 倍、2 倍、3 倍原溶液体积的有机溶剂,来进行有机溶剂沉析。 教学提示 副板书 可先提问 学生 副板书

三、影响有机溶剂沉析的因素 教学提示 (一)温度 大多数生物大分子如蛋白质、酶和核酸在有机溶剂中对温度特别敏感, 温度稍高就会引起变性,且有机溶剂与水混合时产生放热反应,因此有机溶 剂必须预先冷至较低温度,一般在0℃以下,操作时要在冰盐浴中进行,加入 重点内容 有机溶剂必须缓慢,并不断搅拌以免局部浓度过浓。温度越低,得到的生物 活性物质越多,而且可以减少有机溶剂的挥发。 (二)生物样品的浓度 与盐析相似,样品浓度低时增加有机溶剂投入量和损耗,降低了溶质回 收率,易产生稀释变性,但共沉的作用小,有利于提高分离效果。反之,对 于高浓度的生物样品,节省了有机溶剂,减少了变性的危险,但共沉作用大, 分离效果下降。一般认为,对于蛋白质溶液0.5%~2%起始浓度较合适,对于 粘多糖以1%~2%为起始浓度为宜 (三)pH 有机溶剂沉析时适宜的pH,要选择在样品稳定的pH范围内,而且尽可 能选择样品溶解度最低的pH,通常是选在等电点附近,以提高该沉析的分辨 能力。但应注意的是有少数生物分子在等电点附近不稳定,影响其活性:同 时尽量避免目的物与杂质带相反电荷而加剧共沉现象的发生。 (四)离子强度 在有机溶剂和水的混合液中,当离子强度很小,物质不能沉析时,补加 少量电解质即可解决。盐的浓度太大(0.1~0.2mol/L以上),就需大量的有 机溶剂来沉析,并可能使部分盐在加入有机溶剂后析出。同时盐的离子强度 达一定程度时,还会增加蛋白质或酶在有机溶剂中的溶解度。所以一般离子 强度在0.05或稍低为好,既能使沉析迅速形成,又能对蛋白质或酶起一定的 保护作用,防止变性。由盐析法沉析得到的蛋白质或酶,在用有机溶剂沉析 前,一定要先透析除盐。 (五)金属离子 在用有机溶剂沉析生物高分子时还应注意到某些金属离子的助沉作用 些金属离子如Zn+、C2+等可与某些呈阴离子状态的生物高分子形成复合物 这种复合物的溶解度大大降低而不影响生物活性,有利于沉析形成,并降低 10
10 三、影响有机溶剂沉析的因素 (一)温度 大多数生物大分子如蛋白质、酶和核酸在有机溶剂中对温度特别敏感, 温度稍高就会引起变性,且有机溶剂与水混合时产生放热反应,因此有机溶 剂必须预先冷至较低温度,一般在 0℃以下,操作时要在冰盐浴中进行,加入 有机溶剂必须缓慢,并不断搅拌以免局部浓度过浓。温度越低,得到的生物 活性物质越多,而且可以减少有机溶剂的挥发。 (二)生物样品的浓度 与盐析相似,样品浓度低时增加有机溶剂投入量和损耗,降低了溶质回 收率,易产生稀释变性,但共沉的作用小,有利于提高分离效果。反之,对 于高浓度的生物样品,节省了有机溶剂,减少了变性的危险,但共沉作用大, 分离效果下降。一般认为,对于蛋白质溶液 0.5%~2%起始浓度较合适,对于 粘多糖以 1%~2%为起始浓度为宜。 (三)pH 有机溶剂沉析时适宜的 pH,要选择在样品稳定的 pH 范围内,而且尽可 能选择样品溶解度最低的 pH,通常是选在等电点附近,以提高该沉析的分辨 能力。但应注意的是有少数生物分子在等电点附近不稳定,影响其活性;同 时尽量避免目的物与杂质带相反电荷而加剧共沉现象的发生。 (四)离子强度 在有机溶剂和水的混合液中,当离子强度很小,物质不能沉析时,补加 少量电解质即可解决。盐的浓度太大(0.1~0.2mol/L 以上),就需大量的有 机溶剂来沉析,并可能使部分盐在加入有机溶剂后析出。同时盐的离子强度 达一定程度时,还会增加蛋白质或酶在有机溶剂中的溶解度。所以一般离子 强度在 0.05 或稍低为好,既能使沉析迅速形成,又能对蛋白质或酶起一定的 保护作用,防止变性。由盐析法沉析得到的蛋白质或酶,在用有机溶剂沉析 前,一定要先透析除盐。 (五)金属离子 在用有机溶剂沉析生物高分子时还应注意到某些金属离子的助沉作用,一 些金属离子如 Zn2+、Ca2+等可与某些呈阴离子状态的生物高分子形成复合物。 这种复合物的溶解度大大降低而不影响生物活性,有利于沉析形成,并降低 教学提示 重点内容