
《生物化学》教案 授课题目 学时安排 第六章 蛋白质表征 4学时 掌握蛋白质的两性解离 教 相对分子质量测定方法 蛋白质含量测定原理 ◇ 熟悉胶体性质 的 沉淀方法 和 分离纯化的般原则 各种分离纯化方法:纯度鉴定 求 了解蛋白质的分子大小 沉淀方法:相对分子质量测定方法 教学重点 蛋白质含量测定原理 分离纯化的般原则 相对分子质量测定方法 教学难点 分离纯化方法 纯度鉴定 教学过程 讲授结合多媒体课件 作业 P317习题1、5、6、7、8

教学内容 导言 蛋白质的理化性质和氨基酸相似,有两性解离及等电点、紫外吸收和呈色反应。作为生 物大分子,还有胶体性质、沉淀、变性和凝固等特点。要了解和分析蛋白质结构和功能的关 系就要利用其特殊的理化性质,采取盐析、透析、电泳、层析及离心等不损伤蛋白质空间构 象的物理方法分离纯化蛋白质。这些方法的原理是什么?如何提取、纯化,鉴定、测定蛋白 质?且听一一分解 第六章蛋白质的分离、纯化和表征 第一节表征 蛋白质的化性质利氨基酸似,有两性解离及等电点、紫外吸收和星色反应。作为生 物大分子还有胶体性质、沉淀,变性和旋固等特点。要了解和分析蛋白质结构和功能的关 系戒要利用其特殊的理化性质,采取款析、透析、电泳、层析长离心等不损伤黄白质空间剜构 象的物理方法分离纯化蛋白质。 一、蛋白质的酸碱性(掌握) 两性、pl 概念同氨基酸 各解离基团的解离情况 AH--→A-+H+ B+H--→B+H pHpK右式 AH一COOH、一SH,-一酚H BH一N+H,一咪唑+H,一圆+H 白质和氨基酸一样是两性电解质,在溶液中的荷电状态受川值影刚。当茧白质溶液 处于老 山时,黄白质解成不、负子的趋势 即成 兼性离子,净电荷为零 时溶液的p称为该蛋白质的等电点。p1>pl时,该蛋白质粒带负电荷,反之则带正电荷 在人体体液中多数蛋白质的等电点接近H5,所以在生理H7.4环境下,多数黄白质解离 成阴离子。少量蛋白质,鱼精蛋白、组蛋白的偏于碱性,称碱性蛋白质,而胃蛋白南 和丝蛋白为酸性蛋白。 二、蛋白质的相对分子质量测定方法(重点、难点) (一)、据组成测最低相对分子质量 知某组分的含量,求蛋白质的相对分子质量? :某组分量/蛋白质相对分子质量-该组分百分含量(x%)∴. 某组分的原子或分子量 蛋白质相对分子质量 =某组分量/×100 X% 又:某组分有时不知它在分子中有几个,“所得是其最低相对分子质量,真实值

为其倍数」 例1 肌红蛋白和血红蛋白念供量均为0.335% 带入上式得相对分子质量=55.8÷0.335%=16757 但肌红蛋白含1个铁 血红蛋白含4个铁 所以,肌红蛋白为16700:血红蛋白为4×16700 即血红蛋白相对分子质量=4×55.8÷0.335% 例2 某蛋白含亮氨酸1.65%,异亮2.48%,求其相对分子质量? 民点得 131/1.65%=7939注:理论上应以残基计131-18,实际可以分子计) 据异亮得 131/2.48%=5282 先通过二者摩尔百分含量比求出二者个数比: 1.65/131 2.48/131=1/1.5=23 计算时约分(以小数为1),不要除 据亮得 2×13111.65%=15879 3×131/2.48%-15847 该蛋白最低相对分子质量为 15900/15800 :2、3不是亮、异的个数,15800是最低相对分子质量, 若此题分为两个题,则其最低相对分子质量分别是7900、5200(分别以一个计) 此法比较准确,但有时雅得真实量,如例2 (二)、渗透压法 渗透压与溶质颗粒数(摩尔数)有关,即 r=nRT/V=g/M·RT/V=g/V·RTM=cRT/M 渗透压可测得 气体常数 T 恤对混度 溶液体积 溶质摩尔质量即相对分子质量 g/V -c 溶液浓度,自己配制的,已知 从中解出M即可 此法简单易测,也较准确,但对样品的纯度要求较高。 (三)、扩散法 即扩散系数法 由于扩散系数不只与相对分子质量有关,还较大程度取决于其分子形状,所以,一般 不单独使用。路 (四)、沉降分析法 1、沉降速度法 最准确可靠的方法(Svedberg于1940年设计): 蛋白质题粒在2550×10g离心力作用下从溶液中沉降下来。 沉降系数(s)片单位(cm)离心场甲的沉降速度。 s=v/02X "-沉降速度(da =离心机转子角速度(弧度/s) =转速(每分钟旋转次数)×2刀/60 x二蛋白质界面中点与转子中心的距离(©m》 沉降系(常)数的单位:秒

蛋白质分子量()与沉降系(s)的关系 M=RTs/D (I-Ve) 斯维得贝格(Svedberg)方程 —气体常数(8.314×101ergs·mo1-1·度-1) 下—绝对温度 )—扩散常数(蛋白质分子量很大,离心机转速很快,则忽路不计) 单位浓度梯度时,1秒内通过1cm界面所扩傲的溶质的量 —蛋白质的微分比容(3·g1,水溶液为0.74加入溶质使溶剂的增 p—溶剂密度(20℃,g·m1-1) 一沉降系数 通过上式求得 北法为是可靠的方法 生物大 子的沉降系数介于(1~200)×10-1秒 定义10一13为 个S(斯维得贝格单位或沉降系数单位 15.8 SrRNA、70S核糖体(30S+50S) 2、沉降平衡法 指沉降与扩散的平衡 M2 RT)o2(2-2 蛋白质波面距轴心距离 x1处蛋白浓度 2处蛋白浓度 此法理论完善,但对高心机性能要求较高 (五)、凝胶过滤法 溶质透过凝胶的速度只与分子形状(斯托克半径)有关 斯托完半径:某种蛋白质与理想的非水化球具有相同的过杜速度,即 相同的洗脱体积,则认为二者半径相同。其半径称为蛋白质的斯托克半径 示意图 小分子进入凝胶粒内,路长,慢 凝胶粒内有大分子丝之间同漆 大分子穿过凝胶粒问,路短,快 洗脱体积 某颗粒最大量流出时的洗脱液毫升数 浓平 1020304050 ◆洗脱体积(第mL) 相对分子质量与洗脱体积关系式 (经验式,1966年Andrews提出) lgMr=ab·/b·eo b 为常数 为外水体积 为洗脱体积 比法是用与特动美形状辉推经台质的装电汉来生的。 ·实测时,常用标准曲线来求得
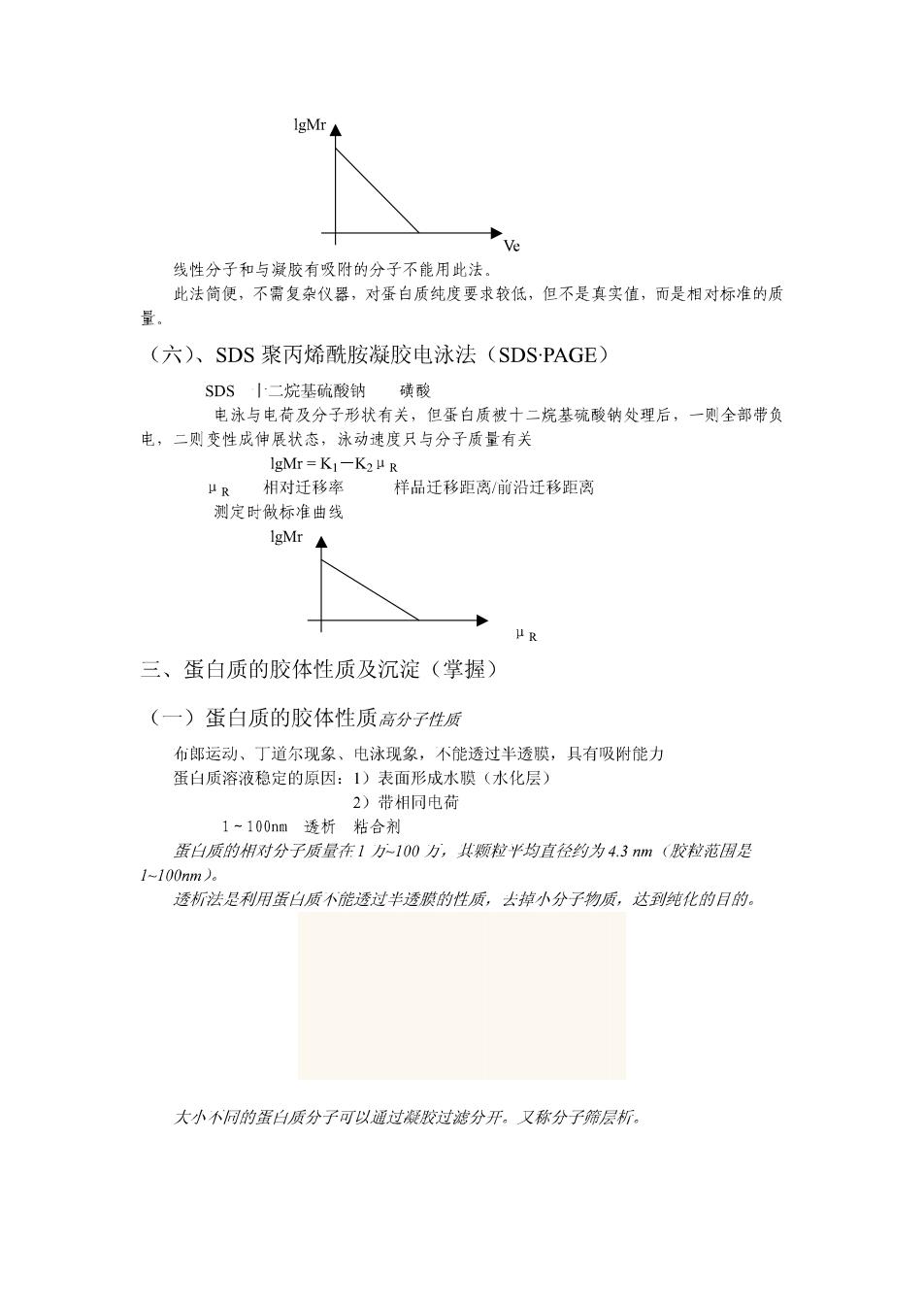
lgM 线性分子和与凝胶有吸附的分子不能用此法. 此法简便,不需复杂仪器,对蛋白质纯度要求较低,但不是真实值,而是相对标准的质 (六)、SDS聚丙烯酰胶胺凝胶电泳法(SDS-PAGE) SDS丨二烷基硫酸钠磷酸 电泳与电荷及分子形状有关,但蛋白质被十二烷基统酸钠处理后,一则全部带负 电,二则变性成伸展状态,泳动速度只与分子质量有关 1gMr=K一K2μR H R 相对迁移率 样品迁移距离/前沿迁移距离 测定时做标准曲线 IgMr μR 三、蛋白质的胶体性质及沉淀(掌握) (一)蛋白质的胶体性质高分子性质 布郎运动、丁道尔现象、电泳现象,不能透过半透膜,具有吸附能力 蛋白质溶液稳定的原因:1)表面形成水膜(水化层) 2)带相同电荷 1-100nm添析、牡合剂 蛋白质的用对分子质量在1万10万,其颍粒半均直径约为43m(歌粒范用足 1-100nm) 透析法是利用蛋白质不能透过半透膜的性质,去掉小分子物质,达到纯化的目的。 大小小同的蛋白质分子可以通过胶过滤分开。又称分子筛层析

(二)蛋白质的沉淀反应 1、加高浓度盐类(盐析):加盐使蛋白质沉淀析出。 煮肉 盐析大量盐不仅中和电荷,且使水成离子水化层,即破不蛋白质水化膜】 分段盐析:调节盐浓度,可使混合蛋白质溶液中的儿种蛋白质分段析出。血清球蛋白 (509NHS0:和度),清蛋白(饱和NHS0,). 盐溶少量盐中和蛋白表面电荷,破坏蛋白质之间静电吸引,促使蛋白质形成水化层 蛋白质结品是靠静电吸引结集沉淀的,难容。少许盐促溶。 蛋白质溶液是靠电性排斥和水化膜罔离面稳定的,难聚,大量盐促聚 2、加有机落剂 消毒 3、加重金属盐 中寺解 4、圳生物碱试剂 单宁酸、苦味酸、钼酸、钨酸、三氯乙酸能沉淀生物碱,称生物赋试剂。 5、变性(加盐或调pH) 凝周 第二节分离、纯化与测定 一、一般原则(熟悉) 把蛋白质从溶液中提取出来,设法除去变性的和非目的蛋白质,以增加单位提取物中目 的蛋白质的含量或生物学活性,即增加制品的纯度或比活,使产量达最高。 般程序(步骤) 1、前处理 破可 提取 2、粗分级分离 调pH (到类) 盐析 有机溶剂 超滤 凝胶过滤 3、细分级分离 凝胶过滤 (到种) 离子交换 吸贤层析 亲和层析 电泳 二、分离纯化方法(熟悉)

(一)据分子大小 1、透析、超滤 加压或离心 ,凝胶过滤 (二)据溶解度差别 I、pl 2、盐析 3,有机溶剂 4、 温度 解 温度 5、分配层机 (二)据电荷差异 1、由泳 在外电场作用下,带电颗粒向其电性相反的电极移动的现象。 利用颗粒电荷性质和数量不同以分离混合物的一种实验技术 分子大小不同的蛋白质所带净电荷密 不同,迁移率即异 在电泳时可以分开 泳动速度与颗粒静电荷数及形状、质量有关,还与环境有关 环境因素电场强度、离子强度、pH、电渗 在同一实验中,环境一致,“主要取决于内因 据支持物份 1.自山界面电泳:蛋白质溶于缓冲液中进行电泳 2。区带电泳:将蛋白质溶液点在浸了缓冲液的支持物上进行电泳,不洞组分形成 带状区域。 (1)纸上电泳:用滤纸作支持物。 (2)凝胶电泳:用凝胶(淀粉、琼脂糖、聚丙烯酰胺)作支持物 1)圆盘电泳:玻璃管中进行的凝胶电泳。示意图 2)平板电泳:铺有凝胶的玻板上进行的电泳。示意图 (3)平板电泳 淀粉、纤维素等 (4)细丝电泳 据点泳方向分上行电泳下行电泳平行电泳

单向电泳双向电泳(如多肽测序中的二疏键位置碗定) 电泳仪整流稳压器 等电聚焦电泳! 介质具H梯度 当蛋白质泳动全其等电点时,净电荷为零,在电场中不再移动 示意图 3、层析聚住 同等电聚焦,但不加电场 4、离子交换层析 (四)据吸附力大小 与介质吸附力不同, 吸附解吸附 吸附层析 硅胶、氧化铝、活性炭等 (五)据对配体的特异性亲和力大小 亲合层析酶-底物:抗体抗原:激素受体等 将一方固定在载体上,混合物通过时,另一方被结合,汽去其他组分,然后,用一方溶 液洗脱 (六)高效液相层析和快速液相层析 见氨基酸 三、蛋白质的含量测定与纯度鉴定(熟悉) 1、含量测定 常用方法 原理 凯氏定氨法 N%-16% 双缩法 -C0-NH-与Cu+反应成紫红色 =540nm Folin-粉试剂法 酚与酚试剂成蓝色 入=500mm 紫外吸收法 含苯丙、骼、色者吸收入=280mm 2、纯度鉴定法 电泳纯1个峰(带) 电泳纯 沉降 沉降速度单 高效液相层析单一洗脱峰(体积) 溶解度分析 的和点明显 溶解 不纯 加入量 特异性分析 比活力最大 木端分析 木端单 以上每一个都是必要条件,但不是充分条件,即 纯,符合: 符合某一,不一定纯 如用特异性分析是纯的,但电泳结果可能是几个带,同工酶 再如溶解度分析是纯的,但层析结果是几个斑点,可能溶解度相同 故要多法五相验证