
第七章 酶 一、教学目的与要求 1、掌握酶的催化原理及特性。 2、掌握酶促反应实质及影响因素。 3、了解各种酶的功能。 二、教学重点与难点 重点:1、酶的催化特性 2、影响酶促反应的因素 难点:酶的作用机制—中间产物学说 三、课时安排与教学方法 教学内容 (计划/实 际) 课时数 课程类型/ 教学方法 第一节 酶的概述 2/ 理论/ 第二节 酶的结构和作用机制 1/ 理论/ 第三节 影响酶促反应的因素 2/ 理论/ 第四节 重要的酶类 1/ 理论/ 合计 6/ 四、教学过程 第七章 酶 生命过程的基本特点就是新陈代谢。新陈代谢过程包含着许多复杂而有规律的物质变化和能量 变化。人、动物和植物在新陈代谢中的一切化学反应,不需要高温高压或强烈的酸碱条件,就很容 易地在一切生物体内进行。其中必须要有一种奇特的物质参加,这就是酶。酶与烹饪的关系很密切。 如动物屠宰后,酶的作用可使肉嫩化,改善肉类原料的风味和质构。又如蔬菜、水果在成熟过程中, 由于酶的作用可使其具有一定的色香味等。 激素是生物体产生的代谢调节物质,通过体液或细胞外液运送到特定作用部位,从而引起特殊 激动效应(调节控制各种物质代谢或生理功能)的一群微量的有机化合物。因此,也可以把这类化学 物质看作生物体内的“化学讯息”。目前有些激素已可通过人工合成得到,但主要来源仍然是作为 “下脚料”的动物腺体。 第一节 酶的概述 酶:酶是由生物体活细胞产生,在细胞内、外均能起催化作用并且有高度专一性的特殊蛋白质。 酶促反应:酶所催化的反应叫酶促反应。 底物:在酶促反应中被催化的物质称为底物。 产物:反应的生成物称为产物。 酶活性:酶所具有的催化能力称为酶活性。 酶的激活:使酶获得活性的过程叫酶的激活。 酶的失活:使酶失去活性的过程叫失活。 一、酶的催化特性 催化剂的通性:只能影响化学反应速度,而不改变反应的平衡点,并在反应前后本身不发生变化, 在热力学规律的限制下起催化作用。 酶催化剂的特性:
第七章 酶 一、教学目的与要求 1、掌握酶的催化原理及特性。 2、掌握酶促反应实质及影响因素。 3、了解各种酶的功能。 二、教学重点与难点 重点:1、酶的催化特性 2、影响酶促反应的因素 难点:酶的作用机制—中间产物学说 三、课时安排与教学方法 教学内容 (计划/实 际) 课时数 课程类型/ 教学方法 第一节 酶的概述 2/ 理论/ 第二节 酶的结构和作用机制 1/ 理论/ 第三节 影响酶促反应的因素 2/ 理论/ 第四节 重要的酶类 1/ 理论/ 合计 6/ 四、教学过程 第七章 酶 生命过程的基本特点就是新陈代谢。新陈代谢过程包含着许多复杂而有规律的物质变化和能量 变化。人、动物和植物在新陈代谢中的一切化学反应,不需要高温高压或强烈的酸碱条件,就很容 易地在一切生物体内进行。其中必须要有一种奇特的物质参加,这就是酶。酶与烹饪的关系很密切。 如动物屠宰后,酶的作用可使肉嫩化,改善肉类原料的风味和质构。又如蔬菜、水果在成熟过程中, 由于酶的作用可使其具有一定的色香味等。 激素是生物体产生的代谢调节物质,通过体液或细胞外液运送到特定作用部位,从而引起特殊 激动效应(调节控制各种物质代谢或生理功能)的一群微量的有机化合物。因此,也可以把这类化学 物质看作生物体内的“化学讯息”。目前有些激素已可通过人工合成得到,但主要来源仍然是作为 “下脚料”的动物腺体。 第一节 酶的概述 酶:酶是由生物体活细胞产生,在细胞内、外均能起催化作用并且有高度专一性的特殊蛋白质。 酶促反应:酶所催化的反应叫酶促反应。 底物:在酶促反应中被催化的物质称为底物。 产物:反应的生成物称为产物。 酶活性:酶所具有的催化能力称为酶活性。 酶的激活:使酶获得活性的过程叫酶的激活。 酶的失活:使酶失去活性的过程叫失活。 一、酶的催化特性 催化剂的通性:只能影响化学反应速度,而不改变反应的平衡点,并在反应前后本身不发生变化, 在热力学规律的限制下起催化作用。 酶催化剂的特性:

(一)具有很高的催化效率 酶的催化效率极高,可比一般催化剂高106~1013倍。 例如,1分子过氧化氢酶,每分钟可催化5×106个过氧化氢分子分解为水和氧,比铁粉催化过氧 化氢分解的效率高1010倍。又如,1g 结晶的细菌α-淀粉酶在56℃、15min内可使2吨淀粉水解为糊精。 酶催化反应的高效率是长期以来最引人注目的研究课题之一,它不仅有很高的理论意义,而且也 具有重要的实际意义。 (二)高度的专一性 酶对其所催化物质的选择性比其它催化剂严格得多。 例如,氢离子可以催化淀粉、脂肪和蛋白质等物质的水解,对其催化物质并无特殊要求。而酶则 不然,β-淀粉酶只能催化淀粉水解生成麦芽糖,而不能催化麦芽糖水解成葡萄糖。蛋白酶只能催化 蛋白质水解,而不能催化其它物质水解。 一种酶只能作 用于一类化合物,或作用 于一定的化学键或一种立体异 构体,从而产生一定的产 物。这种现象就 称 为 酶 的专一性 或特异性。 (三)反应条件温和 酶催化的反应是在常温、常压和近中性的溶液条件下进行。酶本身是蛋白质,故强酸、强碱、高 温、高压、紫外线、重金属盐等一切导致蛋白质不可逆变性的因素,都能使酶受到破坏而丧失其催化 活性。 (四)酶的活性是被调节控制的 生命现象表示了它内部化学反应历程的有序性。这种有序性是受多方面的因素调节和控制的。正 是因为受这些因素的调控,酶在生物体 内才 能准确 地行 使它的 催化 功能, 才能 使生命 活动 有条 不紊地进行。 二、酶的命名 酶的命名有习惯命名和系统命名两种方法。 (一)习惯命名 1、绝大多数酶是根据其所催化的底物命名的,如催化水解淀粉的称为淀粉酶,催化水解蛋白质 的称为蛋白酶等。 2、某些酶根据其所催化的反应性质来命名,如水解酶、脱氢酶、氧化酶、转移酶、异构酶等。 3、有的酶结合上述两个原则来命名,例如琥珀酸脱氢酶是根据其作用底物是琥珀酸和所催化的 反应为脱氢反应而命名的。 4、在这些命名的基础上有时还加上酶的来源和其它特点以区别同一类酶。如胃蛋白酶和胰蛋白 酶,指明其来源不同。碱性磷酸酶和酸性磷酸酶则指出这两种磷酸酶所要求的酸碱度不同等。 习惯命名比较简单,应用历史较长,但缺乏系统性,随着被认识的酶的数目日益增多,而出现许 多问题。例如一酶数名或一名数酶。也有些酶命名不甚合理。为了适应酶学发展的新情况,避免命名 的重复和混乱,国际酶学委员会于1961年提出了一个新的系统命名及系统分类的原则,已为国际生化 协会所采用。 (二)系统命名 按照国际系统命名法原则,每一种酶有一个系统名称和习惯 名称。习惯名称应简单,便于使用,系统名称应明确标明酶的底物及催化反应的性质。 系统命名原 则 : 1、列出底物 , 并 用 “:”隔开。 2、指明反应 性 质 。 如上例中应将两个底物 “ L-丙 氨 酸 ”及 “α-酮戊二酸 ”同时列出,并用 “:”将它们隔开。 它 所 催 化 的 反 应 性质 为 氨 基 转 移 ,也 需 要 指 明 ,所 以 它 的 系 统 名 称 为 “L -丙 氨 酸 :α -酮 戊 二酸氨基转 移 酶”。 3、若底物之 一 是 水 时 , 可 将 水 略 去 不写 。 如乙酰辅酶A水解酶(习惯命名 ),可 以 写 成 乙 酰 辅 酶A:水解酶 (系统命名),而 不 必 写 成 乙酰辅酶A:水水解酶。 4、底物的名 称 必 须 确 切 。 例如若有不 同 构 型, 则 必 须 注 明 L-、 D-型及α-、 β -型 等。现举例如下表7-1所示。 表 7-1 酶 命 名法举例 习惯名称 系 统 名 称 催 化 反 应
(一)具有很高的催化效率 酶的催化效率极高,可比一般催化剂高106~1013倍。 例如,1分子过氧化氢酶,每分钟可催化5×106个过氧化氢分子分解为水和氧,比铁粉催化过氧 化氢分解的效率高1010倍。又如,1g 结晶的细菌α-淀粉酶在56℃、15min内可使2吨淀粉水解为糊精。 酶催化反应的高效率是长期以来最引人注目的研究课题之一,它不仅有很高的理论意义,而且也 具有重要的实际意义。 (二)高度的专一性 酶对其所催化物质的选择性比其它催化剂严格得多。 例如,氢离子可以催化淀粉、脂肪和蛋白质等物质的水解,对其催化物质并无特殊要求。而酶则 不然,β-淀粉酶只能催化淀粉水解生成麦芽糖,而不能催化麦芽糖水解成葡萄糖。蛋白酶只能催化 蛋白质水解,而不能催化其它物质水解。 一种酶只能作 用于一类化合物,或作用 于一定的化学键或一种立体异 构体,从而产生一定的产 物。这种现象就 称 为 酶 的专一性 或特异性。 (三)反应条件温和 酶催化的反应是在常温、常压和近中性的溶液条件下进行。酶本身是蛋白质,故强酸、强碱、高 温、高压、紫外线、重金属盐等一切导致蛋白质不可逆变性的因素,都能使酶受到破坏而丧失其催化 活性。 (四)酶的活性是被调节控制的 生命现象表示了它内部化学反应历程的有序性。这种有序性是受多方面的因素调节和控制的。正 是因为受这些因素的调控,酶在生物体 内才 能准确 地行 使它的 催化 功能, 才能 使生命 活动 有条 不紊地进行。 二、酶的命名 酶的命名有习惯命名和系统命名两种方法。 (一)习惯命名 1、绝大多数酶是根据其所催化的底物命名的,如催化水解淀粉的称为淀粉酶,催化水解蛋白质 的称为蛋白酶等。 2、某些酶根据其所催化的反应性质来命名,如水解酶、脱氢酶、氧化酶、转移酶、异构酶等。 3、有的酶结合上述两个原则来命名,例如琥珀酸脱氢酶是根据其作用底物是琥珀酸和所催化的 反应为脱氢反应而命名的。 4、在这些命名的基础上有时还加上酶的来源和其它特点以区别同一类酶。如胃蛋白酶和胰蛋白 酶,指明其来源不同。碱性磷酸酶和酸性磷酸酶则指出这两种磷酸酶所要求的酸碱度不同等。 习惯命名比较简单,应用历史较长,但缺乏系统性,随着被认识的酶的数目日益增多,而出现许 多问题。例如一酶数名或一名数酶。也有些酶命名不甚合理。为了适应酶学发展的新情况,避免命名 的重复和混乱,国际酶学委员会于1961年提出了一个新的系统命名及系统分类的原则,已为国际生化 协会所采用。 (二)系统命名 按照国际系统命名法原则,每一种酶有一个系统名称和习惯 名称。习惯名称应简单,便于使用,系统名称应明确标明酶的底物及催化反应的性质。 系统命名原 则 : 1、列出底物 , 并 用 “:”隔开。 2、指明反应 性 质 。 如上例中应将两个底物 “ L-丙 氨 酸 ”及 “α-酮戊二酸 ”同时列出,并用 “:”将它们隔开。 它 所 催 化 的 反 应 性质 为 氨 基 转 移 ,也 需 要 指 明 ,所 以 它 的 系 统 名 称 为 “L -丙 氨 酸 :α -酮 戊 二酸氨基转 移 酶”。 3、若底物之 一 是 水 时 , 可 将 水 略 去 不写 。 如乙酰辅酶A水解酶(习惯命名 ),可 以 写 成 乙 酰 辅 酶A:水解酶 (系统命名),而 不 必 写 成 乙酰辅酶A:水水解酶。 4、底物的名 称 必 须 确 切 。 例如若有不 同 构 型, 则 必 须 注 明 L-、 D-型及α-、 β -型 等。现举例如下表7-1所示。 表 7-1 酶 命 名法举例 习惯名称 系 统 名 称 催 化 反 应

谷丙转氨酶 己糖激酶 L-丙氨酸:α-酮戊二酸氨基转移酶 ATP:己糖磷酸基转移酶 L-丙氨酸+α-酮戊二酸→丙酮酸+L-谷氨酸 ATP+葡萄糖→6-磷酸葡萄糖+ADP 三、酶的分 类 国际系统分 类 法 将所 有 的 酶 促 反 应 按 反 应 性 质 分 为 六 大 类。 (一)氧化还原酶类 氧化还原酶类催化氧化还原反应。 反应通式: A·2H + B ==== A + B·2H 2H2 O2 ==== 2H2 O + O2 如乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶 (二)转移酶类 转移酶类催化分子间基团的转移反应。 反应通式: AB + C ==== A + BC 如转氨酶、转甲基酶等。 (三)水解酶类 水解酶类催化水解反应。 反应通式: AB + HOH ==== AOH + BH 如唾液淀粉酶、胃蛋白酶、核酸酶、脂酶等 (四)裂解酶(裂合酶或脱加酶)类 裂解酶类催化非水解地从底物上移去一个基团的反应或其逆反应。 催化一种化合物分裂为两种化合物的反应 反应通式: AB ==== A + B 或催化有两种化合物合成一种化合物的反应 反应通式: A + B ==== AB 如醛缩酶、柠檬酸合成酶。 果糖-1,6-2P ⎯醛缩酶 ⎯⎯→ 磷酸二羟基丙酮+3-磷酸甘油 (五)异构酶类 异构酶类催化各种同分异构体的相互转变。 反应通式: A ==== B 如磷酸葡萄糖异构酶、磷酸甘油酸磷酸变位酶等。 G-1-P ⎯磷酸葡萄糖异构酶 ⎯⎯⎯ ⎯→ G-6-P(6-磷酸葡萄糖) 3-磷酸甘油酸 ⎯磷酸甘油酸磷酸变位酶 ⎯⎯⎯⎯⎯⎯→ 2-磷酸甘油酸 (六)合成酶类(或称连接酶类) 合成酶类催化两个分子合成一个分子的反应,合成过程中伴 有ATP分解的酶类。 反应通式: A + B + ATP ==== AB + ADP + Pi 如谷氨酰胺合成酶、谷胱甘肽合成酶、CTP合成酶等。 在科技文献中,为严格起见,一般使用酶的系统名称,但是因某些系统名称太长,为了方便 起见,有时仍使用酶的习惯名称。 四、酶的化学本质及组成 (一)酶的化学本质 关于酶是否为蛋白质,曾有过争论,自20世纪30年代科学家获得了蛋白酶的结晶以后,酶是蛋白 质的观点才逐渐被接受。随着研究的深入,特别是1969年核糖核酸酶的合成成功,更充分地证明―― 酶的化学本质就是蛋白质。 归纳起来,酶是蛋白质的证据有: ①酶的元素组成和含氮量与蛋白质相同。一般蛋白质的元素组成是C、H、O、N四大主要元素,它 们的含量依次是50%~52%,6.8%~7.7%,22%~28%,15%~18%。酶的元素组成与含量与其相 似,特别是含氮量。 ②化学结构与空间构象与蛋白质相同。酶同蛋白质一样,都是由氨基酸以肽键形成肽链,并且有 二级、三级或四级的空间构象。维持构象的次级键也与蛋白质一样容易受到理化因素的影响而使酶变 性,酶变性后活性消失。 ③酶两性离子的性质与蛋白质相同。酶与蛋白质一样,在不同的酸碱溶液中呈现不同的离子状态。 在电场中,这些大分子常聚集于电极的一端,当不移向任何一端时则为等电点,溶解度此时表现为最
谷丙转氨酶 己糖激酶 L-丙氨酸:α-酮戊二酸氨基转移酶 ATP:己糖磷酸基转移酶 L-丙氨酸+α-酮戊二酸→丙酮酸+L-谷氨酸 ATP+葡萄糖→6-磷酸葡萄糖+ADP 三、酶的分 类 国际系统分 类 法 将所 有 的 酶 促 反 应 按 反 应 性 质 分 为 六 大 类。 (一)氧化还原酶类 氧化还原酶类催化氧化还原反应。 反应通式: A·2H + B ==== A + B·2H 2H2 O2 ==== 2H2 O + O2 如乳酸脱氢酶、琥珀酸脱氢酶、细胞色素氧化酶 (二)转移酶类 转移酶类催化分子间基团的转移反应。 反应通式: AB + C ==== A + BC 如转氨酶、转甲基酶等。 (三)水解酶类 水解酶类催化水解反应。 反应通式: AB + HOH ==== AOH + BH 如唾液淀粉酶、胃蛋白酶、核酸酶、脂酶等 (四)裂解酶(裂合酶或脱加酶)类 裂解酶类催化非水解地从底物上移去一个基团的反应或其逆反应。 催化一种化合物分裂为两种化合物的反应 反应通式: AB ==== A + B 或催化有两种化合物合成一种化合物的反应 反应通式: A + B ==== AB 如醛缩酶、柠檬酸合成酶。 果糖-1,6-2P ⎯醛缩酶 ⎯⎯→ 磷酸二羟基丙酮+3-磷酸甘油 (五)异构酶类 异构酶类催化各种同分异构体的相互转变。 反应通式: A ==== B 如磷酸葡萄糖异构酶、磷酸甘油酸磷酸变位酶等。 G-1-P ⎯磷酸葡萄糖异构酶 ⎯⎯⎯ ⎯→ G-6-P(6-磷酸葡萄糖) 3-磷酸甘油酸 ⎯磷酸甘油酸磷酸变位酶 ⎯⎯⎯⎯⎯⎯→ 2-磷酸甘油酸 (六)合成酶类(或称连接酶类) 合成酶类催化两个分子合成一个分子的反应,合成过程中伴 有ATP分解的酶类。 反应通式: A + B + ATP ==== AB + ADP + Pi 如谷氨酰胺合成酶、谷胱甘肽合成酶、CTP合成酶等。 在科技文献中,为严格起见,一般使用酶的系统名称,但是因某些系统名称太长,为了方便 起见,有时仍使用酶的习惯名称。 四、酶的化学本质及组成 (一)酶的化学本质 关于酶是否为蛋白质,曾有过争论,自20世纪30年代科学家获得了蛋白酶的结晶以后,酶是蛋白 质的观点才逐渐被接受。随着研究的深入,特别是1969年核糖核酸酶的合成成功,更充分地证明―― 酶的化学本质就是蛋白质。 归纳起来,酶是蛋白质的证据有: ①酶的元素组成和含氮量与蛋白质相同。一般蛋白质的元素组成是C、H、O、N四大主要元素,它 们的含量依次是50%~52%,6.8%~7.7%,22%~28%,15%~18%。酶的元素组成与含量与其相 似,特别是含氮量。 ②化学结构与空间构象与蛋白质相同。酶同蛋白质一样,都是由氨基酸以肽键形成肽链,并且有 二级、三级或四级的空间构象。维持构象的次级键也与蛋白质一样容易受到理化因素的影响而使酶变 性,酶变性后活性消失。 ③酶两性离子的性质与蛋白质相同。酶与蛋白质一样,在不同的酸碱溶液中呈现不同的离子状态。 在电场中,这些大分子常聚集于电极的一端,当不移向任何一端时则为等电点,溶解度此时表现为最

低。 ④酶的胶体性质与蛋白质相同。酶与蛋白质一样是大分子胶体化合物,不能透过半透膜。 ⑤酶的其它性质也与蛋白质相同。酶所具有的酸碱性质、降解作用、颜色反应(如双缩脲反应等)、 变性反应等理化性质与蛋白质相同。 以上所述这些现象都充分说明酶的化学本质是蛋白质。 (二)酶的组成 酶也与一般蛋白质一样,种类很多。根据许多精密的研究结果,按其化学结构来划分,可归纳为 两类组成:单纯蛋白酶和结合蛋白酶。 1、单纯蛋白酶 单纯蛋白酶又称单成分酶,其组成是由单纯蛋白质构成的。所以单纯蛋白酶水 解的终产物是氨基酸,再无其它物质。大多数水解酶都是单纯蛋白酶。如胃蛋白酶、脲酶、木瓜蛋白 酶等。 组成:单纯蛋白质 水解产物:氨基酸 实例:水解酶――胃蛋白酶、脲酶、木瓜蛋白酶等 2、结合蛋白酶 结合蛋白酶又称双成分酶。这些酶除含有蛋白质以外,还有其它非蛋白质成分。 结合蛋白酶的蛋白质部分称酶蛋白,非蛋白质部分称活性基或辅助因子。结合蛋白酶 必须是两部 分结合 起 来 组 成的全酶 才具有催化活性。全酶的任何一部分单独存在都不具有催化活性。 全酶(结合酶)=酶蛋白+活性基(辅酶或辅基) 在结合酶中,根据活性基与酶蛋白结合的松紧程度,活性基又辅酶与辅基之分。 辅基:与酶蛋白结合紧密,用透析法不易除去的活性基称辅基;辅酶:与酶蛋白结合疏松,易 被透析法除去的活性基称辅酶。活性基的成分有两类: 一类是低分子有机化合物如NAD、NADP、FAD、FMN等, 一类是无机金属离子,如Fe3+ 、Cu2+ 、Zn2 +、Mn2+ 等。 NAD(辅酶Ⅰ) 烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 NADP(辅酶Ⅱ)烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 │ 磷酸 FAD(黄素腺嘌呤二核苷酸) 异咯嗪-核醇-磷酸-磷酸-核糖-腺嘌呤 FMN(磷酸核黄素 黄素单核苷酸) 异咯嗪-核醇-磷酸 第二节 酶的结构和作用机制 一、酶的活性中心 (一)酶的活性中心 酶与底物的结合不是随意的,酶分子有一定的区域与底物相合,这一区域的一些基团还直接参 与化学键的形成与断裂。这一特定区域称为酶的活性中心。 (二)酶的必需基团 存在于酶的活性中心的,直接参与化学键的形成与断裂的,与酶的催化活性密切相关基团,称 为酶的必需基团。 活性中心内的必需基团分为两种: 结合基团:其中与底物结合的称为结合基团, 催化基团:促进底物发生化学变化的称为催化基团。 有些必需基目兼有这两种作用。既是结合基团又是催化基团。 (三)活性中心的作用 活性中心是酶起专一性催化作用的关键部位。当活性中心被占据或空间结构被破坏时,酶就失 去作用。 (四)非活性中心的作用 酶分子中非活性中心部分也有着一定的作用。 1、维持酶的空间结构。 2、与免疫功能有关等等。 二、酶原激活
低。 ④酶的胶体性质与蛋白质相同。酶与蛋白质一样是大分子胶体化合物,不能透过半透膜。 ⑤酶的其它性质也与蛋白质相同。酶所具有的酸碱性质、降解作用、颜色反应(如双缩脲反应等)、 变性反应等理化性质与蛋白质相同。 以上所述这些现象都充分说明酶的化学本质是蛋白质。 (二)酶的组成 酶也与一般蛋白质一样,种类很多。根据许多精密的研究结果,按其化学结构来划分,可归纳为 两类组成:单纯蛋白酶和结合蛋白酶。 1、单纯蛋白酶 单纯蛋白酶又称单成分酶,其组成是由单纯蛋白质构成的。所以单纯蛋白酶水 解的终产物是氨基酸,再无其它物质。大多数水解酶都是单纯蛋白酶。如胃蛋白酶、脲酶、木瓜蛋白 酶等。 组成:单纯蛋白质 水解产物:氨基酸 实例:水解酶――胃蛋白酶、脲酶、木瓜蛋白酶等 2、结合蛋白酶 结合蛋白酶又称双成分酶。这些酶除含有蛋白质以外,还有其它非蛋白质成分。 结合蛋白酶的蛋白质部分称酶蛋白,非蛋白质部分称活性基或辅助因子。结合蛋白酶 必须是两部 分结合 起 来 组 成的全酶 才具有催化活性。全酶的任何一部分单独存在都不具有催化活性。 全酶(结合酶)=酶蛋白+活性基(辅酶或辅基) 在结合酶中,根据活性基与酶蛋白结合的松紧程度,活性基又辅酶与辅基之分。 辅基:与酶蛋白结合紧密,用透析法不易除去的活性基称辅基;辅酶:与酶蛋白结合疏松,易 被透析法除去的活性基称辅酶。活性基的成分有两类: 一类是低分子有机化合物如NAD、NADP、FAD、FMN等, 一类是无机金属离子,如Fe3+ 、Cu2+ 、Zn2 +、Mn2+ 等。 NAD(辅酶Ⅰ) 烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 NADP(辅酶Ⅱ)烟酰胺-核糖-磷酸-磷酸-核糖-腺嘌呤 │ 磷酸 FAD(黄素腺嘌呤二核苷酸) 异咯嗪-核醇-磷酸-磷酸-核糖-腺嘌呤 FMN(磷酸核黄素 黄素单核苷酸) 异咯嗪-核醇-磷酸 第二节 酶的结构和作用机制 一、酶的活性中心 (一)酶的活性中心 酶与底物的结合不是随意的,酶分子有一定的区域与底物相合,这一区域的一些基团还直接参 与化学键的形成与断裂。这一特定区域称为酶的活性中心。 (二)酶的必需基团 存在于酶的活性中心的,直接参与化学键的形成与断裂的,与酶的催化活性密切相关基团,称 为酶的必需基团。 活性中心内的必需基团分为两种: 结合基团:其中与底物结合的称为结合基团, 催化基团:促进底物发生化学变化的称为催化基团。 有些必需基目兼有这两种作用。既是结合基团又是催化基团。 (三)活性中心的作用 活性中心是酶起专一性催化作用的关键部位。当活性中心被占据或空间结构被破坏时,酶就失 去作用。 (四)非活性中心的作用 酶分子中非活性中心部分也有着一定的作用。 1、维持酶的空间结构。 2、与免疫功能有关等等。 二、酶原激活
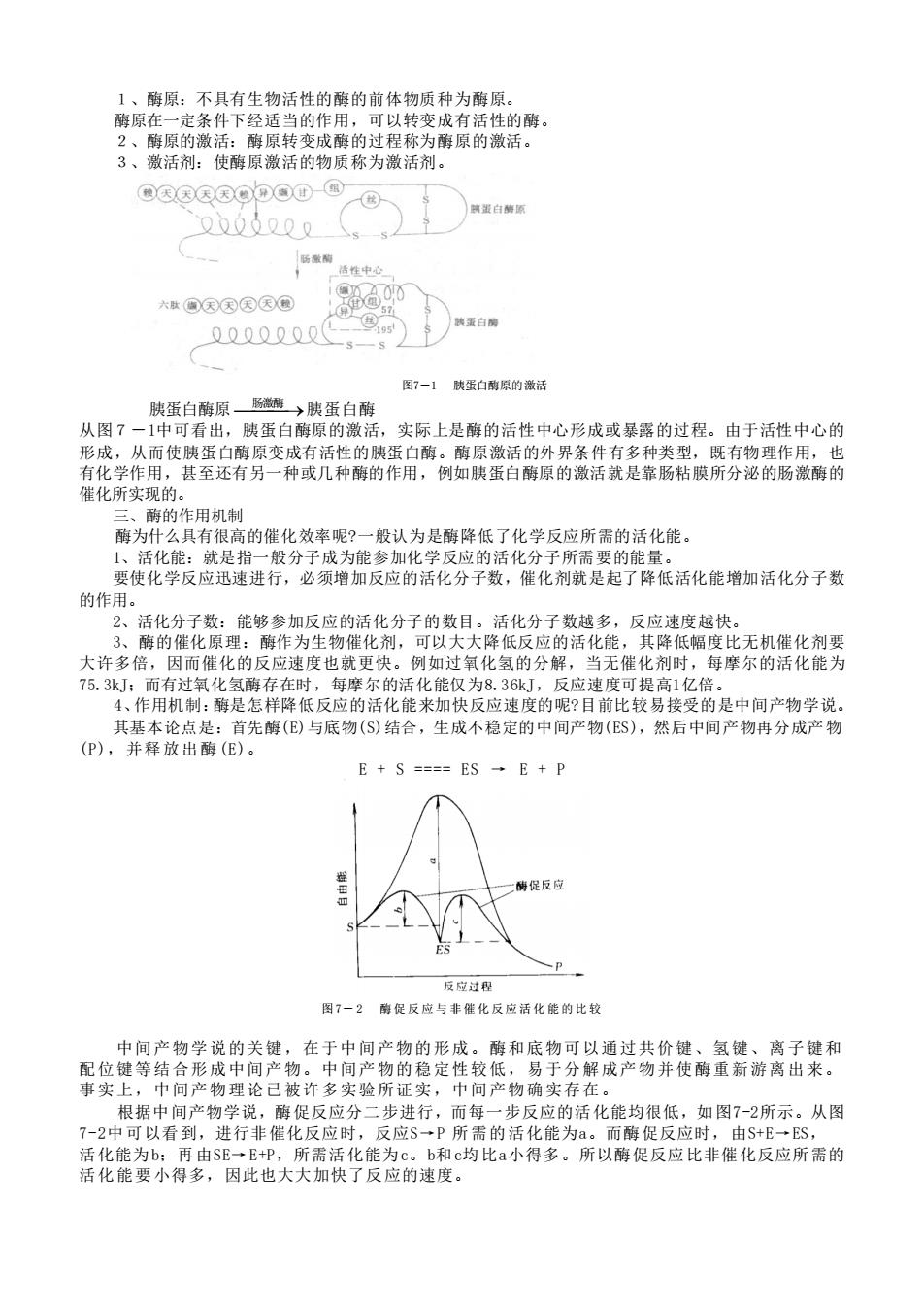
1、酶原:不具有生物活性的酶的前体物质种为酶原。 酶原在一定条件下经适当的作用,可以转变成有活性的酶。 2、酶原的激活:酶原转变成酶的过程称为酶原的激活。 3、激活剂:使酶原激活的物质称为激活剂。 图7-1 胰蛋白酶原的激活 胰蛋白酶原 ⎯肠激酶 ⎯⎯→ 胰蛋白酶 从图7-1中可看出,胰蛋白酶原的激活,实际上是酶的活性中心形成或暴露的过程。由于活性中心的 形成,从而使胰蛋白酶原变成有活性的胰蛋白酶。酶原激活的外界条件有多种类型,既有物理作用,也 有化学作用,甚至还有另一种或几种酶的作用,例如胰蛋白酶原的激活就是靠肠粘膜所分泌的肠激酶的 催化所实现的。 三、酶的作用机制 酶为什么具有很高的催化效率呢?一般认为是酶降低了化学反应所需的活化能。 1、活化能:就是指一般分子成为能参加化学反应的活化分子所需要的能量。 要使化学反应迅速进行,必须增加反应的活化分子数,催化剂就是起了降低活化能增加活化分子数 的作用。 2、活化分子数:能够参加反应的活化分子的数目。活化分子数越多,反应速度越快。 3、酶的催化原理:酶作为生物催化剂,可以大大降低反应的活化能,其降低幅度比无机催化剂要 大许多倍,因而催化的反应速度也就更快。例如过氧化氢的分解,当无催化剂时,每摩尔的活化能为 75.3kJ;而有过氧化氢酶存在时,每摩尔的活化能仅为8.36kJ,反应速度可提高1亿倍。 4、作用机制:酶是怎样降低反应的活化能来加快反应速度的呢?目前比较易接受的是中间产物学说。 其基本论点是:首先酶(E)与底物(S)结合,生成不稳定的中间产物(ES),然后中间产物再分成产物 (P),并释放出酶(E)。 E + S ==== ES → E + P 图 7- 2 酶促反应与非催化反应活化能的比较 中间产物学说的关键,在于中间产物的形成。酶和底物可以通过共价键、氢键、离子键和 配位键等结合形成中间产物。中间产物的稳定性较低,易于分解成产物并使酶重新游离出来。 事实上,中间产物理论已被许多实验所证实,中间产物确实存在。 根据中间产物学说,酶促反应分二步进行,而每一步反应的活化能均很低,如图7-2所示。从图 7-2中可以看到,进行非催化反应时,反应S→P 所需的活化能为a。而酶促反应时,由S+E→ES, 活化能为b;再由SE→E+P,所需活化能为c。b和c均比a小得多。所以酶促反应比非催化反应所需的 活化能要小得多,因此也大大加快了反应的速度
1、酶原:不具有生物活性的酶的前体物质种为酶原。 酶原在一定条件下经适当的作用,可以转变成有活性的酶。 2、酶原的激活:酶原转变成酶的过程称为酶原的激活。 3、激活剂:使酶原激活的物质称为激活剂。 图7-1 胰蛋白酶原的激活 胰蛋白酶原 ⎯肠激酶 ⎯⎯→ 胰蛋白酶 从图7-1中可看出,胰蛋白酶原的激活,实际上是酶的活性中心形成或暴露的过程。由于活性中心的 形成,从而使胰蛋白酶原变成有活性的胰蛋白酶。酶原激活的外界条件有多种类型,既有物理作用,也 有化学作用,甚至还有另一种或几种酶的作用,例如胰蛋白酶原的激活就是靠肠粘膜所分泌的肠激酶的 催化所实现的。 三、酶的作用机制 酶为什么具有很高的催化效率呢?一般认为是酶降低了化学反应所需的活化能。 1、活化能:就是指一般分子成为能参加化学反应的活化分子所需要的能量。 要使化学反应迅速进行,必须增加反应的活化分子数,催化剂就是起了降低活化能增加活化分子数 的作用。 2、活化分子数:能够参加反应的活化分子的数目。活化分子数越多,反应速度越快。 3、酶的催化原理:酶作为生物催化剂,可以大大降低反应的活化能,其降低幅度比无机催化剂要 大许多倍,因而催化的反应速度也就更快。例如过氧化氢的分解,当无催化剂时,每摩尔的活化能为 75.3kJ;而有过氧化氢酶存在时,每摩尔的活化能仅为8.36kJ,反应速度可提高1亿倍。 4、作用机制:酶是怎样降低反应的活化能来加快反应速度的呢?目前比较易接受的是中间产物学说。 其基本论点是:首先酶(E)与底物(S)结合,生成不稳定的中间产物(ES),然后中间产物再分成产物 (P),并释放出酶(E)。 E + S ==== ES → E + P 图 7- 2 酶促反应与非催化反应活化能的比较 中间产物学说的关键,在于中间产物的形成。酶和底物可以通过共价键、氢键、离子键和 配位键等结合形成中间产物。中间产物的稳定性较低,易于分解成产物并使酶重新游离出来。 事实上,中间产物理论已被许多实验所证实,中间产物确实存在。 根据中间产物学说,酶促反应分二步进行,而每一步反应的活化能均很低,如图7-2所示。从图 7-2中可以看到,进行非催化反应时,反应S→P 所需的活化能为a。而酶促反应时,由S+E→ES, 活化能为b;再由SE→E+P,所需活化能为c。b和c均比a小得多。所以酶促反应比非催化反应所需的 活化能要小得多,因此也大大加快了反应的速度

第三节 影响酶促反应的因素 因为酶的本质为蛋白质,所以酶促反应过程势必容易受到环境因素对它的制约和影响。这些因 素主要包括温度、pH、酶浓度、底物浓度等。 一、温度 温度是酶促反应的重要影响因素之一。主要表现为二方面: 第一阶段:随着温度的升高,反应速度增大,达到最大值。 原因:是由于温度的升高,使反应的活化分子数增加,在一定的温度范围内,温度升高,酶促 反应速度增大。当升到某一温度 时,反应速度达到最大。 第二阶段:当温度升高到一定值时,若继续升高温度,酶促反应速度则不再提高,反而降低。 如图7-3。 原因:这是由于当超过某温度时,酶蛋白的热变性使酶变性失活,使得酶促反应速度迅速下降。 最适温度:我们把酶促反应速度达到最大值时的温度称为酶促反应的最适温度。 图7-3 温度对酶促反应速度的影响 不同的酶,最适温度有所不同。植物体内的酶,最适温度一般在45~50℃;动物体内的酶,最 适温度一般在37~40℃。最适温度 不是酶的特征常数,它与实验条件有关。 影响最适温度的因素:反应时间的长短、酶浓度以及pH等条件对最适温度都有影响。例如,作 用时间长,最适温度降低;反之则较高。 低温也使酶的活性降低,但不破坏酶。当温度回升时,酶的催化活性又可随之恢复。例如在8~ 12min内将活鱼速冻至-50℃后运到较远的市场,售卖时解冻复活,这就从根本上保证了鱼的鲜活度, 使人们随时吃到活鱼。这就是应用了低温不破坏酶活性的原理。 当温度较高,酶变性以后,一般不会再恢复活性。食品生产中的巴氏消毒、煮沸、高压蒸汽灭 菌、烹饪加工中蔬菜的焯水处理等,就是利用高温使食品或原料内的酶或微生物酶受热变性,从而 达到食物加工的目的。 二、pH pH对酶促反应速度的影响是复杂的,它不但影响酶的稳定性,而且还影响酶的活性部位中重要 基团的解离状态、酶-底物复 合物的解离状态以及底物的解离状态,从而影响酶的反应速度。 图 7-4 pH对酶促反应速度的影响 绝大多数酶的反应速度随着pH的变化往往呈钟罩形曲线,如图7-4所示。曲线的最高峰是酶促反应 速度最大时的pH,我们称为最适pH。 最适pH:酶促反应速度最大时的pH
第三节 影响酶促反应的因素 因为酶的本质为蛋白质,所以酶促反应过程势必容易受到环境因素对它的制约和影响。这些因 素主要包括温度、pH、酶浓度、底物浓度等。 一、温度 温度是酶促反应的重要影响因素之一。主要表现为二方面: 第一阶段:随着温度的升高,反应速度增大,达到最大值。 原因:是由于温度的升高,使反应的活化分子数增加,在一定的温度范围内,温度升高,酶促 反应速度增大。当升到某一温度 时,反应速度达到最大。 第二阶段:当温度升高到一定值时,若继续升高温度,酶促反应速度则不再提高,反而降低。 如图7-3。 原因:这是由于当超过某温度时,酶蛋白的热变性使酶变性失活,使得酶促反应速度迅速下降。 最适温度:我们把酶促反应速度达到最大值时的温度称为酶促反应的最适温度。 图7-3 温度对酶促反应速度的影响 不同的酶,最适温度有所不同。植物体内的酶,最适温度一般在45~50℃;动物体内的酶,最 适温度一般在37~40℃。最适温度 不是酶的特征常数,它与实验条件有关。 影响最适温度的因素:反应时间的长短、酶浓度以及pH等条件对最适温度都有影响。例如,作 用时间长,最适温度降低;反之则较高。 低温也使酶的活性降低,但不破坏酶。当温度回升时,酶的催化活性又可随之恢复。例如在8~ 12min内将活鱼速冻至-50℃后运到较远的市场,售卖时解冻复活,这就从根本上保证了鱼的鲜活度, 使人们随时吃到活鱼。这就是应用了低温不破坏酶活性的原理。 当温度较高,酶变性以后,一般不会再恢复活性。食品生产中的巴氏消毒、煮沸、高压蒸汽灭 菌、烹饪加工中蔬菜的焯水处理等,就是利用高温使食品或原料内的酶或微生物酶受热变性,从而 达到食物加工的目的。 二、pH pH对酶促反应速度的影响是复杂的,它不但影响酶的稳定性,而且还影响酶的活性部位中重要 基团的解离状态、酶-底物复 合物的解离状态以及底物的解离状态,从而影响酶的反应速度。 图 7-4 pH对酶促反应速度的影响 绝大多数酶的反应速度随着pH的变化往往呈钟罩形曲线,如图7-4所示。曲线的最高峰是酶促反应 速度最大时的pH,我们称为最适pH。 最适pH:酶促反应速度最大时的pH

各种酶的最适pH各不相同。 一般酶的最适pH在4~8之间。 植物和微生物体内的酶,其最适pH多在4.5~6.5之间; 动物体内大多数酶,其最适pH接近中性,一般为6.5~8.0之间。个别酶的最适pH可在较强的酸 性或碱性区域,如胃蛋白酶的最适pH为1.5,精氨酸酶的最适pH为9.7。另外,同是蛋白酶,由于来 源不同,它们的最适pH差别也很大。所谓中性蛋白酶、碱性蛋白酶、酸性蛋白酶是指它们的最适pH 分别在中性、碱性、酸性的pH区域。 中性蛋白酶 酸性蛋白酶 碱性蛋白酶 的最适PH在 碱性区域 酸性区域 中性区域 与酶的最适温度一样,酶作用的最适pH也不是一个特征常数。它也受其它因素的影响。 影响最适pH的因素:如酶的纯度,底物的种类和浓度,缓冲液的种类和浓度等。所以,酶的最 适pH只有在一定条件下才有意义,如表7-2所示。 表7-2 一些酶的最适pH 酶 最适 pH 胃蛋白酶 组织蛋白酶(肝) 凝乳酶(牛胃) β-淀粉酶(麦芽) α-淀粉酶(细菌) 1.5 3.5~5 3.5 5.2 5.2 果胶酶(植物) 胰蛋白酶 过氧化物酶(动物) 蛋白酶(栖土曲霉) 精氨酸酶 7.0 7.7 7.6 8.5~9.0 9.7 三、酶浓度 当底物足够过量,其它条件固定,在反应系统中不含有抑制 酶活性的物质,以及无其它不利于酶发挥作用的因素时,酶促反 应的速度和酶浓度成正比。如图7-5所示。 (E) 酶浓度 (S)底物浓度 图 7-5 酶 浓 度 对 酶 促反 应速 度的 影响 四、底物浓度 所有的酶促反应,如果其它条件恒定,则反应速度决定于酶浓度和底物浓度。如果酶浓度保持不 变,当底物浓度增加时,反应的初速度随之增加,并以双曲线形式达到最大速度。如图7-6所示。图 7-6的曲线表明,在底物浓度较低时,反应速度随底物浓度的增加而急剧加快,两者成正比关系。 当底物浓度较高时,反应速度虽然也随底物的增加而增加,但增加程度却不如底物浓度较低时那样 明显,反应速度与底物浓度不再成正比关系。当底物浓度达到一定程度时,反应速度将趋于恒定, 即使再增加底物浓度,反应速度也不会增加了,即达到最大速度(Vmax)
各种酶的最适pH各不相同。 一般酶的最适pH在4~8之间。 植物和微生物体内的酶,其最适pH多在4.5~6.5之间; 动物体内大多数酶,其最适pH接近中性,一般为6.5~8.0之间。个别酶的最适pH可在较强的酸 性或碱性区域,如胃蛋白酶的最适pH为1.5,精氨酸酶的最适pH为9.7。另外,同是蛋白酶,由于来 源不同,它们的最适pH差别也很大。所谓中性蛋白酶、碱性蛋白酶、酸性蛋白酶是指它们的最适pH 分别在中性、碱性、酸性的pH区域。 中性蛋白酶 酸性蛋白酶 碱性蛋白酶 的最适PH在 碱性区域 酸性区域 中性区域 与酶的最适温度一样,酶作用的最适pH也不是一个特征常数。它也受其它因素的影响。 影响最适pH的因素:如酶的纯度,底物的种类和浓度,缓冲液的种类和浓度等。所以,酶的最 适pH只有在一定条件下才有意义,如表7-2所示。 表7-2 一些酶的最适pH 酶 最适 pH 胃蛋白酶 组织蛋白酶(肝) 凝乳酶(牛胃) β-淀粉酶(麦芽) α-淀粉酶(细菌) 1.5 3.5~5 3.5 5.2 5.2 果胶酶(植物) 胰蛋白酶 过氧化物酶(动物) 蛋白酶(栖土曲霉) 精氨酸酶 7.0 7.7 7.6 8.5~9.0 9.7 三、酶浓度 当底物足够过量,其它条件固定,在反应系统中不含有抑制 酶活性的物质,以及无其它不利于酶发挥作用的因素时,酶促反 应的速度和酶浓度成正比。如图7-5所示。 (E) 酶浓度 (S)底物浓度 图 7-5 酶 浓 度 对 酶 促反 应速 度的 影响 四、底物浓度 所有的酶促反应,如果其它条件恒定,则反应速度决定于酶浓度和底物浓度。如果酶浓度保持不 变,当底物浓度增加时,反应的初速度随之增加,并以双曲线形式达到最大速度。如图7-6所示。图 7-6的曲线表明,在底物浓度较低时,反应速度随底物浓度的增加而急剧加快,两者成正比关系。 当底物浓度较高时,反应速度虽然也随底物的增加而增加,但增加程度却不如底物浓度较低时那样 明显,反应速度与底物浓度不再成正比关系。当底物浓度达到一定程度时,反应速度将趋于恒定, 即使再增加底物浓度,反应速度也不会增加了,即达到最大速度(Vmax)

图 7-6 底 物 浓 度 对 酶 促反 应 速度 的影 响 底物浓度与反应速度之间的这种关系,可用中间产物学说解释:按照中间产物学说,酶促反应 速度决定于中间产物的浓度,而不是简单地与底物浓度成正比。当底物浓度很低时,底物的量不足 以结合所有的酶,此时增加底物浓度,中间产物随之增加,反应速度亦随之加快;当底物浓度增加 至一定程度时,全部的酶都与底物结合成中间产物,反应速度已达到最大值,此时即使再增加底物 浓度也不会增加中间产物的浓度,反应速度于是趋于恒定。 五、激活剂和抑制剂 激活剂:凡是能提高酶活性的物质,都称为激活剂。 选择性:激活剂对酶的作用具有一定的选择性。有时一种酶激活剂对某种酶能起激活作用,而对 另一种酶则可能不起作用。 种 类:酶的激活剂多为无机离子或简单有机化合物。 无机离子如K +、Na+、Mg2+、Zn2+、Fe2+、Ca2+、C1-、I -、Br-、NO-等等。氯离子能使唾液淀粉酶的 活力增强,它是唾液淀粉酶的激活剂。镁离子是多种激酶和合成酶的激活剂。 简单的有机化合物有抗坏血酸、半胱氨酸、谷胱甘肽等,对酶也有一定的激活作用。 许多化合物能与一定的酶进行可逆或不可逆的结合,使酶的催化作用受到抑制。 抑制剂:凡是能降低酶活性的物质,称之为抑制剂。 如药物、抗生素、毒物,抗生代谢物等都是酶的抑制剂。一些动物、植物组织和微生物能产生 多种水解酶的抑制剂,如果加工处 理不当,会影响其食用安全性和营养价值。 第四节 重要的酶类 烹饪领域所涉及的酶主要有三种: ①新鲜的生物性烹饪原料中的酶类。它们的存在直接影响到烹饪原料的质量变化。 任何动植物和微生物来源的新鲜食物,均含有一定的酶类,这些内源酶类对食品的风味、质构、 色泽等感官质量具有重要的影响,其作用有的是期望的,有的则是不期望的。如动物屠宰后,水解 酶类的作用使肉质嫩化,改善肉食原料的风味和质构;水果成熟时,内源酶类综合作用的结果使各 种水果具有各自独特的色、香、味,但如果过渡作用,水果会变得过熟和酥软,甚至失去食用价值。 ②烹饪加工过程中所涉及的酶类。 在食品加工、储藏过程中,有酚酶、过氧化物酶、脂肪氧化酶、维生素C氧化酶等氧化酶类引 起的酶促褐变对许多食品的感官质量具有极为重要的影响。另外这些酶的存在还会直接或间接的导 致一些营养成分(如维生素A原、维生素B、维生素C等)的损失。 ③营养物质在人体内进行代谢所涉及的酶类。 淀粉酶、蛋白酶、脂肪酶等。 一、淀粉酶 来源:淀粉酶广泛地存在于动物、植物和微生物体中, 功能:是水解淀粉、糖原及其衍生物中的α-1,4-葡萄糖苷键。分类:α-淀粉酶、β-淀粉酶、 γ-淀粉酶、R-酶。 (一)α-淀粉酶――作用于α-1,4-糖苷键 1、水解直链淀粉 α-淀粉酶是以随机的方式从淀粉分子内部水解α-1,4-糖苷键,使淀粉成为含有5~8个葡萄糖残 基的低级糊精。使之成为粘度较小的溶液。之后再缓慢水解,最终产物是麦芽糖和葡萄糖。 直链淀粉 ⎯α⎯-淀粉酶水解 ⎯ ⎯→ 低级糊精( DP ~ =5~8)→葡萄糖、麦芽糖 2、水解支链淀粉 作用方式相同,水解产物和直链淀粉相比有什么异同呢? 分析直链淀粉和直链淀粉的结构异同: 直链淀粉――α-1,4-糖苷键;
图 7-6 底 物 浓 度 对 酶 促反 应 速度 的影 响 底物浓度与反应速度之间的这种关系,可用中间产物学说解释:按照中间产物学说,酶促反应 速度决定于中间产物的浓度,而不是简单地与底物浓度成正比。当底物浓度很低时,底物的量不足 以结合所有的酶,此时增加底物浓度,中间产物随之增加,反应速度亦随之加快;当底物浓度增加 至一定程度时,全部的酶都与底物结合成中间产物,反应速度已达到最大值,此时即使再增加底物 浓度也不会增加中间产物的浓度,反应速度于是趋于恒定。 五、激活剂和抑制剂 激活剂:凡是能提高酶活性的物质,都称为激活剂。 选择性:激活剂对酶的作用具有一定的选择性。有时一种酶激活剂对某种酶能起激活作用,而对 另一种酶则可能不起作用。 种 类:酶的激活剂多为无机离子或简单有机化合物。 无机离子如K +、Na+、Mg2+、Zn2+、Fe2+、Ca2+、C1-、I -、Br-、NO-等等。氯离子能使唾液淀粉酶的 活力增强,它是唾液淀粉酶的激活剂。镁离子是多种激酶和合成酶的激活剂。 简单的有机化合物有抗坏血酸、半胱氨酸、谷胱甘肽等,对酶也有一定的激活作用。 许多化合物能与一定的酶进行可逆或不可逆的结合,使酶的催化作用受到抑制。 抑制剂:凡是能降低酶活性的物质,称之为抑制剂。 如药物、抗生素、毒物,抗生代谢物等都是酶的抑制剂。一些动物、植物组织和微生物能产生 多种水解酶的抑制剂,如果加工处 理不当,会影响其食用安全性和营养价值。 第四节 重要的酶类 烹饪领域所涉及的酶主要有三种: ①新鲜的生物性烹饪原料中的酶类。它们的存在直接影响到烹饪原料的质量变化。 任何动植物和微生物来源的新鲜食物,均含有一定的酶类,这些内源酶类对食品的风味、质构、 色泽等感官质量具有重要的影响,其作用有的是期望的,有的则是不期望的。如动物屠宰后,水解 酶类的作用使肉质嫩化,改善肉食原料的风味和质构;水果成熟时,内源酶类综合作用的结果使各 种水果具有各自独特的色、香、味,但如果过渡作用,水果会变得过熟和酥软,甚至失去食用价值。 ②烹饪加工过程中所涉及的酶类。 在食品加工、储藏过程中,有酚酶、过氧化物酶、脂肪氧化酶、维生素C氧化酶等氧化酶类引 起的酶促褐变对许多食品的感官质量具有极为重要的影响。另外这些酶的存在还会直接或间接的导 致一些营养成分(如维生素A原、维生素B、维生素C等)的损失。 ③营养物质在人体内进行代谢所涉及的酶类。 淀粉酶、蛋白酶、脂肪酶等。 一、淀粉酶 来源:淀粉酶广泛地存在于动物、植物和微生物体中, 功能:是水解淀粉、糖原及其衍生物中的α-1,4-葡萄糖苷键。分类:α-淀粉酶、β-淀粉酶、 γ-淀粉酶、R-酶。 (一)α-淀粉酶――作用于α-1,4-糖苷键 1、水解直链淀粉 α-淀粉酶是以随机的方式从淀粉分子内部水解α-1,4-糖苷键,使淀粉成为含有5~8个葡萄糖残 基的低级糊精。使之成为粘度较小的溶液。之后再缓慢水解,最终产物是麦芽糖和葡萄糖。 直链淀粉 ⎯α⎯-淀粉酶水解 ⎯ ⎯→ 低级糊精( DP ~ =5~8)→葡萄糖、麦芽糖 2、水解支链淀粉 作用方式相同,水解产物和直链淀粉相比有什么异同呢? 分析直链淀粉和直链淀粉的结构异同: 直链淀粉――α-1,4-糖苷键;

支链淀粉――α-1,4-糖苷键、α-1,6-糖苷键。 支链淀粉 ⎯α⎯-淀粉酶水解 ⎯ ⎯→ 麦芽糖、异麦芽糖、葡萄糖 3、应用 在制造面包时,面粉中的α-淀粉酶为酵母提供糖分以改善产气能力,改善面团结构,延缓陈化 时间。在制造啤酒时,除去啤酒中由于残存淀粉所引起的雾状混浊。α-淀粉酶还影响粮食的食用质 量,陈米煮的饭不如新米好吃,其主要原因之一是因为陈米中的α-淀粉酶丧失了活性。 (二)β-淀粉酶 β-淀粉酶在水解淀粉分子时,从非还原性端基开始。每次切下 两个葡萄糖单位,即一个麦芽糖分子,并使麦芽糖分子的构型从α型变成β型。 1、水解直链淀粉 直链淀粉 ⎯β⎯-淀粉酶水解 ⎯ ⎯→ β-麦芽糖 2、水解支链淀粉 β-淀粉酶作用于支链淀粉时,只能使外部支链分解到α-1,6结合处为止,而对α-1,6结合内部 核心部分不能作用,最终产物是麦芽糖(54%)和界限糊精。 支链淀粉 ⎯β⎯-淀粉酶水解 ⎯ ⎯→ 界限糊精 麦芽糖 3、应用 β-淀粉酶对食品质量有很大的影响,如烤面包、发酵馒头,都需要面粉中含有一定量的β-淀 粉酶,以便提供可发酵的麦芽糖。 β-淀粉酶主要存在于大麦、小麦等种籽、根茎中,在哺乳动物中不存在。 (三)α-淀粉酶和β-淀粉酶性质比较: 分 子 量:α-淀粉酶<β-淀粉酶 热稳定性:α-淀粉酶>β-淀粉酶 例如:α-淀粉酶溶液在70℃下加热15分钟未有显著破坏,但同样处理β-淀粉酶溶液却使其活 性完全破坏。 二、蛋白酶类 定义:凡是能水解蛋白质或多肽的酶都可称为蛋白酶。 功能:水解蛋白质肽链中的肽键,使蛋白质成为多肽或氨基酸。 分类:根据蛋白质的水解方式可将蛋白酶分为内肽酶和外肽酶内肽酶:从肽链内部水解肽键,结 果主要得到较小的多肽碎片。外肽酶:从肽链的某一端开始水解肽键。故它又可以分为两类: 氨 肽酶:从肽链的氨基末端开始水解肽键,故称为氨肽酶; 羧肽酶:从肽链的羧基末端开始水解肽键,故称为羧肽酶。 (一)植物蛋白酶 木瓜蛋白酶:从番木瓜胶乳中得到。 菠萝蛋白酶:从菠萝汁和粉碎的基中提取。 是两种植物性蛋白酶。它们都是内肽酶。 作用:在烹饪中可使肉类嫩化。 (二)动物组织蛋白酶 动物组织蛋白酶存在于动物体的组织细胞内,在肌肉中的含量比在其它组织中的含量低。这种酶 在动物死亡后释放出来并被激活,产生催化作用,因而肉的食用质量与这种酶有密切的关系。 (三)消化道蛋白酶 人体消化道中的蛋白酶主要是胃蛋白酶、胰蛋白酶,胰糜蛋 白酶等,它们都是内肽酶,都可将蛋白质水解为眎,胨等低相对 分子质量的片段。 1、胃蛋白酶 胃分泌的胃蛋白酶原,在H +或已激活的胃蛋白酶作用下,脱去一段低相对分子质 量肽而成为有活性的胃蛋白酶。它可以在胃酸这样的环境中(pHl~4)起催化作用,而其它的酶在这样 的条件下则会变性失活。 2、胰蛋白酶 胰腺分泌的胰蛋白酶原,在肠激酶或已有活性的胰蛋白酶作用下,脱去一个六肽 片段而成为有活性的胰蛋白酶,其最适pH为7~9。 3、胰糜蛋白酶 胰腺分泌的胰糜蛋白酶原,在胰蛋白酶或胰糜蛋白酶的作用下,脱去两个二肽 片段,成为有活性的胰糜蛋白酶,其最适pH也是7~9。 (四)微生物蛋白酶
支链淀粉――α-1,4-糖苷键、α-1,6-糖苷键。 支链淀粉 ⎯α⎯-淀粉酶水解 ⎯ ⎯→ 麦芽糖、异麦芽糖、葡萄糖 3、应用 在制造面包时,面粉中的α-淀粉酶为酵母提供糖分以改善产气能力,改善面团结构,延缓陈化 时间。在制造啤酒时,除去啤酒中由于残存淀粉所引起的雾状混浊。α-淀粉酶还影响粮食的食用质 量,陈米煮的饭不如新米好吃,其主要原因之一是因为陈米中的α-淀粉酶丧失了活性。 (二)β-淀粉酶 β-淀粉酶在水解淀粉分子时,从非还原性端基开始。每次切下 两个葡萄糖单位,即一个麦芽糖分子,并使麦芽糖分子的构型从α型变成β型。 1、水解直链淀粉 直链淀粉 ⎯β⎯-淀粉酶水解 ⎯ ⎯→ β-麦芽糖 2、水解支链淀粉 β-淀粉酶作用于支链淀粉时,只能使外部支链分解到α-1,6结合处为止,而对α-1,6结合内部 核心部分不能作用,最终产物是麦芽糖(54%)和界限糊精。 支链淀粉 ⎯β⎯-淀粉酶水解 ⎯ ⎯→ 界限糊精 麦芽糖 3、应用 β-淀粉酶对食品质量有很大的影响,如烤面包、发酵馒头,都需要面粉中含有一定量的β-淀 粉酶,以便提供可发酵的麦芽糖。 β-淀粉酶主要存在于大麦、小麦等种籽、根茎中,在哺乳动物中不存在。 (三)α-淀粉酶和β-淀粉酶性质比较: 分 子 量:α-淀粉酶<β-淀粉酶 热稳定性:α-淀粉酶>β-淀粉酶 例如:α-淀粉酶溶液在70℃下加热15分钟未有显著破坏,但同样处理β-淀粉酶溶液却使其活 性完全破坏。 二、蛋白酶类 定义:凡是能水解蛋白质或多肽的酶都可称为蛋白酶。 功能:水解蛋白质肽链中的肽键,使蛋白质成为多肽或氨基酸。 分类:根据蛋白质的水解方式可将蛋白酶分为内肽酶和外肽酶内肽酶:从肽链内部水解肽键,结 果主要得到较小的多肽碎片。外肽酶:从肽链的某一端开始水解肽键。故它又可以分为两类: 氨 肽酶:从肽链的氨基末端开始水解肽键,故称为氨肽酶; 羧肽酶:从肽链的羧基末端开始水解肽键,故称为羧肽酶。 (一)植物蛋白酶 木瓜蛋白酶:从番木瓜胶乳中得到。 菠萝蛋白酶:从菠萝汁和粉碎的基中提取。 是两种植物性蛋白酶。它们都是内肽酶。 作用:在烹饪中可使肉类嫩化。 (二)动物组织蛋白酶 动物组织蛋白酶存在于动物体的组织细胞内,在肌肉中的含量比在其它组织中的含量低。这种酶 在动物死亡后释放出来并被激活,产生催化作用,因而肉的食用质量与这种酶有密切的关系。 (三)消化道蛋白酶 人体消化道中的蛋白酶主要是胃蛋白酶、胰蛋白酶,胰糜蛋 白酶等,它们都是内肽酶,都可将蛋白质水解为眎,胨等低相对 分子质量的片段。 1、胃蛋白酶 胃分泌的胃蛋白酶原,在H +或已激活的胃蛋白酶作用下,脱去一段低相对分子质 量肽而成为有活性的胃蛋白酶。它可以在胃酸这样的环境中(pHl~4)起催化作用,而其它的酶在这样 的条件下则会变性失活。 2、胰蛋白酶 胰腺分泌的胰蛋白酶原,在肠激酶或已有活性的胰蛋白酶作用下,脱去一个六肽 片段而成为有活性的胰蛋白酶,其最适pH为7~9。 3、胰糜蛋白酶 胰腺分泌的胰糜蛋白酶原,在胰蛋白酶或胰糜蛋白酶的作用下,脱去两个二肽 片段,成为有活性的胰糜蛋白酶,其最适pH也是7~9。 (四)微生物蛋白酶

细菌、酵母菌、霉菌等微生物中都含有多种蛋白酶,是蛋白酶 制剂的重要来源。我国目前生产的微生物蛋白酶及菌种主要有:用枯草杆菌1398和栖土曲霉3952生产 中性蛋白酶,用地衣芽孢杆菌2709生产碱性碱白酶等。生产用于食品和药物的微生物蛋白酶,其菌种 目前主要限于枯草杆菌、黑曲霉、米曲霉三种。 种类 酵母蛋白酶 米曲霉 用于食品 黑曲霉 用于食品 霉菌蛋白酶 地衣芽孢杆菌 枯草杆菌 用于食品 细菌蛋白酶 - - - 应用: 1 、食品加工 酱油 啤酒 肉质嫩化 面包薄脆饼干 2 、医药 3 、洗涤剂――增强去污效果。 三、脂肪酶 脂肪酶又称脂肪水解酶,它能把脂肪水解为脂肪酸和甘油。最适温度30~40℃,最适pH一般在8 左右。脂肪酶只有在甘油酯和水所构成的乳状液中才有较大的活性。 粮油中含有脂肪酶,常常使一定量的脂肪被催化水解而使游离脂肪酸含量升高,从而导致粮油 的变质变味、品质下降。在原料中,脂肪酶与它作用的底物在细胞中各有固定的位置,彼此不易发 生反应。但制成成品粮后,使两者有了接触的机会,因此原料比成品粮更易于贮存。 在人体消化道中含有胃脂肪酶、胰脂肪酶等脂肪水解酶,对 脂肪的消化起着很重要的作用。 四、酚酶 酚酶以Cu为辅基,以氧为受氢体。它作用的底物为一元或二元酚(邻酚),因此有人认为它是一种 酶,兼能作用于一元酚和二元酚两类底物;也有人认为它是由酚羟化酶(也称甲酚酶)和多元酚氧化酶 (又称儿茶酚酶)构成的复合体。 酚酶广泛存在于植物界,许多蔬菜、水果的酶促褐变都因它而引起。茶叶、可可豆等饮料的色泽 形成也与酚酶有关。某些粮食在烹饪中的变色现象,如甘薯粉、荞麦面蒸煮变黑,糯米粉蒸煮变红等, 也可能与酚酶有关。 复习思考题 1、什么是酶?酶有何特点? 2、什么是全酶?辅酶和辅基如何区别? 3、为什么说酶的化学本质是蛋白质? 4、什么是酶的活性中心?中心内有哪两种基团,各有何功能? 5、何谓酶原和酶原激活? 6、中间产物学说的主要内容是什么? 7、什么是酶促反应的最适温度和最适pH? 8、影响酶促反应速度的主要因素有哪些? 9、何谓激素?人体中的激素主要分为几类?有何重要的生理功能?
细菌、酵母菌、霉菌等微生物中都含有多种蛋白酶,是蛋白酶 制剂的重要来源。我国目前生产的微生物蛋白酶及菌种主要有:用枯草杆菌1398和栖土曲霉3952生产 中性蛋白酶,用地衣芽孢杆菌2709生产碱性碱白酶等。生产用于食品和药物的微生物蛋白酶,其菌种 目前主要限于枯草杆菌、黑曲霉、米曲霉三种。 种类 酵母蛋白酶 米曲霉 用于食品 黑曲霉 用于食品 霉菌蛋白酶 地衣芽孢杆菌 枯草杆菌 用于食品 细菌蛋白酶 - - - 应用: 1 、食品加工 酱油 啤酒 肉质嫩化 面包薄脆饼干 2 、医药 3 、洗涤剂――增强去污效果。 三、脂肪酶 脂肪酶又称脂肪水解酶,它能把脂肪水解为脂肪酸和甘油。最适温度30~40℃,最适pH一般在8 左右。脂肪酶只有在甘油酯和水所构成的乳状液中才有较大的活性。 粮油中含有脂肪酶,常常使一定量的脂肪被催化水解而使游离脂肪酸含量升高,从而导致粮油 的变质变味、品质下降。在原料中,脂肪酶与它作用的底物在细胞中各有固定的位置,彼此不易发 生反应。但制成成品粮后,使两者有了接触的机会,因此原料比成品粮更易于贮存。 在人体消化道中含有胃脂肪酶、胰脂肪酶等脂肪水解酶,对 脂肪的消化起着很重要的作用。 四、酚酶 酚酶以Cu为辅基,以氧为受氢体。它作用的底物为一元或二元酚(邻酚),因此有人认为它是一种 酶,兼能作用于一元酚和二元酚两类底物;也有人认为它是由酚羟化酶(也称甲酚酶)和多元酚氧化酶 (又称儿茶酚酶)构成的复合体。 酚酶广泛存在于植物界,许多蔬菜、水果的酶促褐变都因它而引起。茶叶、可可豆等饮料的色泽 形成也与酚酶有关。某些粮食在烹饪中的变色现象,如甘薯粉、荞麦面蒸煮变黑,糯米粉蒸煮变红等, 也可能与酚酶有关。 复习思考题 1、什么是酶?酶有何特点? 2、什么是全酶?辅酶和辅基如何区别? 3、为什么说酶的化学本质是蛋白质? 4、什么是酶的活性中心?中心内有哪两种基团,各有何功能? 5、何谓酶原和酶原激活? 6、中间产物学说的主要内容是什么? 7、什么是酶促反应的最适温度和最适pH? 8、影响酶促反应速度的主要因素有哪些? 9、何谓激素?人体中的激素主要分为几类?有何重要的生理功能?