
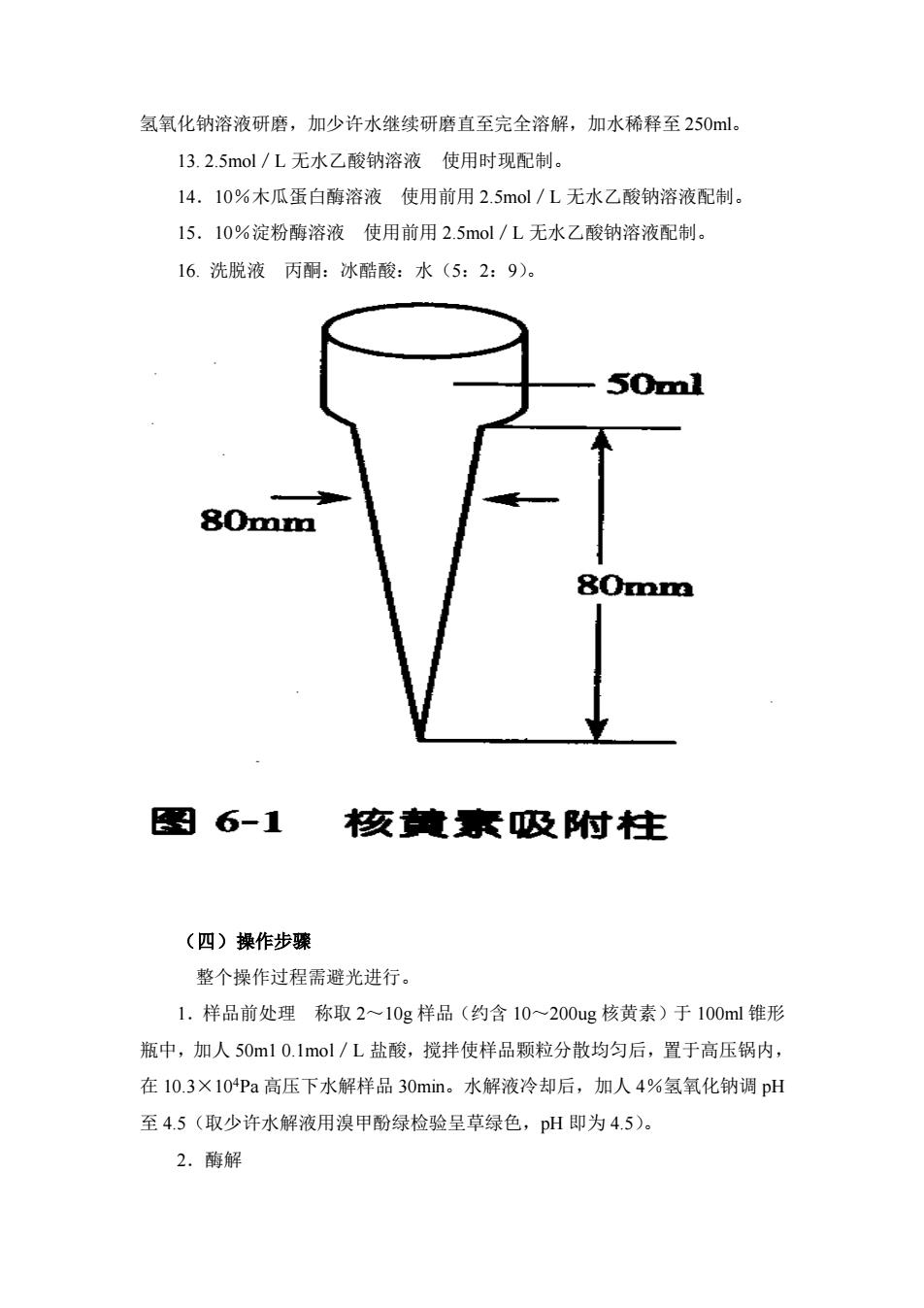
实验五 食物中核黄素含量测定 (荧光法) (-)目的意义 核黄素是机体的物质代谢和能量代谢中不可缺少的物质。通过测定食物中核 黄素含量,可了解人体核黄素摄入情况。 (二)原理 核黄素受到波长为 440~500nm 的光照射后能产生光黄素(luniflavin),此 物质能产生较强的荧光。在稀溶液中其荧光强度与核黄素浓度成正比。 试液中再加人低亚硫酸钠(Na2S2O4),将荧光素还原为无荧光物质。然后再 测定试液中残余荧光物质的荧光强度,两者之差即为食品中核黄素所产生的荧光 强度。 (三)仪器与试剂 1.荧光光度计 2.高压消毒锅 3.锥形烧瓶,核黄素吸附柱(如图 6-1) 4. 1.0mol/L 盐酸溶液 吸取分析纯浓盐酸 83.3ml 于 1L 容量瓶中,加蒸馏 水稀释至刻度。 5. 0.lmol/L 盐酸溶液 将上液按 1:10 稀释。 6.4%氢氧化钠溶液,0.4%氢氧化钠溶液。 7.3%高锰酸钾溶液。 8.3%过氧化氢溶液。 9.核黄素储备液(23ug/ml) 精确称取已干燥过的核黄素(在干燥器中放 置 24h)25mg,加少量蒸馏水溶解后倒入 1L 容量瓶,加蒸馏水 500ml,加入 2.4ml 冰醋酸,将其放在温水中摇动使颗粒完全溶解,冷却后稀释至刻度,加入少量甲 苯,避光冷藏备用。 10. 核黄素工作液(0.lug/ml) 吸取上液 1.0ml,加水稀释至 250ml。避光, 贮于 4℃冰箱中可保存 1 周。 11.20%低亚硫酸钠溶液 用时现配,保存在冰水浴中,4h 内有效。 12. 0.04%溴甲酚绿指示剂 称取 0.1g 溴甲酚绿于小研钵中,加 1.4m1 0.4%
实验五 食物中核黄素含量测定 (荧光法) (-)目的意义 核黄素是机体的物质代谢和能量代谢中不可缺少的物质。通过测定食物中核 黄素含量,可了解人体核黄素摄入情况。 (二)原理 核黄素受到波长为 440~500nm 的光照射后能产生光黄素(luniflavin),此 物质能产生较强的荧光。在稀溶液中其荧光强度与核黄素浓度成正比。 试液中再加人低亚硫酸钠(Na2S2O4),将荧光素还原为无荧光物质。然后再 测定试液中残余荧光物质的荧光强度,两者之差即为食品中核黄素所产生的荧光 强度。 (三)仪器与试剂 1.荧光光度计 2.高压消毒锅 3.锥形烧瓶,核黄素吸附柱(如图 6-1) 4. 1.0mol/L 盐酸溶液 吸取分析纯浓盐酸 83.3ml 于 1L 容量瓶中,加蒸馏 水稀释至刻度。 5. 0.lmol/L 盐酸溶液 将上液按 1:10 稀释。 6.4%氢氧化钠溶液,0.4%氢氧化钠溶液。 7.3%高锰酸钾溶液。 8.3%过氧化氢溶液。 9.核黄素储备液(23ug/ml) 精确称取已干燥过的核黄素(在干燥器中放 置 24h)25mg,加少量蒸馏水溶解后倒入 1L 容量瓶,加蒸馏水 500ml,加入 2.4ml 冰醋酸,将其放在温水中摇动使颗粒完全溶解,冷却后稀释至刻度,加入少量甲 苯,避光冷藏备用。 10. 核黄素工作液(0.lug/ml) 吸取上液 1.0ml,加水稀释至 250ml。避光, 贮于 4℃冰箱中可保存 1 周。 11.20%低亚硫酸钠溶液 用时现配,保存在冰水浴中,4h 内有效。 12. 0.04%溴甲酚绿指示剂 称取 0.1g 溴甲酚绿于小研钵中,加 1.4m1 0.4%
氢氧化钠溶液研磨,加少许水继续研磨直至完全溶解,加水稀释至 250ml。 13. 2.5mol/L 无水乙酸钠溶液 使用时现配制。 14.10%木瓜蛋白酶溶液 使用前用 2.5mol/L 无水乙酸钠溶液配制。 15.10%淀粉酶溶液 使用前用 2.5mol/L 无水乙酸钠溶液配制。 16. 洗脱液 丙酮:冰酷酸:水(5:2:9)。 (四)操作步骤 整个操作过程需避光进行。 1.样品前处理 称取 2~10g 样品(约含 10~200ug 核黄素)于 100ml 锥形 瓶中,加人 50m1 0.1mol/L 盐酸,搅拌使样品颗粒分散均匀后,置于高压锅内, 在 10.3×104Pa 高压下水解样品 30min。水解液冷却后,加人 4%氢氧化钠调 pH 至 4.5(取少许水解液用溴甲酚绿检验呈草绿色,pH 即为 4.5)。 2.酶解
氢氧化钠溶液研磨,加少许水继续研磨直至完全溶解,加水稀释至 250ml。 13. 2.5mol/L 无水乙酸钠溶液 使用时现配制。 14.10%木瓜蛋白酶溶液 使用前用 2.5mol/L 无水乙酸钠溶液配制。 15.10%淀粉酶溶液 使用前用 2.5mol/L 无水乙酸钠溶液配制。 16. 洗脱液 丙酮:冰酷酸:水(5:2:9)。 (四)操作步骤 整个操作过程需避光进行。 1.样品前处理 称取 2~10g 样品(约含 10~200ug 核黄素)于 100ml 锥形 瓶中,加人 50m1 0.1mol/L 盐酸,搅拌使样品颗粒分散均匀后,置于高压锅内, 在 10.3×104Pa 高压下水解样品 30min。水解液冷却后,加人 4%氢氧化钠调 pH 至 4.5(取少许水解液用溴甲酚绿检验呈草绿色,pH 即为 4.5)。 2.酶解

(1)含有淀粉样品的水解液加入 3ml 10%淀粉酶溶液,于 37~40℃保温约 16h。 (2)含有高蛋白样品的水解液加人 3ml 10%木瓜蛋白酶溶液,于 37~40℃保 温约 16h。 上述酶水解液用蒸馏水定容至 100ml,过滤。滤液在 4℃冰箱可保存 1 周。 3.氧化去杂质 取试管 2 支分别编号 A 和 B,按表 6-1 操作。 混匀后放置 2min 以氧化样品中的杂质与色素,再滴加 3%过氧化氢至溶液 褪色,以还原高锰酸钾。剧烈摇动试管,使多余氧气逸出。 4.核黄素的吸附与洗脱 吸附柱下端用一小团脱脂棉垫上,然后称取 1g 硅镁吸附剂湿法装柱(约 5cm 高)。勿使柱内产生气泡,调节流速为 60 滴/分 钟左右。将 A 和 B 管内氧化后的液体通过吸附柱后,用约 20ml 热蒸馏水洗脱样 品中的杂质,再用 5.0ml 洗脱液将核黄素洗脱,用具塞试管收集洗脱液,再用蒸 馏水洗脱吸附柱,收集洗出的液体合并于具塞试管中,定容至 10ml,混匀后留 待测荧光强度。 5.测定荧光强度 选择激发波长为 420nm,发射波长为 520nm,测定样品管 及标准管的荧光强度。然后,在各管的剩余液中加 0.1m1 20%低亚硫酸钠溶液, 立即混匀,在 20s 内测出各管的荧光值,作为各自的空白值。 (五)结果计算
(1)含有淀粉样品的水解液加入 3ml 10%淀粉酶溶液,于 37~40℃保温约 16h。 (2)含有高蛋白样品的水解液加人 3ml 10%木瓜蛋白酶溶液,于 37~40℃保 温约 16h。 上述酶水解液用蒸馏水定容至 100ml,过滤。滤液在 4℃冰箱可保存 1 周。 3.氧化去杂质 取试管 2 支分别编号 A 和 B,按表 6-1 操作。 混匀后放置 2min 以氧化样品中的杂质与色素,再滴加 3%过氧化氢至溶液 褪色,以还原高锰酸钾。剧烈摇动试管,使多余氧气逸出。 4.核黄素的吸附与洗脱 吸附柱下端用一小团脱脂棉垫上,然后称取 1g 硅镁吸附剂湿法装柱(约 5cm 高)。勿使柱内产生气泡,调节流速为 60 滴/分 钟左右。将 A 和 B 管内氧化后的液体通过吸附柱后,用约 20ml 热蒸馏水洗脱样 品中的杂质,再用 5.0ml 洗脱液将核黄素洗脱,用具塞试管收集洗脱液,再用蒸 馏水洗脱吸附柱,收集洗出的液体合并于具塞试管中,定容至 10ml,混匀后留 待测荧光强度。 5.测定荧光强度 选择激发波长为 420nm,发射波长为 520nm,测定样品管 及标准管的荧光强度。然后,在各管的剩余液中加 0.1m1 20%低亚硫酸钠溶液, 立即混匀,在 20s 内测出各管的荧光值,作为各自的空白值。 (五)结果计算

F—稀释倍数 W—样品重量,g S—标准管中核黄素含量;ug (六)结果说明 1. 加入低亚硫酸钠的量不能过多以免影响荧光强度,加入后必须立即读数, 否则核黄素又会被空气氧化为荧光型。 2.过氧化氢不宜多加,因会产生气泡而影响比色。 3.如加入高锰酸钾后有氧化锰细微褐色溶液混浊,可离心使之澄清。 4. 不能用皂粉洗涤玻璃器材,应用硫酸—重铬酸钾洗液浸洗,再以清水洗 净,继以蒸馏水冲洗
F—稀释倍数 W—样品重量,g S—标准管中核黄素含量;ug (六)结果说明 1. 加入低亚硫酸钠的量不能过多以免影响荧光强度,加入后必须立即读数, 否则核黄素又会被空气氧化为荧光型。 2.过氧化氢不宜多加,因会产生气泡而影响比色。 3.如加入高锰酸钾后有氧化锰细微褐色溶液混浊,可离心使之澄清。 4. 不能用皂粉洗涤玻璃器材,应用硫酸—重铬酸钾洗液浸洗,再以清水洗 净,继以蒸馏水冲洗