
《园艺植物育种学》 设计性实验指导书 胡桂兵刘成明编 华南农业大学 园艺学院果树学系 2003年10月
《园艺植物育种学》 设计性实验指导书 胡桂兵 刘成明编 华南农业大学 园艺学院果树学系 2003 年 10 月

《园艺植物育种学》 设计性实验指导 实验名称:园艺植物基因组DNA的提取及RAPD分析 隶属课程:《园艺植物育种学》 课程类别:必修课 预计学时:6学时 指导教师:胡桂兵副教授、刘成明教授、胡志群实验师 授课对象:园艺专业本科生 1
1 《园艺植物育种学》 设计性实验指导 实验名称:园艺植物基因组 DNA 的提取及 RAPD 分析 隶属课程:《园艺植物育种学》 课程类别:必修课 预计学时:6 学时 指导教师:胡桂兵副教授、刘成明教授、胡志群实验师 授课对象:园艺专业本科生

实验一园艺植物基因组DNA的提取及浓度测定 1目的 掌握用改良SDS法提取园艺植物总DNA的原理和方法,并分别用核 酸蛋白测定仪和凝胶电泳法检测出所提DNA的质量。 2原理 2.1DM提取:先用机械的方法使组织和细胞破碎,然后加入十二烷基疏酸 钠(sodium dodecyl sulfate,简称SDS)这个离子型表面活性剂,溶解细胞 膜和核膜蛋白,使细胞膜和核膜破裂,进入细胞核内的表面活性剂解聚核 中的核蛋白(并与蛋白质形成混合物):再加入苯酚和氯仿等表面活性剂, 使蛋白变性:经离心除去果树的组织和变性蛋白:上清液中加入无水乙醇 使DNA沉淀;沉淀DNA溶于TE溶液中,即得园艺植物总DNA溶液。 2.2分光光度(紫外吸收)法检测DNA质量:DNA的吸收峰在260nm, 对于双链DNA,OD26o=1.0时溶液浓度为50μgml,这样通过用紫外分光 光度计测定所提DNA溶液在26Onm的吸光值,可以计算出所提DNA的浓 度,计算公式为:DNA样品浓度(μg/μI)=OD26o×N(样品稀释倍数) ×50/1000。而蛋白质的吸收峰在280nm,核苷酸等小分子量物质的吸收峰 在230m,这样通过测定OD280和OD230的吸光值,计算出OD26o/OD20及 OD260/OD20的比值后,可以判断所提DNA的纯度:纯的DNA溶液其OD260 OD280及应为1.8,OD260/OD230应大于2.0。OD26/OD280大于1.9时,表明 有RNA污染;小于1.6时表明有蛋白质或酚污染。OD260/OD230小于2.0时
2 实验一 园艺植物基因组 DNA 的提取及浓度测定 1 目的 掌握用改良 SDS 法提取园艺植物总 DNA 的原理和方法,并分别用核 酸蛋白测定仪和凝胶电泳法检测出所提 DNA 的质量。 2 原理 2.1 DNA 提取:先用机械的方法使组织和细胞破碎,然后加入十二烷基硫酸 钠(sodium dodecyl sulfate,简称 SDS)这个离子型表面活性剂,溶解细胞 膜和核膜蛋白,使细胞膜和核膜破裂,进入细胞核内的表面活性剂解聚核 中的核蛋白(并与蛋白质形成混合物);再加入苯酚和氯仿等表面活性剂, 使蛋白变性;经离心除去果树的组织和变性蛋白;上清液中加入无水乙醇 使 DNA 沉淀;沉淀 DNA 溶于 TE 溶液中,即得园艺植物总 DNA 溶液。 2.2 分光光度(紫外吸收)法检测 DNA 质量:DNA 的吸收峰在 260nm, 对于双链 DNA,OD260=1.0 时溶液浓度为 50μg/ml,这样通过用紫外分光 光度计测定所提 DNA 溶液在 260nm 的吸光值,可以计算出所提 DNA 的浓 度,计算公式为:DNA 样品浓度(μg/μl)= OD260×N(样品稀释倍数) ×50/1000。而蛋白质的吸收峰在 280nm,核苷酸等小分子量物质的吸收峰 在 230nm,这样通过测定 OD280和 OD230的吸光值,计算出 OD260/ OD280及 OD260/ OD230的比值后,可以判断所提DNA的纯度:纯的DNA 溶液其OD260/ OD280及应为 1.8,OD260/ OD230应大于 2.0。OD260/ OD280大于 1.9 时,表明 有 RNA 污染;小于 1.6 时表明有蛋白质或酚污染。OD260/ OD230小于 2.0 时

表明溶液中有残存的盐和小分子杂质,如核苷酸、氨基酸、酚等。 2.3琼脂糖凝胶电泳检测DNM质量:琼脂糖是一种天然聚合长链状分子, 沸水中溶解,45℃开始形成多孔性刚性滤孔,凝胶孔径的大小决定于琼脂 糖浓度。DNA分子在碱性环境中带负电荷,在外加电场作用下向正极泳动。 DNA分子在琼脂糖凝胶中泳动时,有电荷效应和分子筛效应。不同DNA, 其分子量大小及构型不同,电泳时的泳动率就不同,从而分出不同的区带。 琼脂糖凝胶电泳法分离DNA,主要是利用分子筛效应,迁移速度与分子量 的对数值成反比关系。溴化乙锭(EB)为扁平状分子,在紫外光照射下发 射荧光。EB可与DNA分子形成EB-DNA复合物,其发射的荧光强度较游 离状态EB发射的荧光强度大I0倍以上,且荧光强度与DNA含量成正比。 用肉眼观察,可检测到5ng以上的DNA。 3实验材料 每个学生做1个老师已经准备的幼嫩、健康的园艺植物叶片。 4仪器设备 高速冷冻离心机(Ependorf Centrifuge5810R)、高速台式离心机 (Ependorf Centrifuge5415D)、入电泳装置(包括BIO-RAD Sub-Cell192电 泳槽和PAC300电泳仪)、凝胶成像系统(BIO-RAD)、Biophotometer核酸 蛋白测定仪、MicroBio Mixer Genius、液氮罐、振荡器、电子天平、恒温水 浴锅、烘箱、微波炉等
3 表明溶液中有残存的盐和小分子杂质,如核苷酸、氨基酸、酚等。 2.3 琼脂糖凝胶电泳检测 DNA 质量:琼脂糖是一种天然聚合长链状分子, 沸水中溶解,45℃开始形成多孔性刚性滤孔,凝胶孔径的大小决定于琼脂 糖浓度。DNA 分子在碱性环境中带负电荷,在外加电场作用下向正极泳动。 DNA 分子在琼脂糖凝胶中泳动时,有电荷效应和分子筛效应。不同 DNA, 其分子量大小及构型不同,电泳时的泳动率就不同,从而分出不同的区带。 琼脂糖凝胶电泳法分离 DNA,主要是利用分子筛效应,迁移速度与分子量 的对数值成反比关系。溴化乙锭(EB)为扁平状分子,在紫外光照射下发 射荧光。EB 可与 DNA 分子形成 EB-DNA 复合物,其发射的荧光强度较游 离状态 EB 发射的荧光强度大 10 倍以上,且荧光强度与 DNA 含量成正比。 用肉眼观察,可检测到 5ng 以上的 DNA。 3 实验材料 每个学生做 1 个老师已经准备的幼嫩、健康的园艺植物叶片。 4 仪器设备 高速冷冻离心机(Ependorf Centrifuge 5810R)、高速台式离心机 (Ependorf Centrifuge 5415D)、电泳装置(包括 BIO-RAD Sub-Cell 192 电 泳槽和 PAC300 电泳仪)、凝胶成像系统(BIO-RAD)、Biophotometer 核酸 蛋白测定仪、MicroBio Mixer Genius、液氮罐、振荡器、电子天平、恒温水 浴锅、烘箱、微波炉等

5实验用具 50ml离心管(3只/个材料)、1.5ml离心管(3只/个材料)、研钵(每 人1套)、小剪刀、棉纱手套、不锈钢药匙、10ml移液管、50ml离心管架、 1.5ml离心管盒、吸耳球、1ml移液枪、1ml吸头、1ml吸头盒、100μ1移 液枪、200μ1吸头、200μ1吸头盒、10μ1移液枪、10μ1吸头、10μ1吸 头盒、冰盒、各种规格的试剂瓶若干个。 6试剂 液氮、改良SDS提取液【1.5%SDS(WV),100 mMTris-HCI(pH8.O), 20 nMEDTA(pH8.0),500 nMNaCl,3.0%PVP(WW),0.2%B-巯基乙醇 (VV)小、氯仿-异戊醇(24:1)无水乙醇、70%乙醇、TE、RNA酶(10mg/ml)、 琼脂糖、TAE、5 MNaCl、DNA分子量标记、EB溶液(O.5μgml) 7实验步骤 (1)、在电子天平上称取1.0克用小剪刀剪去主脉的幼嫩叶片,于液态N2 中研磨成粉末。 (2)、用不锈钢药匙把粉末立即转入50ml离心管中,加入15ml经65℃预 热的改良SDS提取液,于65℃水浴锅中裂解60min,其间轻摇数次。 (3)、加入l5ml氯仿-异戊醇,用MicroBio Mixer Genius或双手上下颠倒 震荡10min(第一次去蛋白)。 (4)、4000rpm,离心10min。 (5)、用1ml移液枪转上清液于新的50ml离心管中
4 5 实验用具 50ml 离心管(3 只/个材料)、1.5ml 离心管(3 只/个材料)、研钵(每 人 1 套)、小剪刀、棉纱手套、不锈钢药匙、10ml 移液管、50ml 离心管架、 1.5ml 离心管盒、吸耳球、1ml 移液枪、1ml 吸头、1ml 吸头盒、100μl 移 液枪、200μl 吸头、200μl 吸头盒、10μl 移液枪、10μl 吸头、10μl 吸 头盒、冰盒、各种规格的试剂瓶若干个。 6 试剂 液氮、改良 SDS 提取液【1.5%SDS(W/V),100mMTris-HCl(pH8.0), 20mMEDTA(pH8.0),500mMNaCl,3.0%PVP(W/V),0.2%β-巯基乙醇 (V/V)】、氯仿-异戊醇(24:1)、无水乙醇、70%乙醇、TE、RNA 酶(10mg/ml)、 琼脂糖、TAE、5M NaCl、DNA 分子量标记、EB 溶液(0.5μg/ml) 7 实验步骤 (1)、在电子天平上称取 1.0 克用小剪刀剪去主脉的幼嫩叶片,于液态 N2 中研磨成粉末。 (2)、用不锈钢药匙把粉末立即转入 50ml 离心管中,加入 15ml 经 65℃预 热的改良 SDS 提取液,于 65℃水浴锅中裂解 60min,其间轻摇数次。 (3)、加入 15ml 氯仿-异戊醇,用 MicroBio Mixer Genius 或双手上下颠倒 震荡 10min(第一次去蛋白)。 (4)、4000rpm,离心 10min。 (5)、用 1ml 移液枪转上清液于新的 50ml 离心管中

(6)、用10ml移液管加15ml氯仿-异戊醇,用MicroBio Mixer Genius或双 手上下颠倒震荡l0min(第二次去蛋白)。 (7)、4000rpm离心10mim,用1ml移液枪转上清液于新的50ml离心管中, 加等体积的冷乙醇沉淀DNA。 (8)、用枪头或灭菌的牙签挑出DNA絮团于新的1.5ml离心管中(如无法 挑出,则离心沉淀DNA),用0%乙醇漂洗二次后,吸去液相,于 培养箱或超净台上风干。 (9)、加0.5ml含RNA酶(终浓度为10μg/ml)的TE,于50~58℃水浴 锅中保温消解RNA【上午做到此步,下午2:00接着做下面的步骤】 (10)、12000rpm,离心10min。 (11)、转上清液于1.5ml离心管,按上清液体积加入14体积的5 M NaCI, 混匀,4℃下放置60min(盐析去多糖)。 (12)、12000pm离心10mn,转上清液于新的1.5ml离心管中,加2倍体 积的冷乙醇沉淀DNA,离心,用70%乙醇漂洗后,吸去液相,培养 箱或超净台上风干。 (13)、加0.5mlTE(根据所得的DNA的量来决定,如果量少则0.1~02ml) 溶解DNA,12000pm离心除去不溶物。 (14入Biophotometer核酸蛋白测定仪分析:取15μ1DNA样品稀释 20倍,在Biophotometer核酸蛋白测定仪上测定A260、A280和A230值, 记录所测结果,判定所提DNA的浓度和纯度。 (15)、琼脂糖凝胶电泳分析:用0.8%的凝胶【老师已经做好】,点4μ1 所提的样品,电泳检测精制DNA质量,估算出浓度
5 (6)、用 10ml 移液管加 15ml 氯仿-异戊醇,用 MicroBio Mixer Genius 或双 手上下颠倒震荡 10min(第二次去蛋白)。 (7)、4000rpm 离心 10min,用 1ml 移液枪转上清液于新的 50ml 离心管中, 加等体积的冷乙醇沉淀 DNA。 (8)、用枪头或灭菌的牙签挑出 DNA 絮团于新的 1.5ml 离心管中(如无法 挑出,则离心沉淀 DNA),用 70%乙醇漂洗二次后,吸去液相,于 培养箱或超净台上风干。 (9)、加 0.5ml 含 RNA 酶(终浓度为 10μg/ml)的 TE,于 50~58℃水浴 锅中保温消解 RNA【上午做到此步,下午 2:00 接着做下面的步骤】。 (10)、12000rpm,离心 10min。 (11)、转上清液于 1.5ml 离心管,按上清液体积加入 1/4 体积的 5M NaCl, 混匀,4℃下放置 60min(盐析去多糖)。 (12)、12000rpm 离心 10min,转上清液于新的 1.5ml 离心管中,加 2 倍体 积的冷乙醇沉淀 DNA,离心,用 70%乙醇漂洗后,吸去液相,培养 箱或超净台上风干。 (13)、加 0.5mlTE(根据所得的 DNA 的量来决定,如果量少则 0.1~0.2ml) 溶解 DNA,12000rpm 离心除去不溶物。 (14)、Biophotometer 核酸蛋白测定仪分析:取 15μl DNA 样品稀释 20 倍,在 Biophotometer 核酸蛋白测定仪上测定 A260、A280 和 A230 值, 记录所测结果,判定所提 DNA 的浓度和纯度。 (15)、琼脂糖凝胶电泳分析:用 0.8%的凝胶【老师已经做好】,点 4μl 所提的样品,电泳检测精制 DNA 质量,估算出浓度

(16)、把所提DNA溶液,稀释至5ngμ1的浓度,4℃下保存备用。 8具体做法 全组分成5个小组,8人一组,每人选择一种园艺植物按照实验步骤提 取基因组DNA。 9实验报告 每人写一份,按学术论文格式参考老师提供的范文撰写,包括:题目、 作者、正文(前言、材料和方法、结果与分析、讨论、参考文献)等,其 中结果中要附上自己所提样品的电泳图
6 (16)、把所提 DNA 溶液,稀释至 5ng/μl 的浓度, 4℃下保存备用。 8 具体做法 全组分成 5 个小组,8 人一组,每人选择一种园艺植物按照实验步骤提 取基因组 DNA。 9 实验报告 每人写一份,按学术论文格式参考老师提供的范文撰写,包括:题目、 作者、正文(前言、材料和方法、结果与分析、讨论、参考文献)等,其 中结果中要附上自己所提样品的电泳图

实验2RAPD分析的原理及操作技术 1目的 分子标记是一类建立在分子水平上的遗传标记,它同样具有遗传标记的两个特点, 即可遗传性和可识别性。广义的分子标记包括同工酶和DNA分子标记两类,狭义的分 子标记则仅指后者。DNA分子标记通常是一些小分子量的DNA片段(几十到2O0Obp), 大量存在于真核生物的基因组内,能够通过特定的技术和方法进行检测。一般而言,分 子标记并不是基因,也不是基因的一个部分,但它往往与目的基因(目的性状)有连锁 关系。利用这种连锁关系(越紧密越好),可以对目的基因进行识别和分离,对目的性 状进行早期预选,对优良基因进行聚合育种,从而大大促进园艺植物的育种工作。DNA 分子标记的种类很多,常用的有RAPD(随机扩增多态性DNA)、RFLP(限制性片段长 度多态性)、AFLP(扩增片段长度多态性)、SSR(简单序列重复)等,本实验主要介绍 RAPD分析的实验方法,以了解园艺植物分子标记的基本原理,认识和掌握RAPD分析 在园艺育种中的应用及实验操作技术。 2原理 虽然DNA的基本单元是一个个的单核苷酸,但在只有模板和单核苷酸(NTP)的 反应体系中,DNA聚合酶(Tg酶)并不能启动扩增反应,这是因为该酶催化的反应是 一种延伸反应(在已有的DNA链的3'-OH端掺入单核苷酸,形成磷酸二酯键,合成方 向为5'一3),因此,还需要在反应体系中提供特定的DNA短链(称为引物),用以启 动DNA的聚合反应。 常规的PCR扩增过程为:①将反应体系(模板DNA、引物1、引物2、Mg2+、4 种dNTP和Tag DNA聚合酶,引物1和2都是特异合成的长度为15一30核苷酸的单链 DNA)置于高温(94℃)下变性,使模板双链DNA解链为两条单链;②在低温(40 一60℃)下退火,使引物与模板链3端互补区结合形成部分双链DNA:③在中温(72℃》 下延伸,Tag DNA聚合酶根据模板的核苷酸顺序,将单核苷酸从引物的3'端顺次掺入, 催化磷酸二酯键生成,实现新链的延伸。如此变性、退火、延伸,三步构成的一个循环, 可使两种引物限定范围内的DNA序列扩增一倍。由于每次循环的产物都能成为下一循 环的模板,因而PC产物量以指数方式增加,从理论上计算,经过20个循环,目的 7
7 实验 2 RAPD 分析的原理及操作技术 1 目的 分子标记是一类建立在分子水平上的遗传标记,它同样具有遗传标记的两个特点, 即可遗传性和可识别性。广义的分子标记包括同工酶和 DNA 分子标记两类,狭义的分 子标记则仅指后者。DNA 分子标记通常是一些小分子量的 DNA 片段(几十到 2000bp), 大量存在于真核生物的基因组内,能够通过特定的技术和方法进行检测。一般而言,分 子标记并不是基因,也不是基因的一个部分,但它往往与目的基因(目的性状)有连锁 关系。利用这种连锁关系(越紧密越好),可以对目的基因进行识别和分离,对目的性 状进行早期预选,对优良基因进行聚合育种,从而大大促进园艺植物的育种工作。DNA 分子标记的种类很多,常用的有 RAPD(随机扩增多态性 DNA)、RFLP(限制性片段长 度多态性)、AFLP(扩增片段长度多态性)、SSR(简单序列重复)等,本实验主要介绍 RAPD 分析的实验方法,以了解园艺植物分子标记的基本原理,认识和掌握 RAPD 分析 在园艺育种中的应用及实验操作技术。 2 原理 虽然 DNA 的基本单元是一个个的单核苷酸,但在只有模板和单核苷酸(dNTP)的 反应体系中,DNA 聚合酶(Taq 酶)并不能启动扩增反应,这是因为该酶催化的反应是 一种延伸反应(在已有的 DNA 链的 3’-OH 端掺入单核苷酸,形成磷酸二酯键,合成方 向为 5’→3’),因此,还需要在反应体系中提供特定的 DNA 短链(称为引物),用以启 动 DNA 的聚合反应。 常规的 PCR 扩增过程为:① 将反应体系(模板 DNA、引物 1、引物 2、Mg2+、4 种 dNTP 和 Taq DNA 聚合酶,引物 1 和 2 都是特异合成的长度为 15-30 核苷酸的单链 DNA)置于高温(94℃)下变性,使模板双链 DNA 解链为两条单链;② 在低温(40 -60℃)下退火,使引物与模板链 3’端互补区结合形成部分双链 DNA;③ 在中温(72℃) 下延伸,Taq DNA 聚合酶根据模板的核苷酸顺序,将单核苷酸从引物的 3’端顺次掺入, 催化磷酸二酯键生成,实现新链的延伸。如此变性、退火、延伸,三步构成的一个循环, 可使两种引物限定范围内的 DNA 序列扩增一倍。由于每次循环的产物都能成为下一循 环的模板,因而 PCR 产物量以指数方式增加,从理论上计算,经过 20 个循环,目的

DNA可被扩增10。 RAPD(Randomly Amplified Polymorphic DNA)是一种建立在PCR技术基础上、可 对整个基因组进行选择性扩增的分子标记技术。它是以一个随机合成的10寡核苷酸为 引物,在未知序列的基因组DNA上,对部分DNA序列进行随机扩增,产生长度不同 的DNA产物,通过电泳分离和EB(溴化乙锭,剧毒药品)染色,显示出扩增的DNA 条带。一般来讲,只有当模板DNA链上不太长(≤200Obp)的区域内,存在2个与随 机引物反向互补(基本或完全互补)的序列,这一段DNA片段才能被扩增,其数量也 是以指数方式递增。RAPD与常规PCR的不同之处是:①所用的引物比较短,为随机 合成的10寡核苷酸单链:②扩增反应中只用一个引物,但实际起到两个引物的作用: ③扩增循环中所用的退火温度较低(35一40℃),以利于多态性的检出。 由于DNA聚合酶(Tag酶)的聚合能力和琼脂糖凝胶的分辨能力的限制,RAPD片 段的最佳长度一般为400~2000bp。 3实验材料 通过实验一制备得到的质量合格、浓度准确的植物基因组DNA溶液 4主要仪器设备(下划线示必须设备)和实验用具 PCR扩增仪Pekin Elmer公司),高速冷冻离心机(Beckman公司),低温高速离心机 (Eppendorf公司),DU-640紫外分光光度计(Beckman公司),电泳系统BIO-RAD 公司,凝胶成象系统BIO-RAD公司)。移液枪,灭菌的PCR管、离心管、吸头等。 5主要试剂 灭菌的ddHO:I0×buffer缓冲液(不含MgCb):25 nM M.Clz溶液:dNTP(每种 2.5mM): 随机引物经准确定量后,取少量用ddH20稀释成5M溶液,-20℃下保存备用: 模板DNA经准确定量后,取少量用ddHO稀释成5gL溶液,4℃下保存备用: Tag酶液(3U/μL):TBE电泳缓冲液:载样缓冲液(6×或10×): 琼脂糖(BIOWEST):EB染液
8 DNA 可被扩增 106。 RAPD(Randomly Amplified Polymorphic DNA)是一种建立在 PCR 技术基础上、可 对整个基因组进行选择性扩增的分子标记技术。它是以一个随机合成的 10 寡核苷酸为 引物,在未知序列的基因组 DNA 上,对部分 DNA 序列进行随机扩增,产生长度不同 的 DNA 产物,通过电泳分离和 EB(溴化乙锭,剧毒药品)染色,显示出扩增的 DNA 条带。一般来讲,只有当模板 DNA 链上不太长(≤2000bp)的区域内,存在 2 个与随 机引物反向互补(基本或完全互补)的序列,这一段 DNA 片段才能被扩增,其数量也 是以指数方式递增。RAPD 与常规 PCR 的不同之处是:① 所用的引物比较短,为随机 合成的 10 寡核苷酸单链;② 扩增反应中只用一个引物,但实际起到两个引物的作用; ③ 扩增循环中所用的退火温度较低(35-40℃),以利于多态性的检出。 由于 DNA 聚合酶(Taq 酶)的聚合能力和琼脂糖凝胶的分辨能力的限制,RAPD 片 段的最佳长度一般为 400~2000bp。 3 实验材料 通过实验一制备得到的质量合格、浓度准确的植物基因组 DNA 溶液。 4 主要仪器设备(下划线示必须设备)和实验用具 PCR 扩增仪(Pekin Elmer 公司),高速冷冻离心机(Beckman 公司),低温高速离心机 (Eppendorf 公司),DU-640 紫外分光光度计(Beckman 公司),电泳系统(BIO-RAD 公司),凝胶成象系统(BIO-RAD 公司)。移液枪,灭菌的 PCR 管、离心管、吸头等。 5 主要试剂 灭菌的 ddH2O;10×buffer 缓冲液(不含 MgCl2);25mM MgCl2 溶液;dNTP(每种 2.5mM); 随机引物经准确定量后,取少量用 ddH2O 稀释成 5µM 溶液,-20℃下保存备用; 模板 DNA 经准确定量后,取少量用 ddH2O 稀释成 5ng/µL 溶液,4℃下保存备用; Taq 酶液(3U/μL);TBE 电泳缓冲液;载样缓冲液(6×或 10×); 琼脂糖(BIOWEST);EB 染液
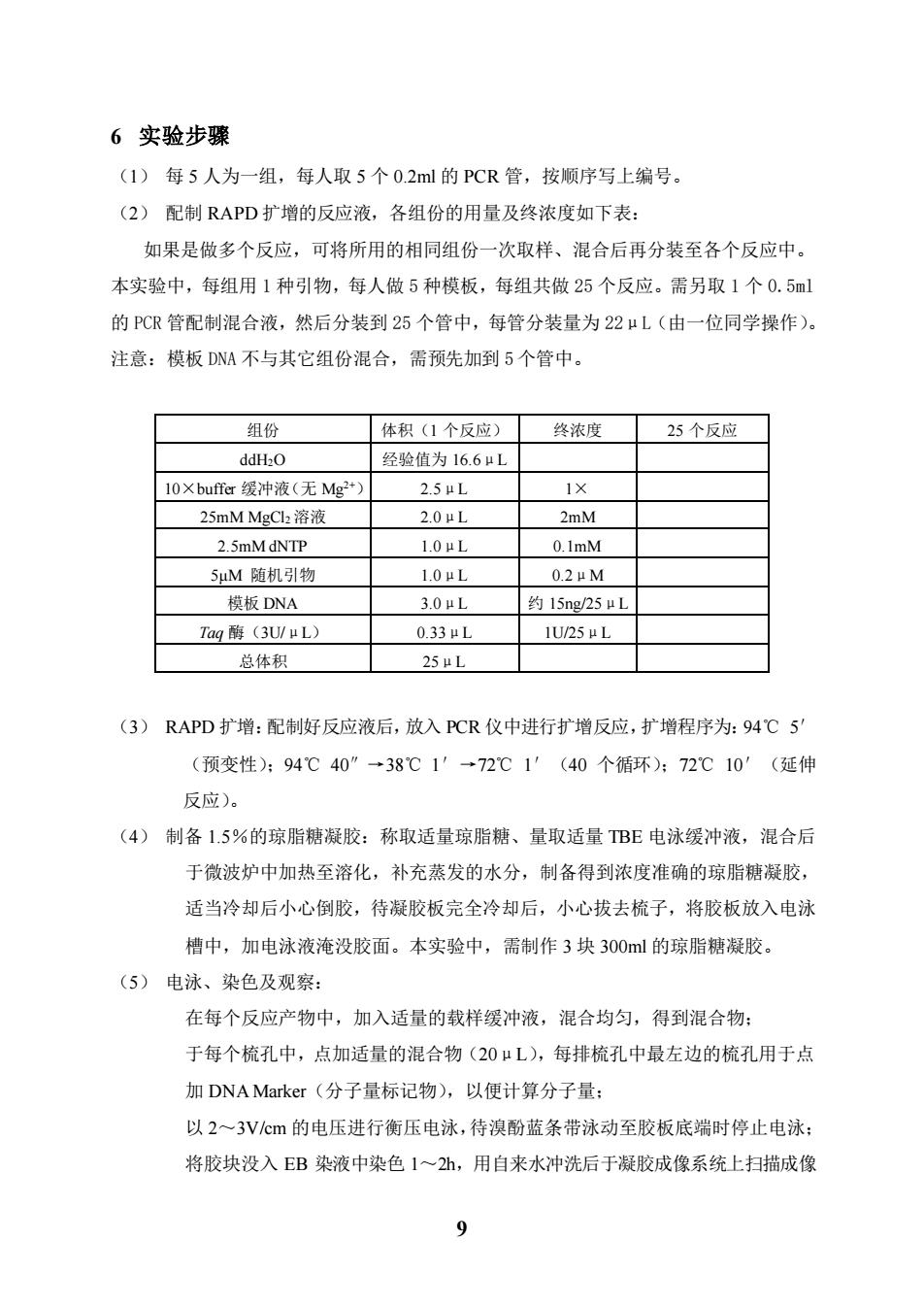
6实验步骤 (1)每5人为一组,每人取5个02ml的PCR管,按顺序写上编号。 (2)配制RAPD扩增的反应液,各组份的用量及终浓度如下表: 如果是做多个反应,可将所用的相同组份一次取样、混合后再分装至各个反应中。 本实验中,每组用1种引物,每人做5种模板,每组共做25个反应。需另取1个0.5l 的PCR管配制混合液,然后分装到25个管中,每管分装量为22μL(由一位同学操作)。 注意:模板DNA不与其它组份混合,需预先加到5个管中。 组份 体积(1个反应) 终浓度 25个反应 ddH2O 经验值为16.6μL 10×buffer缓冲液(无Mg2*) 25uL 1× 25 nM MgCl2溶液 2.0μL 2mM 2 5mMdNTP 1.0uL 0.1mM 5M随机引物 1.0μL 0.2μM 模板DNA 3.0uL 约15ng/25μL Tag酶(3U/μL) 0.33μL IU25μL 总体积 25μL (3)RAPD扩增:配制好反应液后,放入PCR仪中进行扩增反应,扩增程序为:94℃5 (预变性):94℃40”→38℃1'→72℃1'(40个循环):72℃10'(延伸 反应)。 (4)制备1.5%的琼脂糖凝胶:称取适量琼脂糖、量取适量TBE电泳缓冲液,混合后 于微波炉中加热至溶化,补充蒸发的水分,制备得到浓度准确的琼脂糖凝胶, 适当冷却后小心倒胶,待凝胶板完全冷却后,小心拔去梳子,将胶板放入电泳 槽中,加电泳液淹没胶面。本实验中,需制作3块300ml的琼脂糖凝胶。 (5)电泳、染色及观察: 在每个反应产物中,加入适量的载样缓冲液,混合均匀,得到混合物: 于每个梳孔中,点加适量的混合物(20μL),每排梳孔中最左边的梳孔用于点 加DNA Marker(分子量标记物),以便计算分子量: 以2~3Vcm的电压进行衡压电泳,待溴酚蓝条带泳动至胶板底端时停止电泳: 将胶块没入EB染液中染色1~2h,用自来水冲洗后于凝胶成像系统上扫描成像 9
9 6 实验步骤 (1) 每 5 人为一组,每人取 5 个 0.2ml 的 PCR 管,按顺序写上编号。 (2) 配制 RAPD 扩增的反应液,各组份的用量及终浓度如下表: 如果是做多个反应,可将所用的相同组份一次取样、混合后再分装至各个反应中。 本实验中,每组用 1 种引物,每人做 5 种模板,每组共做 25 个反应。需另取 1 个 0.5ml 的 PCR 管配制混合液,然后分装到 25 个管中,每管分装量为 22μL(由一位同学操作)。 注意:模板 DNA 不与其它组份混合,需预先加到 5 个管中。 组份 体积(1 个反应) 终浓度 25 个反应 ddH2O 经验值为 16.6μL 10×buffer 缓冲液(无 Mg2+) 2.5μL 1× 25mM MgCl2 溶液 2.0μL 2mM 2.5mM dNTP 1.0μL 0.1mM 5μM 随机引物 1.0μL 0.2μM 模板 DNA 3.0μL 约 15ng/25μL Taq 酶(3U/μL) 0.33μL 1U/25μL 总体积 25μL (3) RAPD 扩增:配制好反应液后,放入 PCR 仪中进行扩增反应,扩增程序为:94℃ 5′ (预变性);94℃ 40″→38℃ 1′→72℃ 1′(40 个循环);72℃ 10′(延伸 反应)。 (4) 制备 1.5%的琼脂糖凝胶:称取适量琼脂糖、量取适量 TBE 电泳缓冲液,混合后 于微波炉中加热至溶化,补充蒸发的水分,制备得到浓度准确的琼脂糖凝胶, 适当冷却后小心倒胶,待凝胶板完全冷却后,小心拔去梳子,将胶板放入电泳 槽中,加电泳液淹没胶面。本实验中,需制作 3 块 300ml 的琼脂糖凝胶。 (5) 电泳、染色及观察: 在每个反应产物中,加入适量的载样缓冲液,混合均匀,得到混合物; 于每个梳孔中,点加适量的混合物(20μL),每排梳孔中最左边的梳孔用于点 加 DNA Marker(分子量标记物),以便计算分子量; 以 2~3V/cm 的电压进行衡压电泳,待溴酚蓝条带泳动至胶板底端时停止电泳; 将胶块没入 EB 染液中染色 1~2h,用自来水冲洗后于凝胶成像系统上扫描成像