
第十三章氨基酸,蛋白质和核酸 除了脂类和糖类化合物以外,重要的生物大分子还有蛋白质和核酸,这两类化合物是构 成生命的基本物质,其中核酸是遗传信息的携带者,为生命的外在形式提供了建设蓝图,而 蛋白质侧承担着各种各样复杂的生理功能,从整体上维持着生物机体新陈代谢活动的进行。 因此,生命是蛋白质的存在形式,而生命的基本特征就是蛋白质的不断自我更新。 多糖盼水解 低聚糖完全水解 苷键把多个单糖基本单元以同种或不 单糖同的方式连接起来,构成多糖分子链。 肆(珠安建)巴多个写其哈其太 蛋白质部分水解 多肽 完全水解 氨基酸 单元方式按 序连接起来,构成蛋白 质分子链。氨基酸是构成蛋白质的基石。 S13-1氨基酸(Aminoacid) 一、分类,命名和构型 1.分类 「脂肪族 ()按R结构 芳香族 (2按CO0H和-NH, 的相位置 杂环 迄今发现的天然氨基酸有700多种,但组成蛋白质的氨基酸有20余种,而受遗传密码 支配的氨基酸只有20种,且其中19种都属于-氨基酸。 中性 pH≠7 (3)按分子中所含 -0 的个数 减性 pH-7 酸性 pH<7 ,R为脂肪烃基 R中含有羟基和硫 非极性 (4)按RCHNH2COOH中 R中含有芳基 (⑤)按氨基酸在生理 带正电 侧链R一的性质 R中含有碱性基团 带负电 R中含有酸性基团 条件下的解离 不带点 R中含有酰胺基 ·R为环状 (6按来自遗传信息调控?

2.命名 氨基酸多用俗名,即根据来源和性质命名,在表达多肽和蛋白质结构时,常用英文名 称的前三个字母表示,也可用中文名称的第一个或前两个字表示。详见教材。 3.c-氨基酸的构型 受遗传密码支配的20种RC*HNH,COOH中,除甘复酸外,其余19种均为手性分子,且 都是L型。苏氨酸和异亮复酸另有一个不对称碳原子。细菌体内有少数D-型复基酸。 CHO COOH COOH HO- 一H HO —H H2N- CHOH CH3 R L(-)-甘油醛 L(+乳酸 L氨基酸 单糖分子中决定构型OH所连的C*距离羰基最远,而-氨基酸分子中决定构型的 -NH所连的C*(Q~C)距离羧基最近。 二、-氨基酸的物理性质 mp.较高,一般在200-300℃,加热到mp.时常易分解。一般能溶于水,不溶于石油醚等 非极性溶剂。 三、c-氨基酸的化学性质 一COOH→羧酸的性质 -COOH 相互影响 特性 一NH→1°胺的性质 L1.两性和等电点((Isocricpoint) R-CH-COO÷H=R—CH-COO :NH2 NH3+ 内盐(偶极离子或两性离子) 固体氨基酸→是格中的结点之间靠静电引力形戒是体·品格能↑·mp.↑ 接受质子:碰性 RCHCOOH HCI- -RCHCOOH NH2 :NH3+CI- 给出质子:酸性 RCHCOOH NaOH- ·RCHCOONa+H2O :NH2 :NH2

各种-氨基酸在水溶液中的存在形式,取决于氨基酸的结构和水溶液的H值 RCHCOO Ht OH- -RCHCO0一O=-RCHCOOH :NH2 NH3 :NH3+ 负离子 偶极离子 正离子 (在强礪溶液中的 (在强酸溶液中的 主要存在形式) 主要存在形式) pH>pl pH=pl pHNH门+H广-→抑制COOH电离pH=pl (pl值:2.8-3.2) 一NH接受质子 减性氨基酸水溶液-pHK7-[CO0]<NH门+OH促进COOH电离pH=pl (pl值:7.6-10.8) -NH*失去质子 中性氨基酸水溶液pH路7-[C00]路NH门+少量H,抑制-COOH电离pH=p (pl值:一般在56.3) 一NH2接受质子 应用不同的氨基酸,p值各不相同。在等电点时,氨基酸呈电中性,在电场中不迁移, 且偶极离子的浓度最高,而复基酸的溶解度最小,易生成沉淀。可用调节H值的方法,分离 氨基酸混合物。常用的方法:分级沉淀,电泳和色谱法。 这种两性解离性质为20种α-氨基酸所共有,共同赋子蛋白质的两性解离特性。氨基酸的 两性解离性质是氨基酸和蛋白质最主要的化学特性。理解和运用这一性质,是分离、纯化氨 基酸和蛋白质,进而理解核酸性质,理解生物大分子的构象和之间的相互作用以及酶作用的 机理等分子生物学基本理论的基础。 2.脱羧反应(α-取代酸的共性) RCHCOOH 或脱酶RCH2NH2+CO2 NH2 2
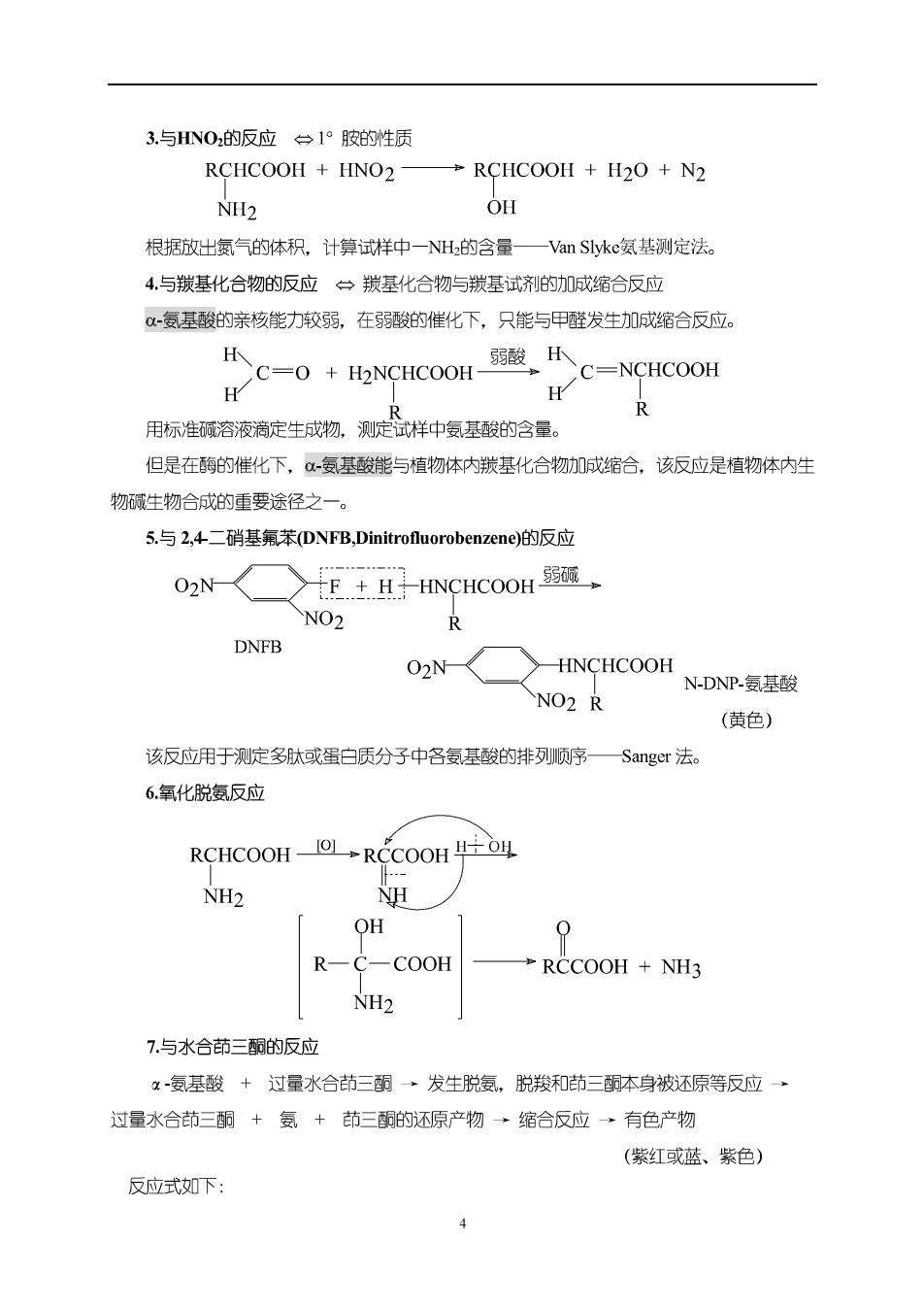
3.与HNO的反应一1°胺的性质 RCHCOOH HNO2 →RCHCOOH+H2O+N2 NH2 OH 根据放出氨气的体积,计算试样中一NH的含量—Van Slyke氨基测定法。 4.与羰基化合物的反应一羰基化合物与羰基试剂的加成缩合反应 -氨基酸的亲核能力较弱,在弱酸的催化下,只能与甲醛发生加成缩合反应。 H H >C=0+H2 CHCOOH-弱酸K C=NCHCOOH 用标准诚溶液滴定生成物,测定试样中复基酸的含量。 但是在酶的催化下,α-氨基酸能与植物体内羰基化合物加成缩合,该反应是植物体内生 物碱生物合成的重要途径之一。 5.与2,4二硝墓氣苯(DNFB,Dinitrofluorobenzene)的反应 02N-HNCHCOOH NO2 R N-DNP-氨基酸 (黄色) 该反应用于测定多肽或蛋白质分子中各复基酸的排列顶序一—Sanger法。 6.氧化脱氨反应 RCHCOOH-0L+RCCOOH NH2 H OH 0 R一C-COOH RCCOOH NH3 NH2 7.与水合茚三酮的反应 x-氨基酸+过量水合茚三霸发生脱复,脱羧和茚三酮本身被还原等反应→ 过量水合茚三酮+氨+茚三的还原产物→缩合反应→有色产物 (紫红或蓝、紫色) 反应式如下:
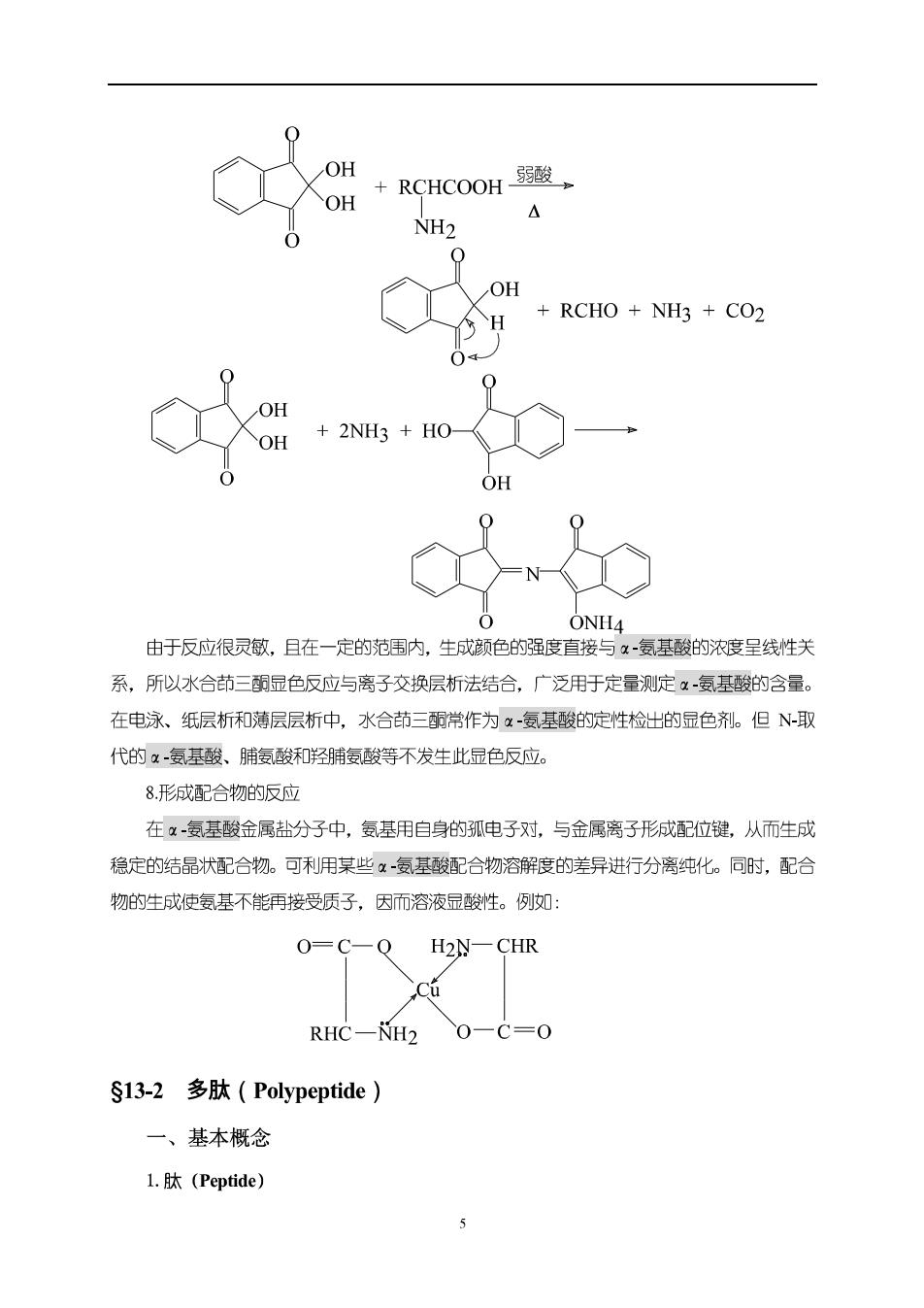
0 OH OH +RCHCOOH弱酸 NH2 OH H RCHO NH3 CO2 O 2NH3 HO- OH 0 ONH4 由于反应很灵敏,且在一定的范用内,生成颜色的强度直接与x-氨基酸的浓度呈线性关 系,所以水合茚三酮显色反应与离子交换层析法结合,广泛用于定量测定x氨基酸的含量。 在电泳、纸层析和薄层层析中,水合茚三酮常作为x-氨基酸的定性检出的显色剂。但N-取 代的x-氨基酸、脯氨酸和羟脯氨酸等不发生此显色反应。 8.形成配合物的反应 在x-复基酸金属盐分子中,氨基用自身的孤电子对,与金属离子形成配位键,从而生成 稳定的结晶状配合物。可利用某些α氨基酸配合物溶解度的嗟异进行分离纯化。同时,配合 物的生成使复基不能再接受质子,因而溶液显酸性。例如: O=C-Q H2N-CHR RHC-H2O一C=O S13-2多肽(Polypeptide)】 一、基本概念 l.肽(Peptide)

2-氨基酸分子间的晦基与羧基脱水,通过酰胺键相连而成的化合物称为肽。 2.肽键 肽分子中的的酰胺键称为肽键。 OH H-HN- OH (也可以偶极离子形式存 肽键 3.多肽 多肽是由多个?氨基酸按一定的排可列顺序通过肽键结合而成的化合物 4,氨基酸残基 组成多肽的复基酸单元称为氨基酸残基 多肽广泛存在于自然界中,但最重要的是作为蛋白质的亚单位存在。蛋白质部分水解可 得到多肽,相对分子质量在1万以下一般称为多脉,大于1万者则加叫作蛋白质。 二、多肽的分类和命名 1.分类 按组成肽链的复基酸单元个数分为:二肽,三肽,四肽…多肽(一般为:250个氨基 酸残基)。例如 N-端 C-端 9 CH3 0 CH3 H2NCH2C-OH H--HNCHCOOH H2NCH2-C HNCHCOOH 甘复酸 丙氨酸 甘复酰丙氨酸 简称:甘-丙(Gy-Ala) 0 0 H2NCHC-OH H--HNCH2COOH-H2NCHC-HNCH2COOH CH3 CH3 6

丙氨酰甘氨酸 两种中性复基酸分子间脱水可生成两种二肽,n种中性氨基酸有!种结合方式。 2.命名 0 0 H2NCHC-HNCH2C- NHCHCOOH 丙氨,酰甘氨酰苯丙复酸 CH3 CH2C6H5 0 CH2SH H2NCHCH2CH2C-NHCHG-NHCH2COOH COOH 0 谷复酰半胱复酰甘复酸(谷胱甘肽) 三、多肽的结构 1.肽键 肽键中的p-π使C一N具有部分双键的性质,其键长介于单键键长C-N(0,148m)和双 键键长(0.127mm)之间,约为0.132mm。组成肽键的原子共平面,目肽键中的C-N键不能自 由旋转,存在顺反两种可能的构型 C C 顺式 C-N 反式 H 多数情况下,反式构型在能量上更有利,但也有例外。 2,多肽结构测定 多肽链中复基酸的排列顺序称为氨基酸顺序(-端→C-端),是多肽和蛋白质最重 要的特性之一。 ()多肽组成的测定 一定质量的多肽试样·酸水解·离子交换柱色谐法分离·水合茚三酮显色· 定性,定量→根据多肽相对分子质量和所含氨基酸的种类,确定各种氨基酸分子的数日一

全自动基酸分析仪的测定原理。 (2)厦基酸序列的测定 ①端基标记法 DNFB法(Sanger法)N-端卤代烃的亲核取代 O2NF+H2NCHCONHCHCO NO2 R HNCHCONHCHCO NO2 R R -HNCHCOOH H2NCHCOOH +.... NO2 R Edman法N-端—异氰酸的劬加成 R 0 C6H5N=C=S HHNCHC-NHCHC OH- 异硫酸酯 0 -NHCH HCL C6HSNH NH H2NCHC- R' 0=C CH-R R 苯基乙内酰硫脲 缩短后的肽链可以继续进行第二个、第三个…N-端标记 一多肽顺序自动分析仪。 次可连续测出60个以上氨基酸顺序。 酶解法C端—逐步水解 用羧肽酶A水解氨基酸。如果氨基酸的侧链为芳香环或比较大的烃基,水解反应更容易 进行。 测定出多肽的结构,就可以在实验室里进行多肽的人工合成。但由于复基酸分子中可发 生反应的部位很多,所以对于不希望发生反应的基团腰加以保护,对希望反应的县团要使其 活化。所加的活化试剂和保护试济剂必须易于和被活化、被保护部位反应,又不与其它基团反 应,反应后易于除去,除去时又不影响其它基团和已形成的太键。由此可见,多肽的人工合 成比起氨基酸的顺序测定更为复杂。 四、多肽的性质

由于多肽分子中含有游离的N-端氨基和C-喘羧基,以及碱性氨基酸、酸性氨基酸残基例 链中的复基和羧基,所以多肽分子相当于一个氨基酸分子,但情况要复杂得多。多肽也有等 电点,等电点时的性质与厦基酸相似。 Sl3-3蛋白质(Protein) 一、蛋白质的结构 蛋白质是由一条或多条多肽链以特殊方式组合成的生物大分子,蛋白质的结构可以分为 6个层次:一级结构,二级结构,超二级结构,三级结构,四级结构以及分子缔合体。一级 结构以外的其它结构又称为空间结构或三维结构。 1.一级结构 蛋白质的一级结构包括组成蛋白质的多肽链数目,每一条多肽链的复基酸顺序,以及多 肽连内或链间二硫键的数目和位置。 目前已知上干种不同蛋白质的一级结构,例如胰岛素。胰岛素的一条肽链相对分子质量 约为6000,应当属于多肽,但在溶液中受金属离子(例如Z)的作用,两条分子链迅速 结合,使相对分子质量达到约12000。因此,胰岛素是目前最小的蛋白质。 任何一种蛋白质,在其自然状态或活性状态下,都具有特征而稳定的空间结构。一旦这 种特征的立体结构遭到破环,即使其一级结构不变,蛋白质的生物功能也会完全丧失。所以, 具有独特的空间结构,是蛋白质区别厅普通有机分子的最显著特点。 2.二级结构 蛋白质的二级结构是指肽链的主链在空间的排列。只涉及分子主链的构象及链内或链间 肽键上形减的氢键。多肽链的构像主要取决于两个条件: 条件1组成肽键的原子处于同一平面,肽链中两个相的肽键通过一个共同的x碳相 车 -N一C C-NiC Cx一N和Cα一C键可以自由旋转,因比肽链钱在保持酰胺键平面结构不变的情况下,形 成不同的空间排列一构象。 条件2主链上酰胺键形成的链内或链间氢键 N-H-0=C 9

这种氧键对于稳定主链构象具有重要意义。因此在各种可能的构象中,能够形成氧键最 多的构象最稳定。 化学家Pauling从20世纪30年代开始应用X射线衍射法研究蛋白质的品体结构,并于 1951年首先提出了蛋白质的立体结构模型:z-螺旋和印-折叠。 (①x螺旋?螺旋结构是蛋白质二级结构中最典型的、也是最稳定的一种二级结构, 主链形成了右于螺旋。在Pauling提出的x-螺旋结构模型中,每隔3.6个氨基酸残基上升一圈, 螺距为0.54nm,与天然ax-角蛋白的衍射图案中所推算的0.54~0.55nm一个周期是一致的。在 ?螺旋体中,氨基酸残基的侧链伸向外侧,相邻的罗圈之间形械链内氢键,取向几乎与中心 轴平行,其氢键是肽键中氨原子上的氢原子与其后的第四个氨基酸残基上的羰基氧原子之间 形成的。除了两端外,所有肽键都在螺旋内形城了氢键,每个呔键的成氢键能力都得到满足, 所以构象稳定。 (2邝-折叠在Pauling提士的邮-折叠结构模型中,肽链处于较伸展的曲折形式,多肽链的 长轴互相平行,相邻酞链借助氢,键皱此连成片层结构,例如角蛋白和丝蛋白。所有的肽键都 参与链间氢键的形成,其氢键与链的长轴几乎垂直,侧链基团在折叠片平直的上和下交替伸 展。 ,平行式:所有肽链的N-端都处于同一端,如邱-角蛋白。 B-折叠片 (反平行:肽链N-端一顺一倒的排列,如丝蛋白。反平行构象较稳定。 从x-螺旋和邱-折叠结构可以看出非共价相互作用在稳定蛋白质结构中所起到的重要作 用,而且无论蛋白质的结构如何复杂与变化,本质上均是受这些作用力所控制的。 2超二级结构 蛋白质的超二级结构是指二级结构单元间的组合方式,主要是指纤维状蛋白(角蛋白、 胶原蛋白等)的整体和球状蛋白(肌红蛋白、血红蛋白等)的局部。例如 x角蛋白属于“三右一左”式,三股右手x螺旋一起向左拧成一根左于螺旋结构。 丝心蛋白是典型的反平行邱-折叠的平行方式的再堆积。 胶原纤维属于“三左一右”式,三股左手x螺旋一起向右拧成一根右手螺旋结构。 3三、四级结构 ()三级结构在二级结构的基础上,蛋白质分子多肽链上的复基酸残基借助氢键(非肽 键)、二硫键、酯键、疏水键、正负离子间的盐键以及分子间其它作用力一次级键,进一 步卷曲、折叠、盘绕形成更复杂的空间结构