
第十一章杂环化合物和生物碱 (Heterocyclic compound and Alkaloid) 杂环化合物:在环状化合物成环的原子中,除了碳原子外,还有其它杂原子(O,N,S 等)。 前几章时论过的环醚,内酯,交酯,内酐等,成环的原子中也有杂原子,但这些化合物 的性质与相应的开链化合物类以,所以一般不将这些化合物归入杂环化合物中讨论。例如: 0 0 四氢呋喃 四咯 戊内酯 本章主要讨论具有芳香性的杂环化合物,这类化合物属于芳香族。 苯系芳烃 芳香烃 芳香族 [非苯系芳烃 (杂环化合物 此外,本章所涉及的植物体内存在的一类天然产物—生物@,也属于杂环化合物, §11-1杂环化合物的分类、命名和结构 一、 杂环化合物的分类和命名 1.分类 (1)单环 五员环,例: 六员环,例: (2)稠环 2.命名 杂环化合物多采用音译命名法,即将其英文名称译成同音汉字,并用“口”字旁作为杂 环的标志
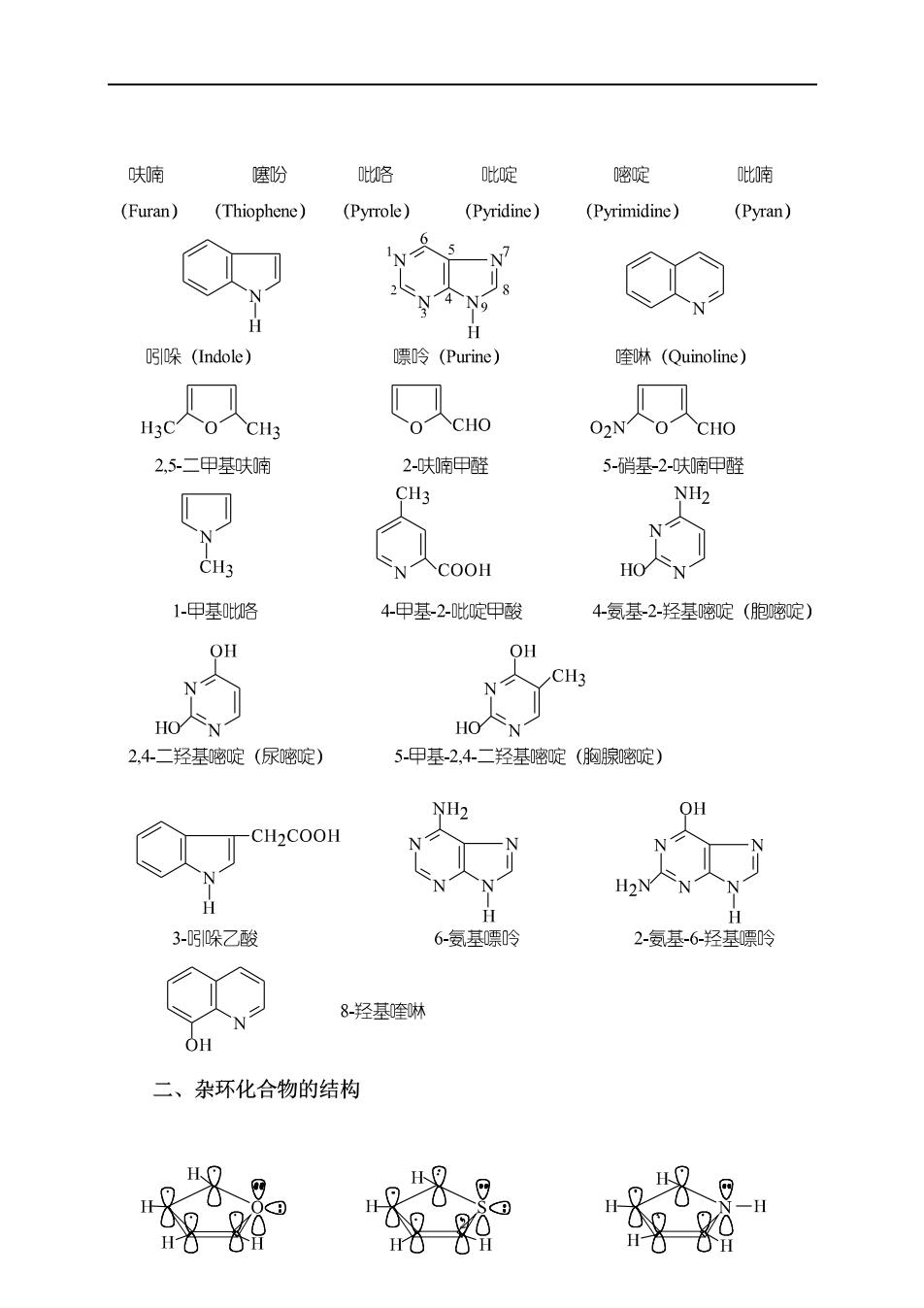
呋喃 噻盼 此咯 此啶 嘧啶 喃 (Furan)(Thiophene)(Pyrrole) (Pyridine) (Pyrimidine) (Pyran) N y个 H 吲l哚(Indole) 嘌呤(Purine) 喹啉(Quinoline) O人CHO 02N人0CH0 2,5.二甲基呋喃 2-呋喃甲醛 5-硝基-2-呋甲醒 CH3 NH2 CH3 1-甲基咯 4甲基-2-此啶甲酸 4-复基-2-羟基密啶(胞嘧啶) OH OH HO八N 2.4.二羟基嘧啶(尿密啶) 5.甲基-2.4二羟基密啶(胸腺密啶) NH2 OH H 3-吲哚乙酸 6-氨基嘌吟 2-氨基6-羟基岭 8-羟基喹淋 OH 二、杂环化合物的结构 H日
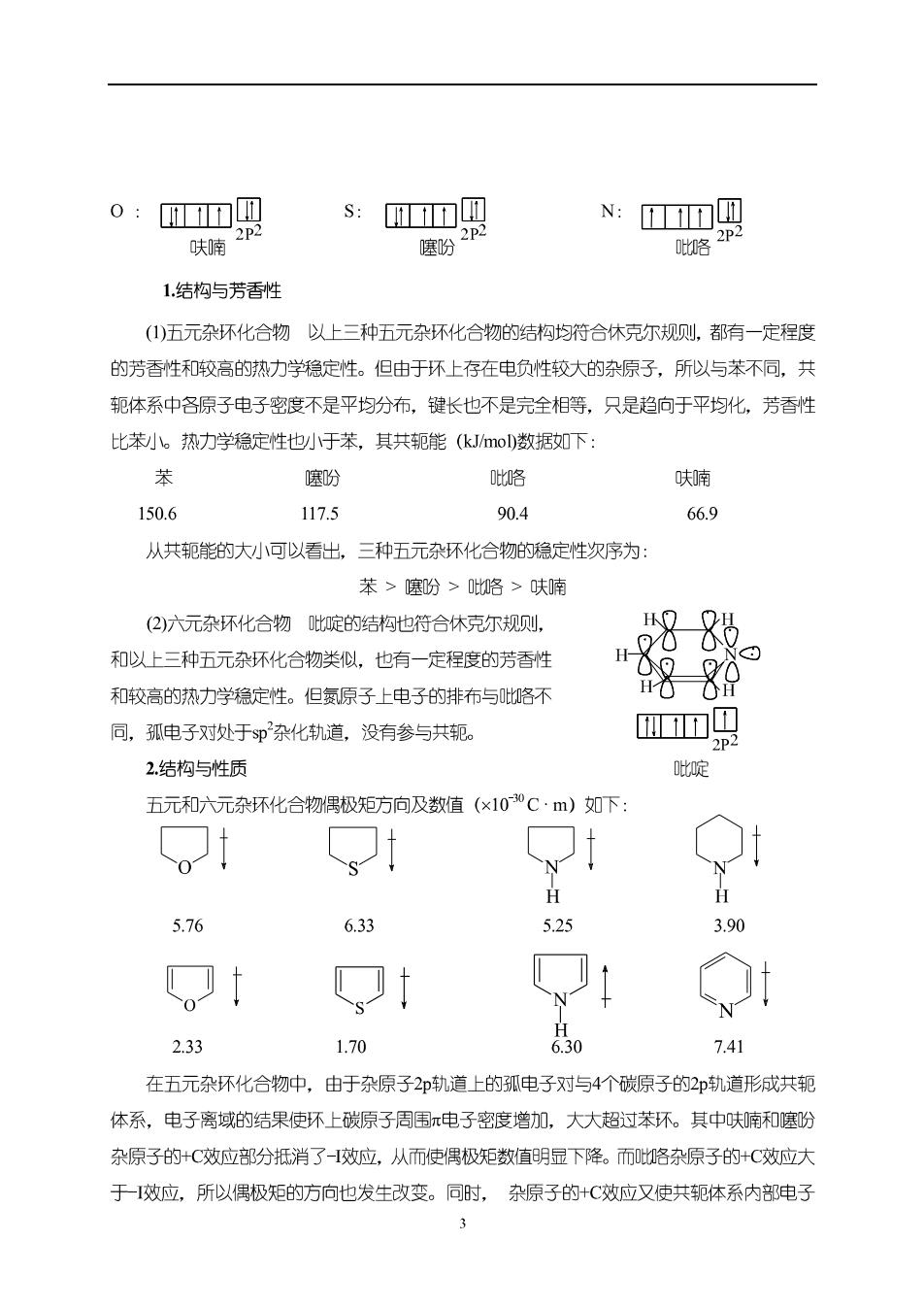
o:卫网 s:D回 N:ID四 味隋2P 魔份2P Q略2p2 1,结构与芳香性 ()五元杂环化合物以上三种五元杂环化合物的结构均符合休克尔规侧,都有一定程度 的芳香性和较高的热力学稳定性。但由于环上存在电负性较大的杂原子,所以与苯不同,共 轭体系中各原子电子密度不是平均分布,键长也不是完全相等,只是趋向于平均化,芳香性 比苯小。热力学稳定性也小于苯,其共轭能(ko数据如下 庭盼 财咯 呋喃 150.6 117.5 90.4 66.9 从共轭能的大小可以看出,三种五元杂环化合物的稳定性次序为 苯>噻盼>咯>呋喃 (2)六元杂坏化合物啶的结构也符合休克尔规侧, 和以上三种五元杂环化合物类似,也有一定程度的芳香性 。 和校高的热力学稳定性。但氮原子上电子的排布与咯不 邻8 同,孤电子对处于p杂化轨道,没有参与共轭。 吸 2结构与性质 吡啶 五元和六元杂环化合物偶极矩方向及数值(×100C·m)如下, 5.76 6.33 5.25 3.90 t 2.33 1.70 6.30 7.41 在五元杂环化合物中,由于杂原子2印轨道上的孤电子对与4个碳原子的2p轨道形成共轭 体系,电子离域的结果使环上碳原子周围π电子密度增加,大大超过苯环。其中呋喃和噻盼 杂原子的+C效应部分抵消了-效应,从而使偶极矩数值明显下降。而咯杂原子的+C效应大 于-效应,所以偶极短的方向也发生改变。同时 杂原子的+C效应又使共轭体系内部电子

密度的分布出现极性交替,两个α位(杂原子的位)的电子密度高于两个位(杂原子的间 位),因而亲电取代反应优先发生在两个位。 在六元杂环化合物中,由于电负性大的复原子的孤电子对没有参与共轭,因而-C和-H 效应的叠加(二者方向一致),使环上碳原子周围电子密度大大减小,低于苯环。共轭体系 内部电子密度极性交替的结果,又使复原子的双测位电子密度下降的更为明显,亲电取代反 应一般发生在间位(位)。 亲电取代反应的活性次序:吡咯>呋喃>噻盼>苯>吡啶 其次,吡咯和呋喃遇强酸时,杂原子能发生质子化,破坏大π键,从而呈现共轭二烯烃 的性质:易聚合,易被氧化。而啶侧比苯更难氧化。正因为如此,咯和呋南不能直接 用强酸进行硝化、磺化等反应,要采用较温和的非质子性试剂。 另外,啶和咯虽然都含有氨原子,但前者孤电子对没有参与成键,能接受质子而显 减性,后者的孤电子对参与共轭,不但不能接受质子,而且表现出一定的弱酸性。 §11-2杂环化合物的性质 一、物理性质 五元和六元杂环结构上的美异,使它们在物理性质上也有很大的区别, 上述四种化合物中,吡啶的极性最大,且原子没有参与成键的孤电子对不仅能与水形 成氢键,还能与一些金属离子形成配位键。所以,啶与水能以任何比例互溶,又能溶解大 多数极性和非极性有机物(例如乙醇和乙醚),甚至能溶解某些无机盐类。 三个五元杂环化合物在水中的溶解良均小于啶,这是因为它门的孤电子对参与了共轭, 杂原子的电子密度降低。 二、化学性质 1亲电取代反应 B (1)卤代 脉cn 01 OBI Br2 乙酸室温S人B
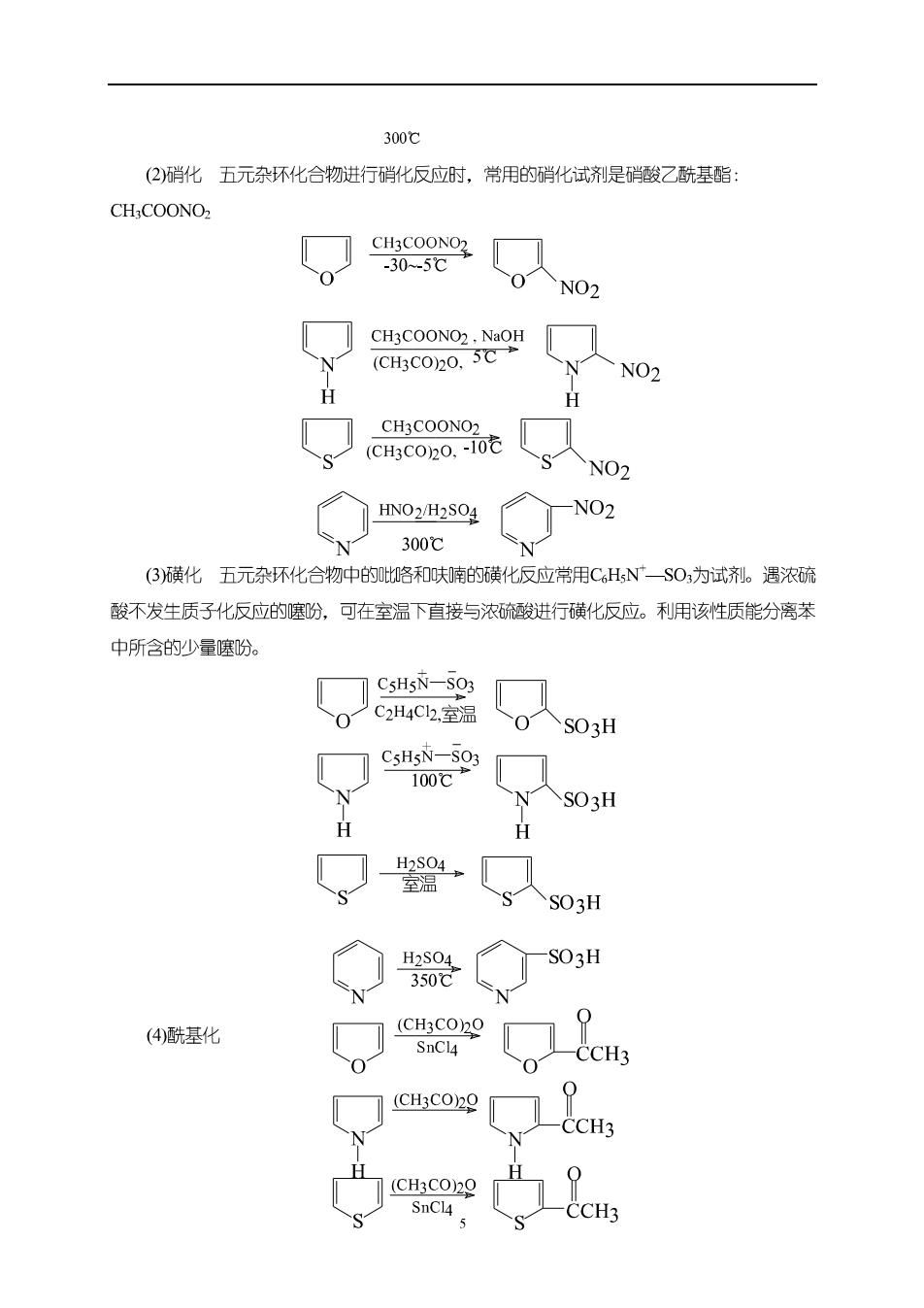
300℃ (2硝化五元杂环化合物进行硝化反应时,常用的硝化试剂是硝酸乙酰基酯 CHCOONO 9 NO CH3COONO2.NaOH NO2 H H CH3COONO (CH3CO2O.-10 CNO2 HNO2/H2S04 NO2 300℃ (3磺化五元环化合物中的咯和呋喃的磺化反应常用CHNSO,为试剂。遇浓硫 酸不发生质子化反应的噻盼,可在室温下直接与浓硫酸进行磺化反应。利用该性质能分离苯 中所含的少量噻盼。 CsHsN-S03 0 C2H4C12,.室温 0S03H C5HsN-SO3 100℃1 SO3H H H S SO3H ◇器 一S03H (4酰基化 (CH3COO (CH3C029 CCH3 (CH3CO)20 P SnCl4
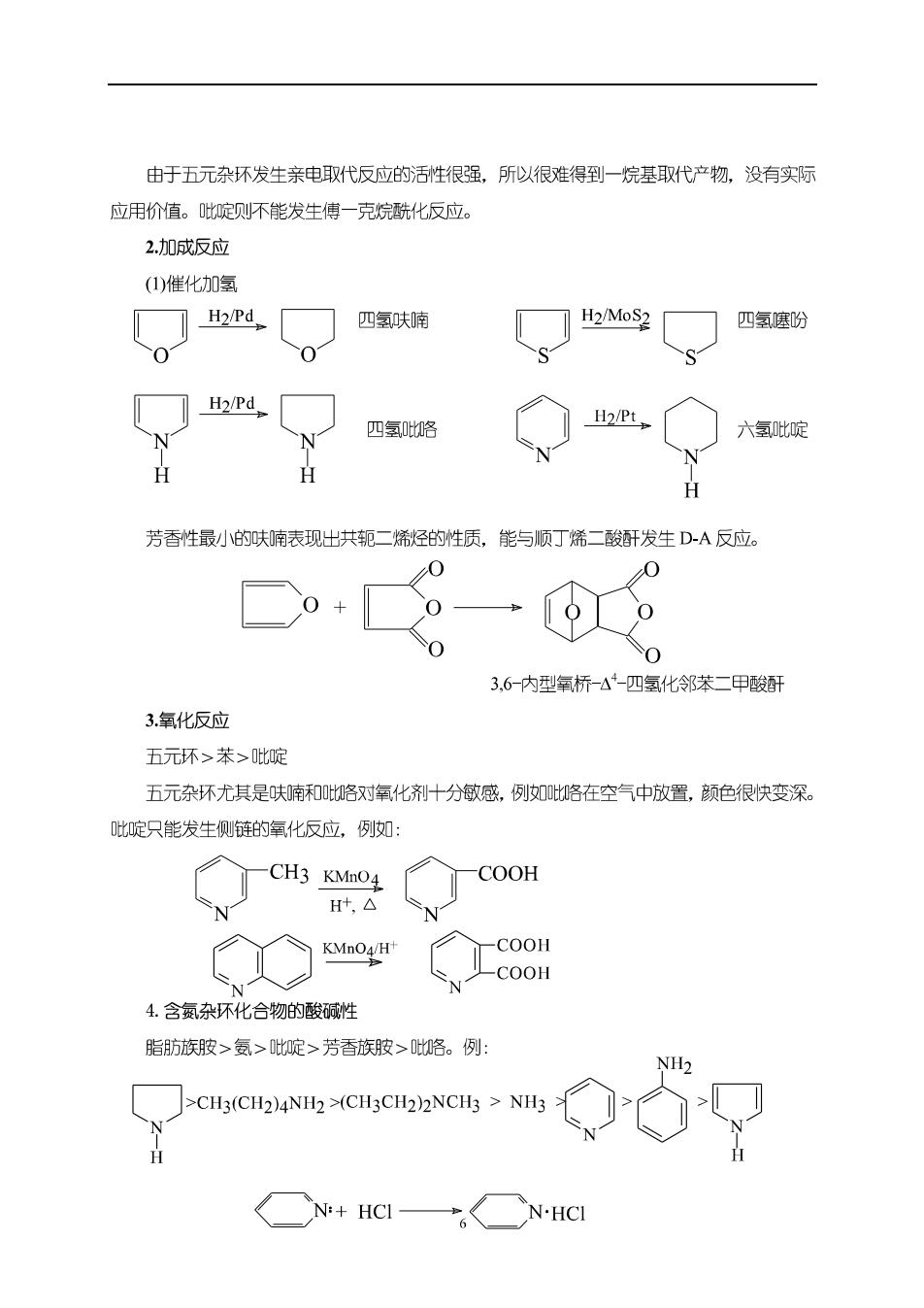
由于五元杂环发生亲电取代反应的活性很强,所以很难得到一烷基取代产物,没有实际 应用价值。啶侧不能发生傅一克烷酰化反应。 2加成反应 (1)催化加氢 H2/Pd 四氢呋喃 H2/MoS2 四氢噻盼 ]H2/Pd 四氢咯 H 芳香性最小的呋喃表现出共轭二烯烃的性质,能与顺丁烯二酸发生D-A反应, 0 0 3,6-内型氧桥-4-匹氢化邻苯二甲酸厨 3氧化反应 五元环>苯>吡啶 五元杂环尤其是呋喃和咯对氧化剂十分敏感,例如比咯在空气中放置,颜色很快变深 啶只能发生侧链的氧化反应,例如: —CH3KMnO4 COOH Ht,△ -COOH -C00H 4.含氮杂环化合物的酸碱性 脂肪族胺>氨>啶>芳香族波>咯。例 NH2 N:+HCI- N.HCI
N:+s03+〈N's0 §11-3重要的杂环化合物 一、糠醛 二、叶绿素与血红素 三、吡哆素 四、嘧啶衍生物 H-O 尿嘧啶互变异构 H 亚胺式 酰胺式 NH2 NH2 HO 一 N CH3 HN CH3 HO 胞密啶互变异构 胸腺密啶互变异构 NH2 H 腺嘌呤 在生物体内的DNA和RNA分子链中,上述三种密啶类杂环化合物和鸟嘌吟是以酰胺式 存在。 六、哚与吲哚乙酸

七、苯并吡喃衍生物 §11-4生物碱 生物碱是具有强烈牛理作用的含氨减性化合物,广泛存在于多种植物中,属次生代谢产 物。除少数结构比较简单的生物碱,分子中的氨原子不再环内,绝大多数是结构复杂的杂多 环化合物。在植物体内,生物常与酸结合成盐。许多中草药如:当归,麻黄,黄连等的有 效成分都属于生物藏类。到目前为止,已发现的生物超过6000种。 一、生物碱的种类及生理活性 二、生物碱的一般性质 1.物理形状 一般情况下,生物的分子是不对称分子,且多为左旋体。 2.减性 大多数生物碱显碰性,结构不同,碱性强弱不同。 3溶解性 多数游离的仲、叔胺型生物碰为脂溶性。 减性生物碱可溶于酸性水溶液。 4沉淀反应 大部分生物碱都能与某些酸类、重金属盐及相对分子质量大的配合物盐反应,生成单盐、 配合物盐或不溶性复合物沉淀。这类反应可用于预示植物体内生物的存在,能与生物碱反 应生成沉淀的试齐剂称为生物碱沉淀试剂。常见的生物碱试剂有: 碘碘化钾,碘化铋钾,磷钼酸和苦味酸等。 5显色反应 能与生物碱发生显色反应的试济剂称为生物诚显色试剂,常用于鉴别某些生物孤。例如: 吗啡+1%钒酸铵/浓硫酸·棕色 四、生物碱的提取和分离 利用生物碱在植物中的存在形式,选泽不同的提取分离方法。 1.H,O/适用于游离生物减的提取。 2.醇类溶剂适用于游离生物减和盐类

3.有机溶剂适用于游离生物威和盐类。例如: 原料细粉 碱减化,过滤 游离生物碱 氯仿、二氯甲烷等有机溶剂 水层 有机层 游离生物碱及脂溶性杂质 酸化 水层 有机层 生物碱威的盐 脂溶性杂质 减化 游离生物碱 氯仿、二氯甲烷等有机溶剂 水层 有机层 游离生物碱 蒸馏除溶剂 重结晶