
第一章结构与性质 题例1-1指出下列化合物中各个碳原子的杂化状态,标明形成每个碳碳共价键的原子轨道及 共价键的类型 (1)CH—CHC=CH (2)(CHC-CH=CH (3)CH2=CH-CHz-CH=CH2 【思路】有机化合物分子中的碳原子是以即、sp和s即三种杂化状念与其它原子成键,所形成的共价健有 。键和π键,键不可能独立存在,只能与σ键并存。此类愿目可按以下思路判断:若碳原子以4个单键与其它 原子相连,该碳原子为$印杂化,而单键就是。键:若碳原子以一个双键和两个单键与其它原子相连,该碳原子为 杂化,双键中有一个σ键和一个:能:若碳原子以一个三锭和一个单键或者通过两个双键与其它原子相连,则 该碳原子为s印杂化,三键中有一个σ键和两个:锭。 【解析】依据上述思路,解析如下: (1)CH CH C=CH Cmp-Cmp3 Cip-Cp Cap-Cip Caw-Car Cap:-Cpz (a (g ( (网 2)一88= Cn-CiCn一CpCp一Cp2和Cr一C ( Cr-Crs Cm-Cipa ( 3)8=8-8-8= Cp一Cn和Cr一CCp一Cp:和C一Cp 题例1-2试用键的极性和可极化性的概念比较C一F、C一C1、C一Br和C一I键极性强弱和 共价键异裂的难易程度。 【思路】解此类避目首先要掌握键的极性和可极化性的定义及区别,然后用无机化学中已掌握的相关知识 H一F、H一C、H一Br和H一I健的极性和水溶液的酸性类推。 【解析】在元煮周期表中,同一主族的元煮从上到下元素的电负性逐渐减小,原子吸引电子的德力趋弱 失去电子的能力趋强,原子半径逐渐增大。 健极性的强弱:对第Ⅶ主族的卤族元素来说,如果与凶原子形成共价健的原子相同时,键的极性从上到下依 次减弱,因此C-F、C-C1、C-Br、C一I锭极性强弱次序与H一、H-C、H-Br、H一I变化规律相同,即: C-F>C-CI>C-Br>C-I

共价健异裂的难易得度:对第M主族的卤元素来说,如果与卤原子形成共价健的原子相同时,健的可极化性 从上到下依次增大,所以在极性水分子这一外电场的影响下,日一X键异裂的程度依次增大,给出质子的能力即酸 性从强到弱的次序为:H一>H一B>H一C>H一F。同理,C一X键异裂的程度从易到难的次序为:C一>C一 Br>C-Cl>C-F 题例13试比较下列各组化合物沸点的高低。 (1)CH:CHCH2OH CH:CHCHO (2)CH,CHBr和CH,CHl (3)(CH)CH和CH:CH2CH2CH 【思路】从分子间作用力与沸点的关系入手,先考忠影响因素最大的氢键,其次是分子极性,再次是相对 分子质量和分子间接触积,最后是分子距离 【解析】能够形成分子间氢能的物质,沸点明显升高,且形成分子间氢键的能力越强,沸点越高。若形成 分子间氢健的能力相当,则分子极性越大,沸点越高。如果形成分子间氢健的能力和分子极性相当,就比较相对 分子质量:相对分子质量越大,色散力越大,沸点越高。如果前三个因素都相当,则比较支链数目和分子间距离: 支链数目越少、分子接触面越大、分子间距离越小,分子间作用力越大,沸点藏越高。因此3组化合物沸点的高 低次序比较如下 (1)CH:CH,CH,O日>CH:CH,CHO(前者能形成分子间氢键) (2)CH,CH,Br<CH,CHl(二者都不能形成分子间氢健,相对分子质量的影响超过分子极性》 (3)(CH)CH<CH,CH,CH,CH(二者都不能形成分子间氢键,分子极性相当,又是同分异构体,但后者为 直链烷烃,没有支能,分子间接触而大于前者,分子间距离小于前者) 题例14试说明下列反应的类型和试剂的性质。 (1)CH一C=CH+CH,O CH1一C=CH (2)CH3一C=CH+Cr →CH,-C=CH-CI (3)CH3-C=CH Br CH2一C=CH+HB 【思路】依照有机反应的两种分类方法,根据反应前后反应物和活性中间体结构的变化以及共价键的断裂方 式判断反成的类型和试剂的性质。 【解析】根据反应前后反应物和活性中间体结构的变化判断,()和(2)居于加成反应,(3)属于取代反 应:根据共价键的断裂方式判断,(1)和(2)属于离子型反应,(3)属于自由基反应。另外,既然任何一个离子 型反应都可看作是亲核试剂与亲电试剂之间的反应,那么如何环定一个离子型反应是亲核还是亲电的反应呢?答 案就是以反应中最先与碳原子形成共价锭的试剂为判断标准。因此反应(1)属于离子型亲核加成反应,因为与反 应物丙缺三键碳原子形成共价铠的是亲核试剂CH0,生成碳负离子中间体:反应(2)属于离子型亲电加成反应, 因为与反应物丙块三健碳原子形成共价健的是亲电试剂C,生成碳正高子中间体:反应(3)属于白由基型取代反 应,试剂B即和生成的活性中间体CH,一C三CH都是自由基

第二章波谱法在有机化学中的应用 题例2-1回答下列问题。 (1)如何用红外光谱区别下列各组化合物? AH,C-&-OH和 -C-OCH3 0 B.CHCH,CCHs CH3CH2CHC-H co和-oH (2)在下列化合物的H核磁共振谱中,哪个甲基上质子的化学位移最大? A.CH:CH=CH2 B.CHC=CH C.CH:CH2CH3 (3)某化合物的红外光谱:1700cm1有一强吸收峰,3000cm有一中强吸收峰。下列哪个 构造式代表该化合物? CHO 0 A. (4)某化合物分子式为CH,H核磁共振谱:=1.65(6,二重峰),=5.30(2H,四重 蜂)。下列哪个结构式代表该化合物? A.CH2=CHCH2CH3 B.< c.、Λ D.CH3CH-CHCH3 【思路】(1)和(3):从辨认化合物之间官能团的差异入手,利用红外光谱不同言能团的特征吸收频率加 以区别,或用给定的吸收频率确定化合物的结构。(2)考察的知识点是H核磁共振谱中被测化合物的结构对质子 化学位移的影响:如果质子附近存在吸电子能力强的基团,会导致其周出电子云密度下降、所受到的局部屏薇效应 减小、核磁共振信号移向低场,从而使化学位移增大:基团吸电子能力超强、数目越多、与质子相距越近,该质于 周国电子云密度下降的幅度就越大,所受到的局部屏蔽汝应也就越小,化学位移增幅也就越大。(4)题中给定的化 合物有两组H核磁共振信号,一般情况下有几组不等价质子靠有几组H核磁共振信号,所以要想确定哪个结构 式符合目要求,首先必须确认哪个结构式中有两组不等价的质子,且一组有6个质子,另一组有两个质子:其次 考虑每一组质子受邻碳质子自旋偶合影响共振信号的裂分数日。 【解析】依据上述思路,解析如下: (1)A,两个化合物都有喉基,但含骏基化合物的红外光谱在3300~2500cm处有0-H起的仲缩振动,以 此可区别骏酸和酯: B.两个化合物都有我基,但含醛基化合物的红外光谱在2820cm和2720cm处有中强的双峰,该峰为整基 不饱和碳的C一H锭仲缩振动,以此可区别醛和酮: C两个化合物都有碳碳双锭,但前者有酮基,所以其红外光请在~1700cm有强吸收,属拨基C一0锭的

仲缩振动:而后者无装基、有醇羟基,在3600一3300cm有强吸收,属醇0一H健的仲缩振动,以此区别二者。 (2)从第一章可知,不同杂化状态的碳原子电负性大小为:sp>sp>3p,而化合物A的甲基与sp杂化碳原 子相连,化合物B的甲基与即杂化碳原子相连,化合物C的甲基与p杂化碳原子相连,故化合物B的'H一核磁 共振谱中甲基上质子的化学位移最大。 (3)该化合物的红外光谱在1700cm'处有一强吸收峰,说明分子中含羰基,因此答案C和D可以排除:3000 cm1有一中强吸收峰,属苯环不饱和碳氢健的仲缩振动,故正确答案是B。 (4)题中给定的4个答案中,只有D符合要求。解此类题目时,不但要确定正确容案,而且要搞清楚其它化 合物为什么不符合要求。从题目给出的日-核磁共据管数据可知:化合物A有5组不等价的质子,化合物B只有1 组,化合物C有3组,而化合物D有2组.同时,因为化合物D分子对称,其中两个甲基的6个质子完全等价。 受邻碳一个质子自旋偶合影响,共振信号裂分成二重峰:双键两个不饱和碳上连的两个质子虽然处于邻碳,但由于 完全等价,彼此间有偶合但不裂分,因此只受邻碳3个质子自旋偶合影响,共振信号裂分成四重峰,且这两个质了 直接与sD杂化碳原子相连,化学位移大于一C日的6个质子,所以正确答案是D。 题例2一2同分异构体A、B和C分子式为CH,C1,三者的'H-核磁共振谱图中都不止一组 峰,其中A在=3.4处有二重峰,B在=3.5处有三重峰,C在=1.0处有三重峰(3H)、在 1.5处有二重峰(3H)。试推测化合物A、B和C的结构。 【思路】先写出分子式符合条件的所有结构异构体,然后根据H核磁共振图确定A、B和℃的结枸 【解析】从分子式可知,这3个化合物属卤代烷,符合分子式的结构异构体有4种: (D)CHCH-CH-CH-CI (2)CHSCH-CHCHs (3)CHCHCHCI (4)(CHCCI CH 其中(4)的H核磁共振谱图只有一组峰,不符合条件,A在心34处有二重峰,该组质子的碳原子一定与 氯直接相连(氯的电负性大,使该组质子的共振信号移向低场,化学位移增大),且邻碳上有1个质子,故化合物 4的构造式是(3).B在3.5处有三重峰,该组质了的碳原子也与氯直接相连,且邻碳上有2个质子,故化合物 B的构造式是(1).化合物C的构造式不用推测就是(2):构造式中有两个不对称的一CH,各为质子a和质子d: 厨子a离氯近、邻碳上一个质子,=15,二重峰:质子d离氯远、邻碳上两个质子,=10,三重峰 题例2-3某化合物分子式为CH,0,红外光谱:1715cm有强吸收峰:H核磁共振谱图显 示有3组峰:一个单峰(3H),一个四重峰〔2H),一个三重峰(3H)。试推测该化合物的结构式。 【思路】先由分子式计算山该化合物的不饱和度(Q),然后根据红外光谱确定其特征官能团,最后根据H 核磁共振谱确定有几组不等价的质子,何组又有几个等价质子,每组质子邻碳上连的是哪组质子· 【解析】由分子式计算出该化合物的一1,其红外光谱在1715cm又有强吸收峰,所以结构中应有1个 基。H核磁共振谱:单峰(3H),提示有一个一CH,且邻碳上没有质子,故该甲基与羰基碳直接相连:四重峰(2H)、 三重峰(3),提示该化合物分子中有一结构片段-CH,CH,且一CH一另一个邻碳上没有质子。放推得该化合物 结构式为: 0 CH.CCH.CHs 题例2-4某化合物(CH100),红外光谱:1705cm有强吸收峰:'H-核磁共振谐:6-2.0 (3H,单峰),3.5(2H,单峰),。7.1(5H,多重峰)。试推测该化合物的构造式。 【思路】思路同题例2-3。 【解析】由分子式计算山该化合物的2=5,可能有苯环(2=4):其红外光谱在1705cm又有强吸收峰
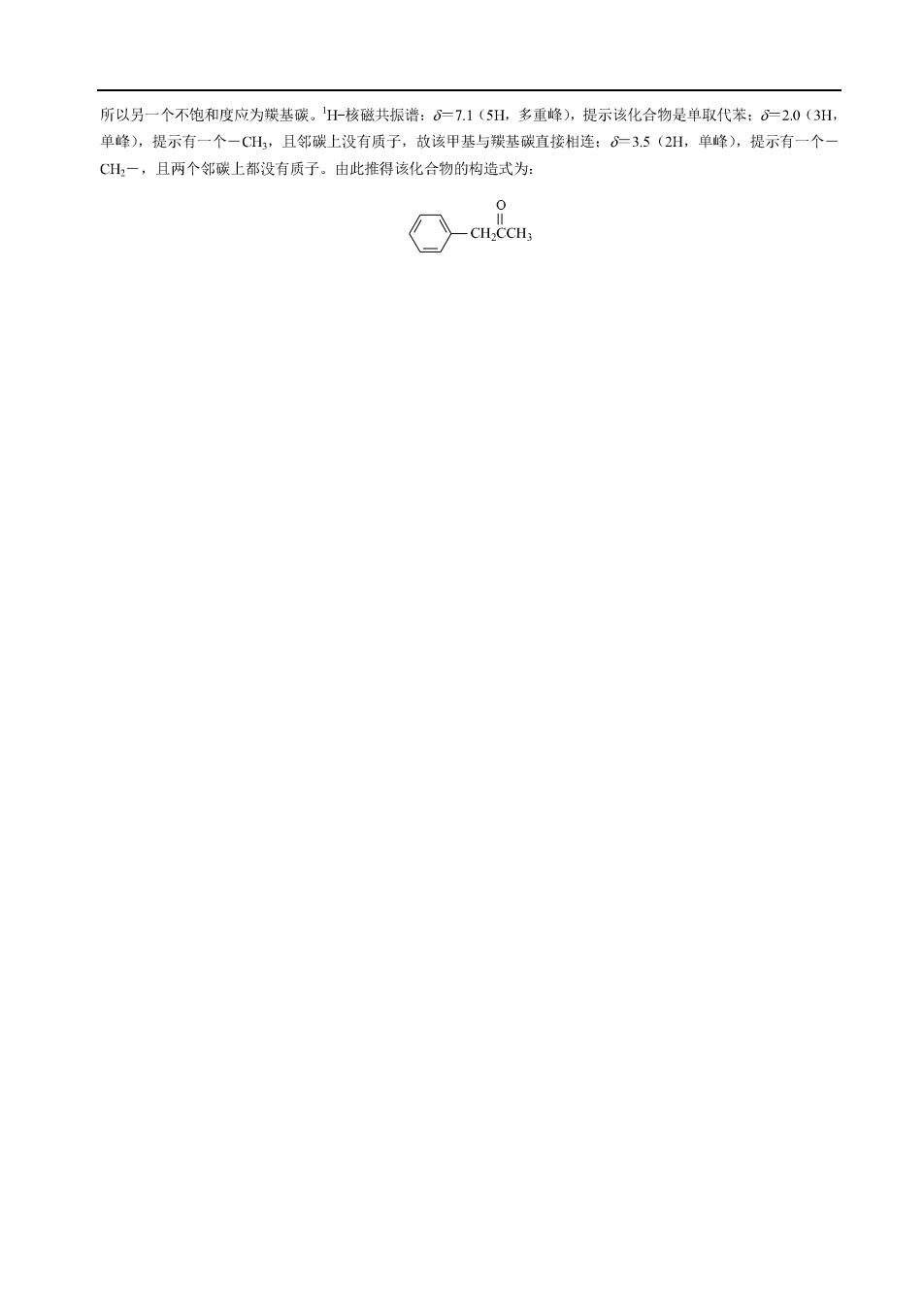
所以另一个不饱和度应为援基碳,H-核磁共振谱:。=7.1(5H,多重峰),提示该化合物是单取代苯:。20(3日, 单峰),提示有一个一CH,且邻碳上没有质子,故该甲基与我基碳直接相连:。35(2H,单峰),提示有一个 CH,一,且两个邻碳上都没有质子。由此推得该化合物的构造式为: ○-cucc

第三章开链烃 题例31用系统命名法命名下列化合物。 (I)CH;CH2CH-CHCH2C(CH3)3 (2)CH;CH(CH2CH=CH2)2 CH:CH.CHCH (3)CH=CCH2CH=CCH3 ④H,C c-QC=CCH, CH3 H 【思路】命名时应先选择主链,确定母体名称:然后给母体碳链编号,确定官能团和取代基的位次:最后 依据系统命名原则,参照支链烷烃命名和含官能团化合物命名的基木格式写山全名。 【解析】化合物(1)为烷烃,主链的选择有两种方法,应选择取代基最多(3个取代基)的最长碳链为主 链,并根据最低系列原则编号。化合物(2)为二烯烃,要选择包括两个碳碳双键的最长碳链为主链,因为分子是 对称结构,所以编号没有选择性。化合物(3)属于烯炔类,要选择包括碳碳双键和三键的最长碳链为主链,并使 双键和三健的位次尽可能低。化合物(4)也属于烯炔类,是用构型式书写的,要考感构型的标记:命名时先确定 构造式的名称,再标记其构型,该化合物主链的选择同(3),但主链的两种编号方法都符合最低系列原则,此时应 给双健以最低编号。化合物(5)为二烯烃,是用提线式表达其构型的,命名的思路与(2)和(4)类似,两个双 键的构型按位次从低到高依次标记。 按上述思路和解析对客化合物命名如下: (1)2,25-三甲基-4丙基庚烷 (2)4-甲基-1,6-庚二烯 (3)5-甲基-4己烯-1炔 (4)Z)2-已烯-4炔 (5)(2E,4B-5-甲基-2,4-庚二烯 题例3-2按要求完成下列各题。 (1)按下列化合物沸占高低排列顺序 正戊烷正己烷正庚烷异戊烷新成烷 (2)比较下列碳正离子的稳定性顺序。 A.CH=CHCH CH B.CH=CHCHCH C.CH CH-CHCH (3)比较下列化合物与溴的四氯化碳溶液加成反应活性。 CH2=CHCH;CH2=CH2CH2=CHNO2 CH2=CHCI (4)写出下列各化合物与氯化氢加成反应的产物 CICH=CH2 CF:CH=CH2 CH:CH2CH=CH2 (5)用Newman投影式表示化合物CH,CFCl2的稳定构象。 【思路】(】)依据分子间作用力与有机化合物物理性质的关系,题目所给的5个化合物形成氢键的能力和 分子极性相当,所以先按相对分子质量大小分组,相对分子质量大者沸点高:分在一组的同分异构体按支链数日从 小到大排序,支链数目少者沸点高。(2)先考虑p-灯共轭效应:P开共轭汝应越强,体系越稳定:再考感。p超共 轭效应和烷基的+1效应:带正电荷碳原子上所连的C一Hσ键和烷基数目越多,体系越稳定。(3)以乙烯为相对标 准,综合考忠诱导效应和共效应,与双健碳原子相连的基团能使π健电子云率度升高,则化合物亲电加成反应活 性大:反之,活性小,(4)综合考感诱导效应和共轭效应,判断双铠碳原子上所连基团会使π键上正负电荷如何分

布,亲电试剂优先进攻带部分负电荷的双键碳原子。(5)总体上讲,开链化合物的所有极端构象中,交义式构象比 重叠式构象稳定:在交叉式和重叠式构象中,又因绕。键相对旋转的两个原子上所连原子或基团的不同,还存在 对位交叉、邻位交叉、部分重叠、全重叠等构象:判断稳定性的依据就是看非键原子或基团,尤其是非键大基团之 的距离,彼此间距离越远,非锭斥力越小,稳定性就越大 【解析】按上述思路解析如下: (1)将5个化合物分成3组,沸点最低的一组是正戊烷、异戊烷和新戊烷,这一组中新戊烷支链数最多,其 次是异戊烷,正戊烷没有支链。所以沸点从高到低的顺序是:正庚烷>正己烷>正戊烷>异戊烷>新戊烷。 (2)将给出的3个碳正离子分成两组,B和C属于烯丙基型,都存在pπ共钜体系,稳定性大于A:除此 之外,B还存在3个C一Hσ键与带正电荷碳原子之向的σp超共辄因此稳定性顺序是:B>C>A (3)丙烯分子中的甲基使x键电子云密度升高,亲电加成反应活性大于乙烯的原因见p22解读2电子效应的 应用②烯烃的结构与亲电加成反应活性。 氯乙烯分子中既存在一CI的I效成,又存在+C效应(pπ共辄),二者方问相反,且-I>+C(C一C键們极 矩指向氯原子,但偶极矩绝对值小于氯乙烷C一C键,说明+C效应部分抵消了-」效应),其净结果使π键电子云 密度下降,不利于亲电试剂的进攻,故反应活性小于乙。 硝基乙烯的构造式如下: 0 CH:=CH-N=0 分子中一NO,的-1效应大于一C,同时还存在C一C一N-0的π-π共轭体系。共轭体系中离域的4个π电子 虽然在4个原子周国都能山现,但由于氧原子的电负性大,所以x电子向着氧原子的方向离域,产生-C效应,两 种效应的方向一致,使π健上电子云密度明显下降,反应活性比氯乙烯小。所以这4个化合物与澳的四氯化碳溶液 加成反应活性顺序为:CH,=CHCH>CH,=CH,>CH,=CHC>CH,=CHNO。 (4)CHCH,CH=C,分子中的一C,CH,对促上正负电荷分布所起的作用和一CH类似,与氯化氢的加 成取问符合马氏规则.CP,CI=CH,分子中的一C,所起的作用正好和一C相反,一CF,的1效应使C2一Cg键 的一对电子在C,上山现的概率密度或小,由于正负相吸,C本能地吸引异性电荷,使可极化性高的x健发生极化, 对电子在C,上出现的概率密度相对增大。所以亲电试剂矿优先进攻C,与氯化氢的加成取向违背马氏规见 CF,CI-Cr键上正负电荷分布如下所示: 2 CICH-CH分子中的+C效应,使共轭体系中负电荷分布在C,和C上(见p21解读2.p-π共轭中的实例3),所以 与氯化氢的加成取向符合马氏规则,由此得到3个化合物与氯化氢加成反应的产物: CLCHCH:CF:CH,CH,CI CH:CHCHCH (5)该化合物是乙烷的衔生物,由于其中一个碳原子所连3个原子相同,所以只有2种极端构象:交义式和 重叠式,其中最稳定的是非锭原子间相距最远的交叉式构象。用Newman投影式表示为:

题例3-3完成下列反应式(写出主要产物)。 (1)(CH3)2CHCH2CH3 1molBr2 (2)CHaCH-CH-CH-CH:Br/CCL Cl 500℃+ (4)CH:CHC CH_ (③)(CH3)2CHCH-=CH, H,0 C12 CH;C=CCH3 Hg>H 0 宝温,避光 0 【思路】首先,要结合反应物结构和反应条件,判断在给定的条件下有可能发生的反应属于反应物中某种 官能团的性质,还是官能团之间或官能团与非官能团之间相互影响产生的特性:其次,如果是同一类被此没有影响 的官能团,则应考感其它基团对这些官能团反应活性的影响,即在给定条件下哪个官能团优先发生反应:再次,要 考虑其它基团对官能团反应的取向所产生的影响:最后,即使发生的反应属于非官能团部分共价键的断裂,也应考 忠不同部位的反应活性 【解析】(I)反应物是统烃,没有官能团:在光照条件下与溴发生的是自由基溴代反应:如果发生一澳代, 涉及3种C一H健的均裂和4个不同部位的反应,即可得到4种一澳代产物,而反应活性最大的是3℃一H, (2)反应物是结构不对称的共柜二烯烃:与溴的四氯化碳溶液发生的是1,2-和1,4-亲电加成反应:甲基的+ 和+1效应使共柜效应传递山现正负电荷交替现象(见p23解读2电子效应的应用⑤共轭二烯烃的结构与1,4加成反 应),并影响反应的取向 (3)反应物是结构不对称的单烯烃:在高温气相条件下与氯气发生的是α氢原子的自由基氯代反应:在室温 下与氯气发生的是双键的亲电加成反应,且反应取向符合马氏规则。反应条件不同,直接影响反应的部位和产物 (4)两个反应物都是单炔烃,在酸性条件下,经汞离子催化与水发生亲电加成反应,得到烯醇式,再发生分 C=0结构的酮(甲基酮):第二个反应物结构对 R 称,不存在反应取向问题,所以二者的产物均为2.丁酮. (5)该反应属二烯体与亲二烯体的双烯合成反应:亲二烯体是顺丁烯二酸研(马米酸酐),在该反应中其反 应官能团是碳碳双键,是双烯合成常用的亲二烯体。 这五个反应的主要产物分别是: (2)CH;CH=CH-CH-CH2+CH;CH-CH=CH-CH2 Br B Br

(3)(CHA)CCH-CH:(CH)-CHCHCH:CI (④CH,CH,CCH CH.CH.CCH 题例34用化学方法鉴别下列化合物。 1-己烯2-己炔1-己炔己烷 【思路】题目要求用化学方法,也就是说不能根据物念、溶解性、气味等这些物理性质的不同来鉴别给定 化合物.鉴别时先将给定化合物按类别分组,然后根据官能团的典型化学性质鉴别不同类别的化合物,最后根据同 一类别化合物各自的某些特性鉴别同组化合物。 【解析】鉴别化合物所用的化学方法应尽可能简单、易于实现、便于操作,而且现象要明显。完成此类题 目时,要用流程示意图或列表的方法,不要用语言叙述。例如:要写出反应试剂和条件,用“√”或“十”表示能 发生反应,“×”或“一”表示不能发生反应,能发生反应者一定要写明现象 1-己烯) (十)红棕色褪去 2-己炔 (十)红棕色褪去 Ag(NH)2" (-)KMnO (+)繁色褪去,C01 BrCCL (-)J H (十)紫色褪去 1-己炔 室温避光 (十)红棕色褪去 (十)灰白色! 己烷 (-) 题例3-5化合物A和B,分子式都是CH,两者都能使溴的四氯化碳溶液褪色,A能与硝 酸银的氨溶液作用生成沉淀,A经高锰酸钾酸性溶液氧化得到CO,和(CH)2CHCOOH。B不与硝酸 银的氨溶液作用,B经高锰酸钾酸性溶液氧化得到HOOCCH,COOH和CO2。试推测化合物A利B 的结构。 【思路】要充分利用愿目所给的每一条结构信息,随着这些信息的利用,被推测化合物的范出逐渐缩小 直至得到最后结果。一般先根据分子式计算不饱和度,得出化合物各种可能的类别:再根据相关化合物的化学性质 不断缩小范,最终确定化合物的类别:然后根据有关化合物反应得到的已知生成物,从后往前反推化合物的结构, 多数情况下要利用被推测的化合物经一系列反应得到的稀烃,再经氧化所得产物(已知)来反推。此外,要注意题 目的要求。如果题目要求:写出该化合物的结构式,可不写推断过程:如果要求:推测该化合物的结构,则应写出 简要的推断过程:如果要求:写仙该化合物的结构式,并用反应式表示推断过程(或写出各步反应式),就不写推 断过程。但不管您目是否要求,写山各步反应式本身就是对结果最好的验证,有推断过程也便于对避目的检查。 【解析】①A和B:CH,2=2→A和B可能是开链二烯烃、环状单烯或开链单块烃: ②A能与硝酸银的氨溶液作用生成淀→A是端基快烃: ③A经高锰酸钾酸性溶液氧化得到CO,和(CH)CHCOOH→A分子中有两个结构片段:CH=和=CCH(CH2 ④B不与硝酸银的氨溶液作用→B可能是开二烯烃、非端基炔烃或环状单烯烃: ⑤B经高锰酸钾酸性溶液氧化得到HO0CCH,C00H和CO,二者碳原子个数之和为4,所以一分子B氧化后 得到两分子C0,共3个产物→B分子中有3个结构片段:CH,=、-CHCH,CH-、-CH,是开链二烯烃 由此推得:A:CH≡CCII(CH2B:CH,=CHCH,CH-CH
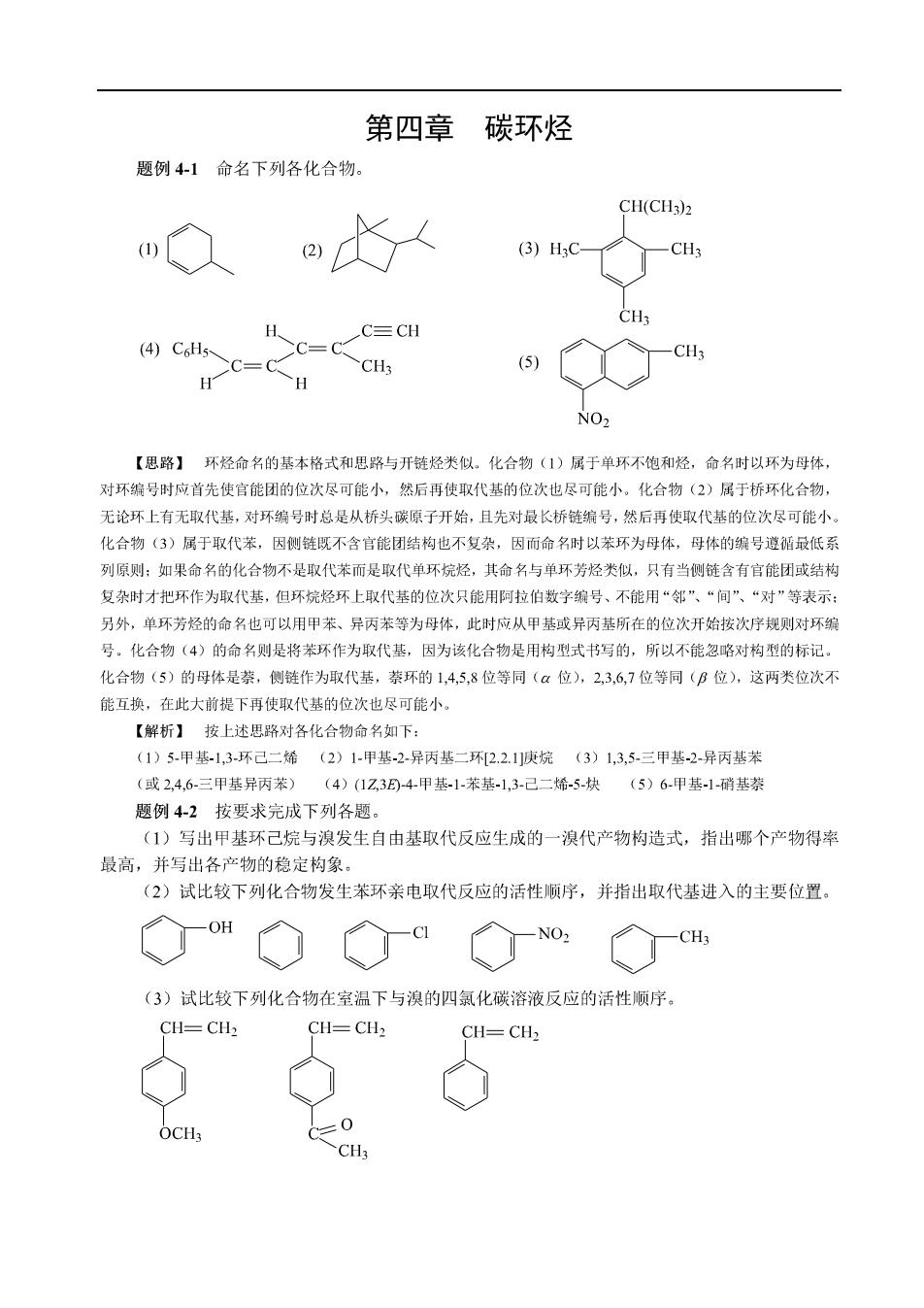
第四章碳环烃 题例4-1命名下列各化合物。 CH(CH3)2 (3)HC C≡CH (4)C6H5 C=C C=C (5) H H NO2 【思路】环烃命名的基本格式和思路与开链烃类似。化合物(1)属于单环不饱和烃,命名时以环为母体 对环编号时应首先使宫能团的位次尽可能小,然后再使取代基的位次也尽可能小,化合物(2)居于桥环化合物, 无论环上有无取代基,对环编号时总是从桥头碳原子开始,且先对最长桥链编号,然后再使取代基的位次尽可能小 化合物(3)属于取代苯,因侧链既不含官能团结构也不复杂,因而命名时以苯环为母体,母体的编号遵循最低系 列原则:如果命名的化合物不是取代苯而是取代单环烷烃,其命名与单环芳烃类似,只有当侧链含有官能团或结构 复杂时才把环作为取代基,但环烷烃环上取代基的位次只能用阿拉伯数字编号、不能用“邻“、“间”、“对“等表示 另外,单环芳经的命名也可以用甲苯、异丙苯等为母体,北时应从甲基或异丙基所在的位次开始按次序规则对环翁 号。化合物(4)的命名则是将苯环作为取代基,因为该化合物是用构型式书写的,所以不能忽略对构型的标记 化合物(5)的母体是茶,侧链作为取代基,萘环的1,45,8位等同(a位),2,36,7位等同(B位),这两类位次不 能互换,在此大前提下再使取代基的位次也尽可能小 【解析】按上述思路对各化合物命名如下: (1)5-甲基-1,3坏己二烯(2)1甲基-2异丙基二环2.2.1庾烷(3)1,35三甲基2异丙基苯 (或246三甲基异丙苯) (4)(1Z304甲基1苯基-1,3已二烯-5-炔(5)6-甲基-1-硝基 题例42按要求完成下列各题。 (1)写出甲基环己烷与溴发生自由基取代反应生成的一溴代产物构造式,指出哪个产物得率 最高,并写出各产物的稳定构象。 (2)试比较下列化合物发生苯环亲电取代反应的活性顺序,并指出取代基进入的主要位置 ◇m◇◇a NO: H (3)试比较下列化合物在室温下与溴的四氯化碳溶液反应的活性顺序。 CH=CH2 CH=CH2 CH=CH2 C=0 CH3