
第一章结构与性质 Structure and Property 1-1有机化学 Organic Chemistry 导言生活与有机化学 一、有机化学与有机化合物 1.有机化学发展简史 (1)利用 (2)提取 (3)合成 (4)有机化合物的结构:一维→二维→三维 (5)有机化学的近代发展 2.有机化学研究的对象 有机化学就是研究烃类及其衍生物的组成、结构、制备、性质和变化规律的科学。 3.有机化合物的特性 关键词结构决定性质,性质是结构的反映 (1)结构结构复杂,种类繁多,数目庞大。其特性主要由碳原子在周期表中的位置及成 键方式所决定。 (2)性质易燃烧;熔点和沸点低;大多难溶于水,易溶于非极性或弱极性有机溶剂;不 导电;反应速率一般较小,通常需要加热或加催化剂,且副反应较多。 二、有机化学与生命科学 1.有机化合物是构成动植物体的主要物质 2.生命运动的基础是生物体内物质分子的化学运动 化学亮点植物通过化学模仿进行“性欺骗” 3.自然资源的开发利用与有机化学 4.科学技术的发展与有机化学 参考文献吴毓林等.化学——生命科学的基本语言.科学,1997,49(1) 三、学习有机化学的要求及本学期课程安排 1

1.要求 ()学握基本理论、基本知识、基本技能 (2)提高分析问题、解决问题的能力 2.内容 (1)结构→结构与性质的关系→性质 (2)有机化学反应的原理和规律 (3)有机化学实验基本操作和技能 3.本学期教学安排 4.教学方法 5.主要教学参考书 ()邢其毅等编基础有机化学(上下册,第三版).高等教育出版社,2005 (2)高占先主编有机化学(第二版)高等教育出版社,2007,直向21世纪课程致衫 (3)汪小兰编有机化学(第四版),高等教育出版社,2005 (4)高鸿宾主编有机化学(第四版)高等教育出版社,2006,面向21世纪课程教材 (5)GPatrick.有机化学(影印版)科学出版社,2000 (6)床玮等编有机化学学习指导.高等教育出版社,2007,傅建熙主编《有机化学》(第二 版)配套教学参考书 (7)周文明主编有机化学典型题解析及自测试题.西北工业大学出版社,2003 S1-2共价键与分子结构 Covalent Bond and Molecular Structure 一、原子轨道和核外电子排布 1.原子轨道 在经典物理中:根据波动方程(偏微分方程)求出的波函数用于猫述波的运动状态→电 子等微观粒子具有波粒二象性·同样可以根据波动方程求出描述电子运动状态的波函数 平(化,)一→平(,p)一→Ψ在三维空间的图形.反映了在核外空间能找到电子的区域,该区域 可代表原子轨道的图形→波函数平称为原子轨道·用球坐标表示波函数时,平为r0.g 三个变量的函数,r表示电子与核的距离,日和φ表示电子的方位→反映出在空间某一点 找到电子的几率。 原子的核外空间,从内到外有各种能级不同的电子层→离原子核越远→电子层的能
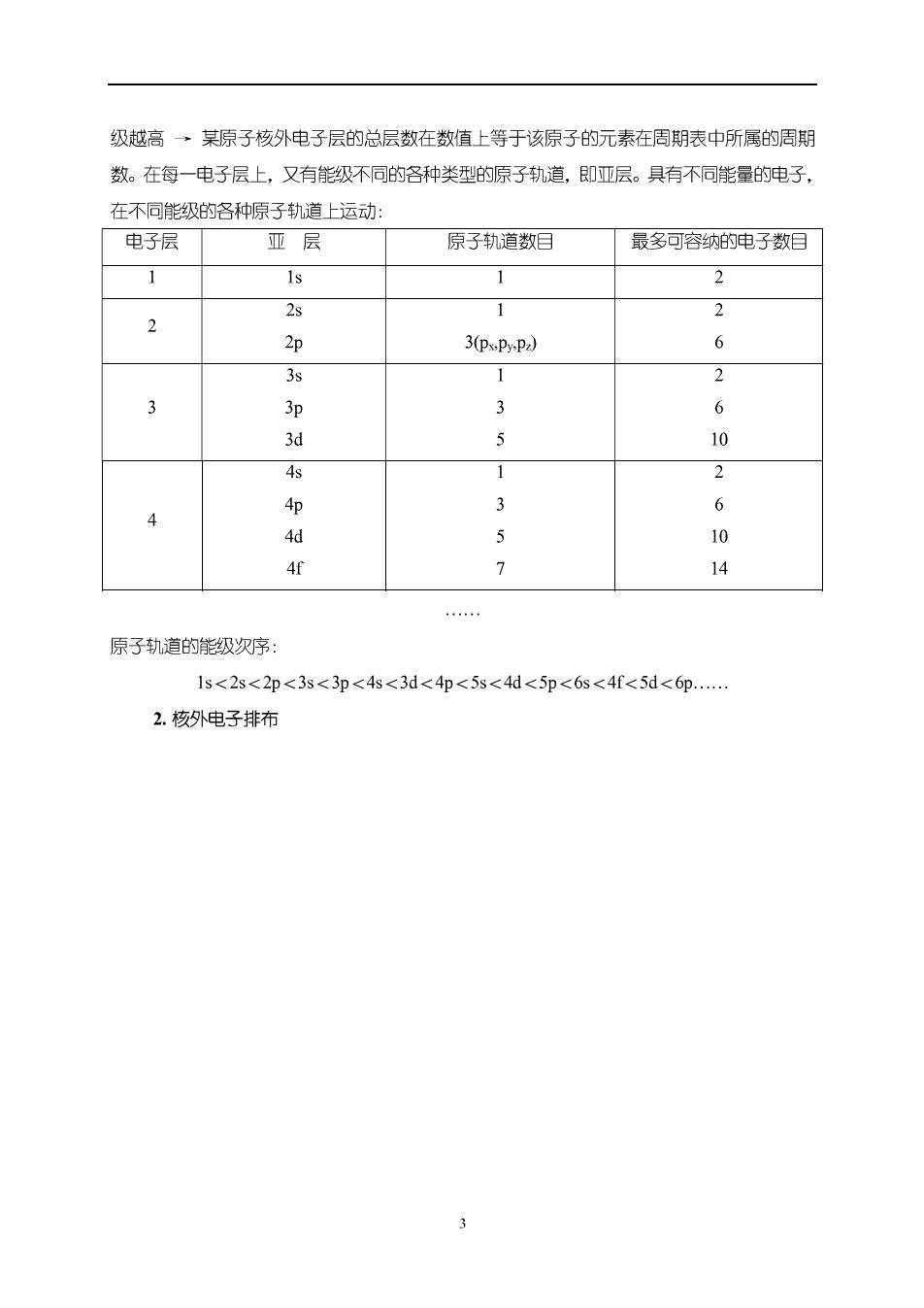
级越高·某原子核外电子层的总层数在数值上等于该原子的元素在周期表中所属的周期 数。在每一电子层上,又有能级不同的各种类型的原子轨道,即亚层。具有不同能量的电子 在不同能级的咯种原子轨道上运动 电子层 亚层 原子轨道数目 最多可容纳的电子数目 1 。 1 2 2 3(pxPyP2) 6 9 2 3 3p 3 6 3d 10 4s 2 3 4 4p 6 5 10 4f 7 原子轨道的能级次序: 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p… 2.核外电子排布

片片a分 ☒ 片片片片合片片片台分分台台 ☆☆☆者☆者☆☆☆ 么么么 n2

二、共价键理论 1.价键理论 价键理论所用的量子力学方法一电子配对法:两原子各有一个自旋相反的未成对电 子,相遇时才能配对成键。 共价键的特性:饱和性和方向性。 共价键的类型:σ键和π键。 2.杂化轨道理论 (1)类型 类型 基态 激发态 杂化态 $p:4个杂化轨道 C:sp W 0 mun 轨道间夹角109.59 2p2 2s1 2p3 0:不等性sp w mom T 轨道间夹角1045 2s2 2p4 N:不等性sp 四0 团 轨道间夹角107° 2S22p3 $p:3个杂化轨道 有1个设有参与杂化的 轨道间夹角120 p轨道 2p2 2S2 0(或S) 2p4 四 2S2 N w hmn 2P3 职 2 sp:2个杂化轨道 有2个没有参与杂化的 轨道间夹角180 p轨道 四 mnmn 292 2p2 即杂化态2Pp2 (2)实质:原子轨道的线性组合一一杂化,形成新的原子轨道。例如:碳原子的1个2s 轨道和3个2印轨道线性组合形缄4个sp杂化轨道

④1=a1p+b1④x+c④pytd1pp D:-a:D.+b:Dp+c:Dpy+dDp ①3=ap,+b④m+c3ppy十d④p Φ=a4b,+b4中x+caDpy+d中p 3.分子轨道理论 分子轨道:电子在整个分子中运动的状态函数一”~成键电子不再定域于两个成键原 子之间,而是在整个分子内运动离域每个分子轨道具有一定的能级分子中的电子, 根据能量最低原理、Pauli原理和Hud规侧逐级排列在分子轨道中组成分子的各个原子的 原子轨道线性组合,形成分子轨道→符合“轨道能量接近,能够最大重叠,位相相问”的成 键原侧~能组合成能量比原子轨道低的稳定的分子轨道·分子轨道中节面数↑轨道的饯 量↑。 三、共价键的键参数 ”关键词结构决定性质,性质是结构的反映 1.键长 以共价键结合的两个原子核之间的平衡距离—键长。键长!一→共价键强度↑ 2.键角 分子中某一原子与另外两原子形缄的共价键在空间的夹角键角。键长和健角决定了 分子的立体形状。 3.键俄 在一个大气压和25℃下,将1ml气态双原子分子每个分子离解为两气态中性原子所需 要的能量一离解能。双原子分子:离解能=键能,两个不同原子组成的多原子分子:键 能=共价键的平均离解能。键能!→共价键强度↓。 4.键的极性 (1)电负性原子成键时,对成键电子的吸能力。吸引能力↑→原子的电负性↑。两成 键原子的电负性差别↑一→键的极性↑。 常见原子电负性大小次序: F>Cl>Br>I,F>0>N>C 8+6 (2极性共价健H3C一C (3)非极性共价键

(4键偶极矩矢量,大小:uq×d,方向:十中。μ↑→键的极性↑。 (⑤分子偶极矩键偶极矩的矢量和,μ个→分子的极性↑。 (6极性分子分子中正负电荷中心不重合,0,存在固有偶极。 5键的可极化度 键的极化:外电场诱导下产生的偶极一诱导偶极→起键的极化→键极性改变的 能力键的可极化度。成键原子半径↑·共价键的可极化度↑。 §13分子间作用力与有机化合物的物理性质 Intermolecular Force and Physical Properties of Organic Compounds 一、分子间作用力 1.取向力 极性分子固有偶极一分子定向排列·静电引力,取向力。分子极性↑,分子间距离! 取向力↑。 2.诱导力 极性分子的固有偶极诱导另一个极性分子或非极性分子产生诱导偶极,极性分子间、极 性分子和非极性分子间固有偶极与诱导偶极之间的静电3引力·诱导力。分子极性↑、被诱导 分子的变形性↑、分子间距离↓→诱导力↑。 3.色散力 分子中的电子及各原子的原子核的运动一瞬时偶极,极性分子间、极性分子和非极性 分子间、非极性分子间通过瞬时偶极产生的作用力一一色敷力。分子的变形性↑、分子间距 离↓、分子间接触表面积↑→色散力↑。 4.氢键 (1)定义 (2)形城氢键的条件X一H.Y一R (3)氢键的特点方向性和饱和性 (4)氢键的种类 分子间氢键 CH3 CH3 CH3 CH3 H CH3 H …0-H…0-H-0-H …0-H-0-H0-H…0-H- 甲醇分子间氢键 甲醇与水分子间氢键

分子内氢键 H ○ N=0 邻硝基苯酚分子内氢键 二、分子间作用力与有机化合物的物理性质 ÷关键词结构决定性质,性质是结构的反映 l.沸点:boiling point(b.p.) 形成氢键的能力 分子间作用力↑分子极性↑ b.p.1 相对分子质量↑ (分子间距离! 例1:丙醇和丙三醇 例2:邻、对硝墓苯酚 例3:溴乙烷和乙烷 例4:戊院和己烷 例5:正戊烷和新戊烷 2.熔点:melting point(mp.) 分子间作用力、分子对称性↑一·mp.↑ 例:邻二氯苯和对二氯苯 3.溶解度:solubilit6y(S) 溶解的实质用溶质与溶剂分子间作用力取代溶质分子间、溶剂分子间作用力。 溶解的原则相似相溶 例:CH,OHHO,CHOH/CCL,CHsCOOH/HO,Ci2H2sCOOH/H-O 参考文献:决定物质性质的一种重要因素一一分子间作用力.大学化学,1989,42) §1-4有机化合物的结构与性质 一、同分异构现象 1.同分异构现象

碳链异构 顺反异构 (1)结构异构 官能团异构 (2)立体异构 旋光异构 位置异构 构象异构 互变异构 2.结构式表示方法 (1)蛛网式 (2)结构简式 (3)键线式 二、有机化合物的分类 1,按碳链分类 开链 (1)脂防族 环状 (2)芳香族 (3)杂环 2.按官能团分类 三、有机化学反应 1.有机反应类型 游离基型 按共价键的断裂方式分为 亲电 ABA:+B· 均裂 离子型 亲核 A:B-A++B- 异裂 2有机反应历程 一步反应:生成过渡态 两步反应:生成反应中间体 四、有机化合物结构与性质的关系 决定 结构 ÷性质 反映 近代结构理论