
旋光法测定蔗糖转化 反应的速率常数 UNIVERS -Rate Constant for the Conversion of Sucrose by a Polarimetric Method 5
旋光法测定蔗糖转化 反应的速率常数 ─Rate Constant for the Conversion of Sucrose by a Polarimetric Method

目的要求 一、了解旋光仪的基本原理,掌握旋光仪的正确使 用方法: 二、了解反应物浓度与旋光度之间的关系: 三、测定蔗糖转化反应的速率常数和半衰期。 夫学是6出记学实验 1一=
目的要求 一、了解旋光仪的基本原理,掌握旋光仪的正确使 用方法; 二、了解反应物浓度与旋光度之间的关系; 三、测定蔗糖转化反应的速率常数和半衰期

基本原理 H+ C12H22011(蔗糖)+H20)C6H1206(葡萄糖)+CH1206(果糖) 该反应是一个二级反应,由于反应时时大量存在的,而且H+浓度保持不 变,因此蔗糖反应可看作为一级反应。 对于一级反应 In(c/[cl)=-kt In(co/[c]) c=co-y 半衰期 以2或t表示 级反应的半衰期为 n2- 0.693 k k 大学出记学实验
基本原理 该反应是一个二级反应,由于反应时时大量存在的,而且H+浓度保持不 变,因此蔗糖反应可看作为一级反应。 H+

旋光度 蔗糖及其转化产物都具有旋光性,物质的旋光能力用比选光度来度量, 比旋光度定义: 溶液的比旋光度=[a]'=100·ā/(c·1) [α],:表示旋光性物质在t℃、光源的波长为λ时的比旋光度。光源的波长一般用钠光 的D线,在20℃或25℃测定。如[a]。20(水)表示某旋光化合物以水为溶剂在20℃时在钠 光的D线下所测的比旋光度: α:标尺盘转动的角度读数(即旋光度),用旋光仪测定: 入:光源的光波长: d:纯液体的密度(单位:gcm3): l:旋光管的长度(单位:dm): c:溶液的浓度(100mL溶液中所含样品的质量,g): t: 测量时的温度(℃)。 大学磨石出记学实验 一三
旋光度 蔗糖及其转化产物都具有旋光性,物质的旋光能力用比选光度来度量, 比旋光度定义:
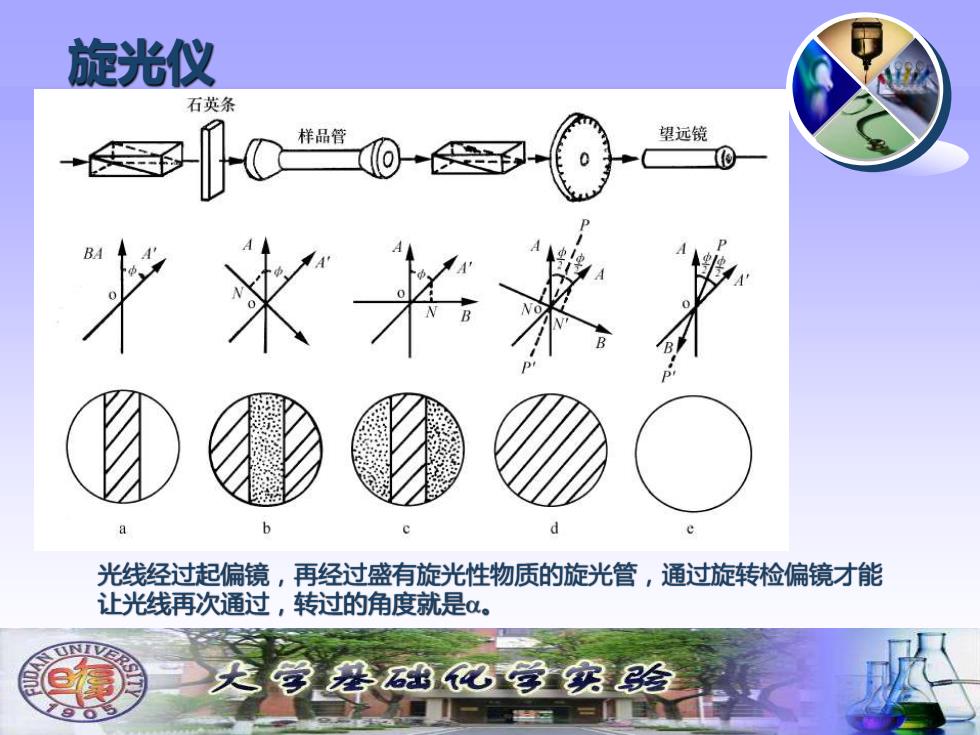
旋光仪 石英条 样品管 望远镜 光线经过起偏镜,再经过盛有旋光性物质的旋光管,通过旋转检偏镜才能 让光线再次通过,转过的角度就是。 尖学磨出记学实验
旋光仪 光线经过起偏镜,再经过盛有旋光性物质的旋光管,通过旋转检偏镜才能 让光线再次通过,转过的角度就是

反应动力学 >体系最初的旋光度: a0=β反c0 > 体系最终的旋光度:。阝生co >f 时间为t时,旋光度:a,=B反c+B反(co-c) >动力学方程: In(a,-a)=-kt +In(do-a) 一犬学是出记学实验
反应动力学 ➢ 体系最初的旋光度: α0 0 =β 反c ➢ 体系最终的旋光度: α = 0 β c 生 ➢ 时间为t时,旋光度: α =β 0 c + β c -c) t 反 反 ( ➢ 动力学方程: 0 ln(α - ) = - + ln(α - ) t kt

实验步骤 >旋光仪的零点校正 用蒸馏水校正旋光仪的零点,样品管装满蒸馏水 管内不应有气泡。测量时旋转检偏镜至能观察到三分视野 暗度相等为止,记下起偏镜旋光度。 > 反应过程的旋光度测定 将恒温水浴和恒温箱都调节到反应所需的温度,蔗糖 盐酸恒温一段时间,盐酸加入到蔗糖中,开始反应计时,并测 定反应过程中的旋光度。 将反应液放入50-60℃水浴中反应,冷至实验温度下测试 旋光度,即得a% 尖学老石出记学实验
NMR样品管 实验步骤 ➢ 旋光仪的零点校正 用蒸馏水校正旋光仪的零点,样品管装满蒸馏水, 管内不应有气泡。测量时旋转检偏镜至能观察到三分视野 暗度相等为止,记下起偏镜旋光度。 ➢ 反应过程的旋光度测定 将恒温水浴和恒温箱都调节到反应所需的温度,蔗糖、 盐酸恒温一段时间,盐酸加入到蔗糖中,开始反应计时,并测 定反应过程中的旋光度。 将反应液放入50-60oC水浴中反应,冷至实验温度下测试 旋光度,即得 α

数据处理 >绘制不同温度下,与对应时间的关系 >绘制ln(C,-a心m)与关系,由直线斜率求反应 速率常数k,并计算半衰期t12。 >由不同温度下速率常数,根据Arrhenius公式 计算反应的平均活化能。 天学石出记学实验
数据处理 ➢ 绘制不同温度下 与对应时间t的关系。 ➢ 绘制 与t关系,由直线斜率求反应 速率常数k ,并计算半衰期t1/2。 ➢ 由不同温度下速率常数,根据Arrhenius公式 计算反应的平均活化能。 αt ln(α - ) t