
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 2 章 化学键与分子结构 Chapter 2 Chemical Bond and Molecular Structure 教学要求 1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的特征,会用价电子对互斥理论和 杂化轨道理论解释简单的分子结构; 5.初步认识分子轨道,掌握第二周期元素的分子轨道特点; 6.理解金属键理论,特别是能带理论,会用能带理论解释固体分类; 7.初步了解晶体与非晶体的区别和晶体的内部结构; 8.认识分子间作用力和氢键的本质,会用其解释对物质性质的影响。 课时分配(8 学时) 1.化学键的定义; 2.离子键理论; 3.电子对键与路易斯结构式; 共 2 学时 4.价层电子对互斥理论; 5.价键理论; 6.杂化轨道理论; 共 4 学时 7.化学轨道理论; 8.金属键理论; 9.分子间力、氢键; 共 2 学时 前言 1.从结构观点看,除稀有气体外,其它原子都是不稳定结构,因此不可能以孤立的原 子存在,而是以可以独立存在的分子形式存在,分子由原子组成,是参与反应的基本单元, 可以是一个原子组成(rare gas 金属蒸气),可是以千千万万(为金刚石等)。物质的性质取 决于分子性质。 2.取决于分子的内部结构——了解物质的性质和化学反应规律,分子结构包含的内 容: (1)分子中原子间的强相互作用力(>40kJ·mol-1),即化学键(可由 IR, UV 等实验判断,也可进行量子力学计算); 分子水平研究 (2)分子或晶体的空间构型(即几何形状),可由四圆衍射测定或理论推测; (3)分子间力;
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 2 章 化学键与分子结构 Chapter 2 Chemical Bond and Molecular Structure 教学要求 1.认识化学键的本质; 2.掌握离子键的形成及其特点; 3.掌握离子的特征,离子极化概念; 4.掌握价键理论的内容;会用价键理论解释共价键的特征,会用价电子对互斥理论和 杂化轨道理论解释简单的分子结构; 5.初步认识分子轨道,掌握第二周期元素的分子轨道特点; 6.理解金属键理论,特别是能带理论,会用能带理论解释固体分类; 7.初步了解晶体与非晶体的区别和晶体的内部结构; 8.认识分子间作用力和氢键的本质,会用其解释对物质性质的影响。 课时分配(8 学时) 1.化学键的定义; 2.离子键理论; 3.电子对键与路易斯结构式; 共 2 学时 4.价层电子对互斥理论; 5.价键理论; 6.杂化轨道理论; 共 4 学时 7.化学轨道理论; 8.金属键理论; 9.分子间力、氢键; 共 2 学时 前言 1.从结构观点看,除稀有气体外,其它原子都是不稳定结构,因此不可能以孤立的原 子存在,而是以可以独立存在的分子形式存在,分子由原子组成,是参与反应的基本单元, 可以是一个原子组成(rare gas 金属蒸气),可是以千千万万(为金刚石等)。物质的性质取 决于分子性质。 2.取决于分子的内部结构——了解物质的性质和化学反应规律,分子结构包含的内 容: (1)分子中原子间的强相互作用力(>40kJ·mol-1),即化学键(可由 IR, UV 等实验判断,也可进行量子力学计算); 分子水平研究 (2)分子或晶体的空间构型(即几何形状),可由四圆衍射测定或理论推测; (3)分子间力;

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 (4)分子的结构与物性间的关系; 3.化学键的本质是什么?为什么总是按一定的比例化合? 1916 年 Kossel——稀有气体的稳定结构提出离子键理论(简单明了,但不能说明 H2、 O2、N2 等相同原子组成的双原子分子) 1916 年 Lewis——共享电子对——共价键理论(根据电磁知识,很难解释为什么能共享 电子对就能结合成稳定的分子) 1927 年——Heitler 和 London 把量子力学应用到 H2 分子的形成上。 现代的物理研究成就提供了研究基础:四圆衍射磁性,核磁共振等。 解释了: a.分子的稳定性和共价键的本质问题; b.共价键的饱和性; c.分子的几何构型和共价键的方向性; d.化学键和分子的物化性质的关系。 4.化学键(现在已明确知道的化学键的类型) 5.分子间力和氢键:这些概念都在深入——超分子化学 随着化学进入一个复杂体系尤其是生命体系后,化学就不仅仅涉及我们研究对象分子的 成键和断键,也即不仅是离子键和共价键那样的强作用力,而且必须考虑这一复杂体系中分 子的弱相互作用力,如范德华力、库伦力、π-π堆集和氢键等等。虽然它们的作用力较弱, 如其中较强的氢键键能一般仅为普通 C—H 共价键键能的四分之一不到,但由此都组装了分 子聚集体、分子互补体系或通称的超分子体系。此种体系具有全新的性质或可使通常无法进 行的反应得以进行。在生物体中最著名的 DNA 的双螺旋结构就是由源自氢键的碱基配对而 形成的。高效的酶催化反应和信息的传递也是通过分子聚集体进行的。这样一个分子间互补、 组装的过程也就是通称的分子识别的过程。 DNA 的碱基主要有四种:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。 生物体的遗传信息的密码的形式编码在 DNA 上,表现为特定的核苷酸排列顺序,并通 过 DNA 的复制由亲代传递给子代。 由于生命活动是通过蛋白质来表现,所以生物的遗传特征实际上是通过 DNA→RNA→ 蛋白质过程传统的。 DMA ← → ( ) ( ) 反转录 酶 转录 酶 RNA 转录 → 蛋白质 复制(酶) 复制(酶) DNA 分子双螺旋结构模型(a)及其图解(b) 酶催化作用的锁-钥理论 Lock and key model of enzyme action
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 (4)分子的结构与物性间的关系; 3.化学键的本质是什么?为什么总是按一定的比例化合? 1916 年 Kossel——稀有气体的稳定结构提出离子键理论(简单明了,但不能说明 H2、 O2、N2 等相同原子组成的双原子分子) 1916 年 Lewis——共享电子对——共价键理论(根据电磁知识,很难解释为什么能共享 电子对就能结合成稳定的分子) 1927 年——Heitler 和 London 把量子力学应用到 H2 分子的形成上。 现代的物理研究成就提供了研究基础:四圆衍射磁性,核磁共振等。 解释了: a.分子的稳定性和共价键的本质问题; b.共价键的饱和性; c.分子的几何构型和共价键的方向性; d.化学键和分子的物化性质的关系。 4.化学键(现在已明确知道的化学键的类型) 5.分子间力和氢键:这些概念都在深入——超分子化学 随着化学进入一个复杂体系尤其是生命体系后,化学就不仅仅涉及我们研究对象分子的 成键和断键,也即不仅是离子键和共价键那样的强作用力,而且必须考虑这一复杂体系中分 子的弱相互作用力,如范德华力、库伦力、π-π堆集和氢键等等。虽然它们的作用力较弱, 如其中较强的氢键键能一般仅为普通 C—H 共价键键能的四分之一不到,但由此都组装了分 子聚集体、分子互补体系或通称的超分子体系。此种体系具有全新的性质或可使通常无法进 行的反应得以进行。在生物体中最著名的 DNA 的双螺旋结构就是由源自氢键的碱基配对而 形成的。高效的酶催化反应和信息的传递也是通过分子聚集体进行的。这样一个分子间互补、 组装的过程也就是通称的分子识别的过程。 DNA 的碱基主要有四种:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。 生物体的遗传信息的密码的形式编码在 DNA 上,表现为特定的核苷酸排列顺序,并通 过 DNA 的复制由亲代传递给子代。 由于生命活动是通过蛋白质来表现,所以生物的遗传特征实际上是通过 DNA→RNA→ 蛋白质过程传统的。 DMA ← → ( ) ( ) 反转录 酶 转录 酶 RNA 转录 → 蛋白质 复制(酶) 复制(酶) DNA 分子双螺旋结构模型(a)及其图解(b) 酶催化作用的锁-钥理论 Lock and key model of enzyme action
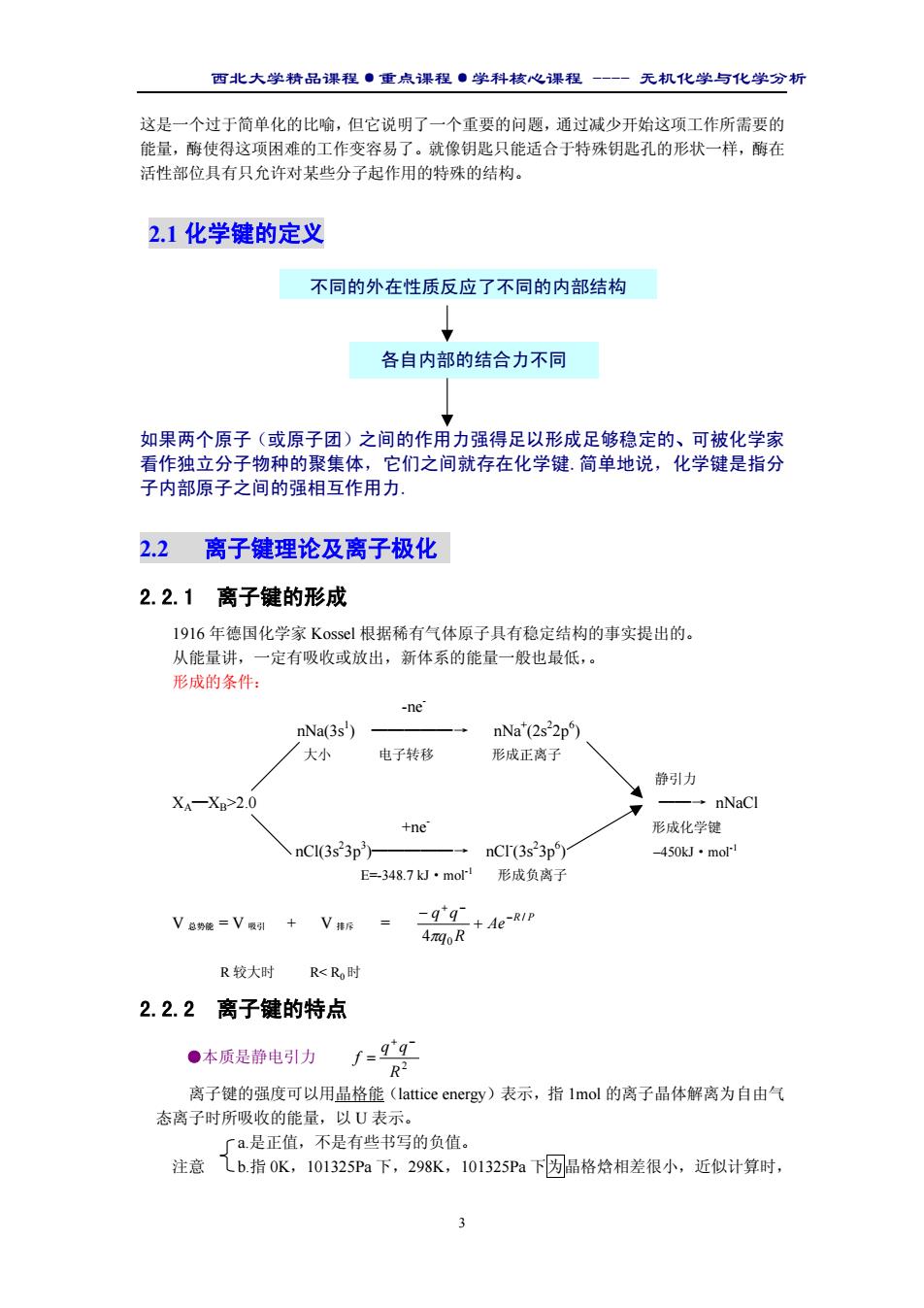
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 这是一个过于简单化的比喻,但它说明了一个重要的问题,通过减少开始这项工作所需要的 能量,酶使得这项困难的工作变容易了。就像钥匙只能适合于特殊钥匙孔的形状一样,酶在 活性部位具有只允许对某些分子起作用的特殊的结构。 2.1 化学键的定义 如果两个原子(或原子团)之间的作用力强得足以形成足够稳定的、可被化学家 看作独立分子物种的聚集体,它们之间就存在化学键.简单地说,化学键是指分 子内部原子之间的强相互作用力. 2.2 离子键理论及离子极化 2.2.1 离子键的形成 1916 年德国化学家 Kossel 根据稀有气体原子具有稳定结构的事实提出的。 从能量讲,一定有吸收或放出,新体系的能量一般也最低,。 形成的条件: -ne- nNa(3s1 ) —————→ nNa+ (2s2 2p6 ) 大小 电子转移 形成正离子 静引力 XA—XB>2.0 ——→ nNaCl +ne- 形成化学键 nCl(3s2 3p3 )—————→ nCl- (3s2 3p6 ) –450kJ·mol-1 E=-348.7 kJ·mol-1 形成负离子 V 总势能 = V 吸引 + V 排斥 = R P Ae q R q q / 0 4 − + − + − π R 较大时 R< R0时 2.2.2 离子键的特点 ●本质是静电引力 2 R q q f + − = 离子键的强度可以用晶格能(lattice energy)表示,指 1mol 的离子晶体解离为自由气 态离子时所吸收的能量,以 U 表示。 a.是正值,不是有些书写的负值。 注意 b.指 0K,101325Pa 下,298K,101325Pa 下为晶格焓相差很小,近似计算时, 不同的外在性质反应了不同的内部结构 各自内部的结合力不同
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 这是一个过于简单化的比喻,但它说明了一个重要的问题,通过减少开始这项工作所需要的 能量,酶使得这项困难的工作变容易了。就像钥匙只能适合于特殊钥匙孔的形状一样,酶在 活性部位具有只允许对某些分子起作用的特殊的结构。 2.1 化学键的定义 如果两个原子(或原子团)之间的作用力强得足以形成足够稳定的、可被化学家 看作独立分子物种的聚集体,它们之间就存在化学键.简单地说,化学键是指分 子内部原子之间的强相互作用力. 2.2 离子键理论及离子极化 2.2.1 离子键的形成 1916 年德国化学家 Kossel 根据稀有气体原子具有稳定结构的事实提出的。 从能量讲,一定有吸收或放出,新体系的能量一般也最低,。 形成的条件: -ne- nNa(3s1 ) —————→ nNa+ (2s2 2p6 ) 大小 电子转移 形成正离子 静引力 XA—XB>2.0 ——→ nNaCl +ne- 形成化学键 nCl(3s2 3p3 )—————→ nCl- (3s2 3p6 ) –450kJ·mol-1 E=-348.7 kJ·mol-1 形成负离子 V 总势能 = V 吸引 + V 排斥 = R P Ae q R q q / 0 4 − + − + − π R 较大时 R< R0时 2.2.2 离子键的特点 ●本质是静电引力 2 R q q f + − = 离子键的强度可以用晶格能(lattice energy)表示,指 1mol 的离子晶体解离为自由气 态离子时所吸收的能量,以 U 表示。 a.是正值,不是有些书写的负值。 注意 b.指 0K,101325Pa 下,298K,101325Pa 下为晶格焓相差很小,近似计算时, 不同的外在性质反应了不同的内部结构 各自内部的结合力不同
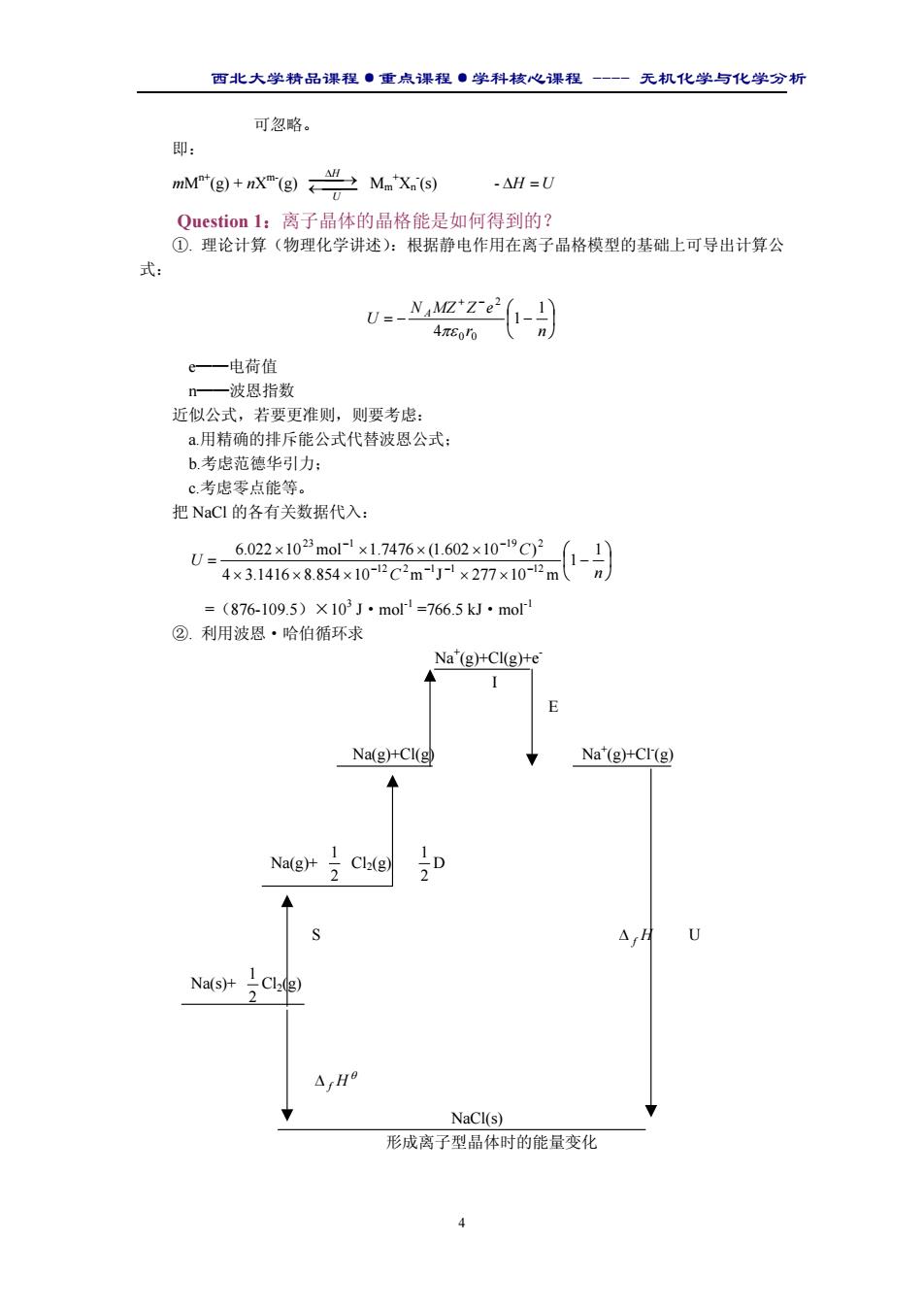
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 可忽略。 即: mMn+(g) + nXm-(g) ← ∆ → U H Mm + Xn - (s) - ∆H = U Question 1:离子晶体的晶格能是如何得到的? ①. 理论计算(物理化学讲述):根据静电作用在离子晶格模型的基础上可导出计算公 式: = − − + − r n N MZ Z e U A 1 1 4 0 0 2 πε e——电荷值 n——波恩指数 近似公式,若要更准则,则要考虑: a.用精确的排斥能公式代替波恩公式; b.考虑范德华引力; c.考虑零点能等。 把 NaCl 的各有关数据代入: − × × × × × × × × × = − − − − − − C n C U 1 1 4 3.1416 8.854 10 m J 277 10 m 6.022 10 mol 1.7476 (1.602 10 ) 12 2 1 1 12 23 1 19 2 =(876-109.5)×103 J·mol-1 =766.5 kJ·mol-1 ②. 利用波恩·哈伯循环求 Na+ (g)+Cl(g)+e- I E Na(g)+Cl(g) Na+ (g)+Cl- (g) Na(g)+ 2 1 Cl2(g) 2 1 D S ∆ f H U Na(s)+ 2 1 Cl2(g) θ ∆ f H NaCl(s) 形成离子型晶体时的能量变化
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 可忽略。 即: mMn+(g) + nXm-(g) ← ∆ → U H Mm + Xn - (s) - ∆H = U Question 1:离子晶体的晶格能是如何得到的? ①. 理论计算(物理化学讲述):根据静电作用在离子晶格模型的基础上可导出计算公 式: = − − + − r n N MZ Z e U A 1 1 4 0 0 2 πε e——电荷值 n——波恩指数 近似公式,若要更准则,则要考虑: a.用精确的排斥能公式代替波恩公式; b.考虑范德华引力; c.考虑零点能等。 把 NaCl 的各有关数据代入: − × × × × × × × × × = − − − − − − C n C U 1 1 4 3.1416 8.854 10 m J 277 10 m 6.022 10 mol 1.7476 (1.602 10 ) 12 2 1 1 12 23 1 19 2 =(876-109.5)×103 J·mol-1 =766.5 kJ·mol-1 ②. 利用波恩·哈伯循环求 Na+ (g)+Cl(g)+e- I E Na(g)+Cl(g) Na+ (g)+Cl- (g) Na(g)+ 2 1 Cl2(g) 2 1 D S ∆ f H U Na(s)+ 2 1 Cl2(g) θ ∆ f H NaCl(s) 形成离子型晶体时的能量变化

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 ( ) ( ) 2 θ 1 ∆f H = S + D + I + −E + −U ∴ U = −∆ H S + D + I − E 2 θ 1 f 以 NaCl 为例: U = [-(-411)+09+121+496-349] kJ· mol-1 =788 kJ·mol-1 如果再者的结果相当接近,说明离子键理论基本上是正确的。 ③.水合能循环法(上边的常常缺少 E 和晶体结构参数) 盖斯定律 始态 NaCl(s) → −U Na+ (g) + Cl- (g) ∆Hsol 溶解热 h(Na ) ∆H + h(Cl ) ∆H − 绝对水合能 Na+ (aq) + Cl- (aq) 终态 则 sol h(Na ) h(Cl ) U = ∆H + + ∆H − − ∆H =(-443.9)+(-340.6)-3.8 =788.3 kJ·mol-1 Question 2:离子键的键能(焓)和晶格能(焓)的含义是否相同? 不同。 298K,101325Pa Na(g) ∆ →E1 Na+ (g) ∆ →E3 NaCl(g) ∆ →E4 NaCl(s) Cl(g) ∆ →E2 Cl- (g) 则 键焓= ∆E1 + ∆E2 + ∆E3 晶格焓= ∆E3 + ∆E4 (由于离子型晶体稳定,分子只有在极高的强度下存在,因此键焓用处不大。) 影响 U 大小主要是电荷和 r0(P31 表 2.1) ●没有方向性和饱和性(P36) 结构化学还可计算,但不属本课程内容。 ●键的离子性与元素的电负性有关 单键的离子性能百分数与电负性差值之间的关系 XA-XB 离子性百分比/% XA-XB 离子性百分比/%
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 ( ) ( ) 2 θ 1 ∆f H = S + D + I + −E + −U ∴ U = −∆ H S + D + I − E 2 θ 1 f 以 NaCl 为例: U = [-(-411)+09+121+496-349] kJ· mol-1 =788 kJ·mol-1 如果再者的结果相当接近,说明离子键理论基本上是正确的。 ③.水合能循环法(上边的常常缺少 E 和晶体结构参数) 盖斯定律 始态 NaCl(s) → −U Na+ (g) + Cl- (g) ∆Hsol 溶解热 h(Na ) ∆H + h(Cl ) ∆H − 绝对水合能 Na+ (aq) + Cl- (aq) 终态 则 sol h(Na ) h(Cl ) U = ∆H + + ∆H − − ∆H =(-443.9)+(-340.6)-3.8 =788.3 kJ·mol-1 Question 2:离子键的键能(焓)和晶格能(焓)的含义是否相同? 不同。 298K,101325Pa Na(g) ∆ →E1 Na+ (g) ∆ →E3 NaCl(g) ∆ →E4 NaCl(s) Cl(g) ∆ →E2 Cl- (g) 则 键焓= ∆E1 + ∆E2 + ∆E3 晶格焓= ∆E3 + ∆E4 (由于离子型晶体稳定,分子只有在极高的强度下存在,因此键焓用处不大。) 影响 U 大小主要是电荷和 r0(P31 表 2.1) ●没有方向性和饱和性(P36) 结构化学还可计算,但不属本课程内容。 ●键的离子性与元素的电负性有关 单键的离子性能百分数与电负性差值之间的关系 XA-XB 离子性百分比/% XA-XB 离子性百分比/%
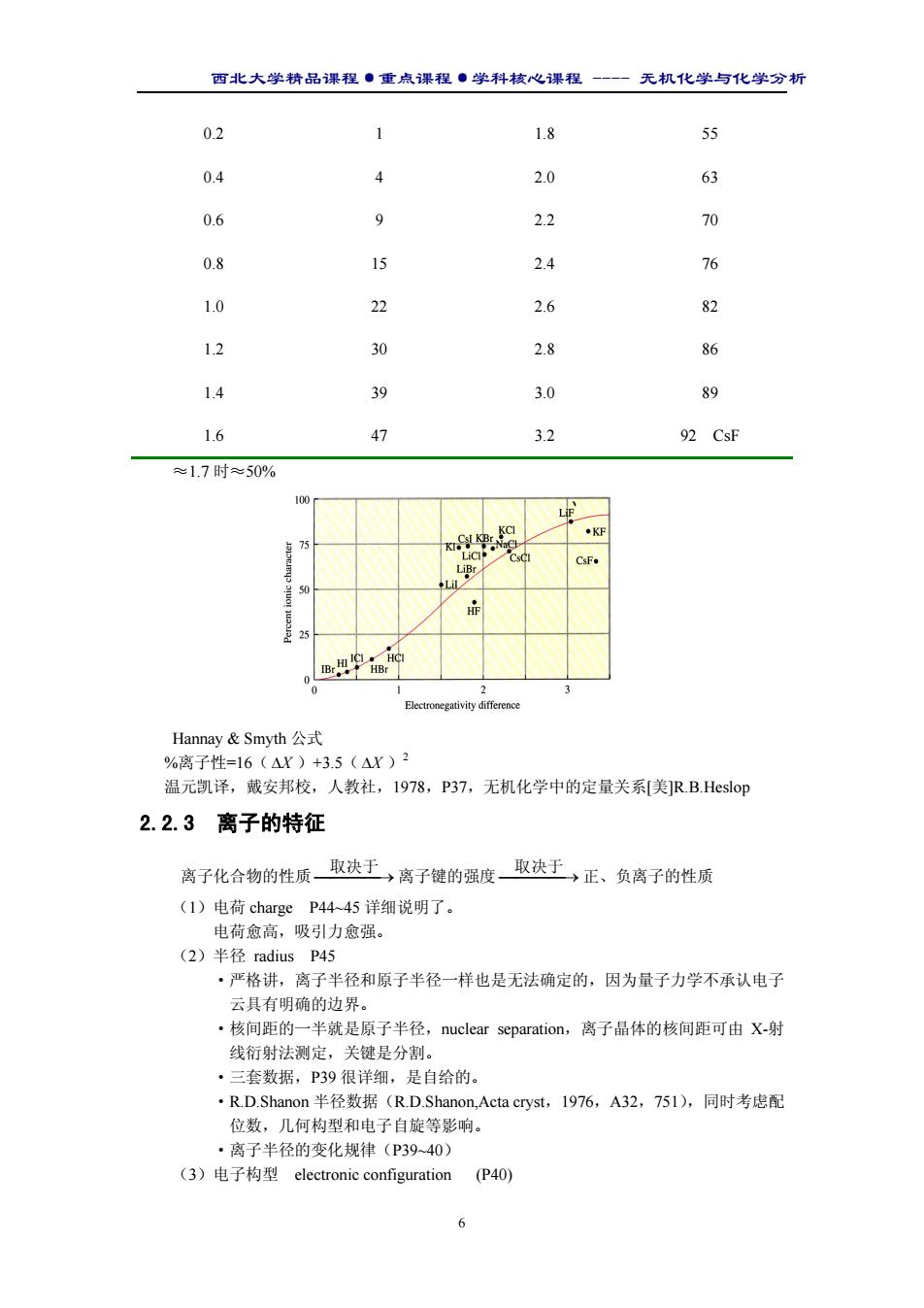
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 0.2 1 1.8 55 0.4 4 2.0 63 0.6 9 2.2 70 0.8 15 2.4 76 1.0 22 2.6 82 1.2 30 2.8 86 1.4 39 3.0 89 1.6 47 3.2 92 CsF ≈1.7 时≈50% Hannay & Smyth 公式 %离子性=16( ∆X )+3.5( ∆X )2 温元凯译,戴安邦校,人教社,1978,P37,无机化学中的定量关系[美]R.B.Heslop 2.2.3 离子的特征 离子化合物的性质 → 取决于 离子键的强度 → 取决于 正、负离子的性质 (1)电荷 charge P44~45 详细说明了。 电荷愈高,吸引力愈强。 (2)半径 radius P45 ·严格讲,离子半径和原子半径一样也是无法确定的,因为量子力学不承认电子 云具有明确的边界。 ·核间距的一半就是原子半径,nuclear separation,离子晶体的核间距可由 X-射 线衍射法测定,关键是分割。 ·三套数据,P39 很详细,是自给的。 ·R.D.Shanon 半径数据(R.D.Shanon,Acta cryst,1976,A32,751),同时考虑配 位数,几何构型和电子自旋等影响。 ·离子半径的变化规律(P39~40) (3)电子构型 electronic configuration (P40)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 0.2 1 1.8 55 0.4 4 2.0 63 0.6 9 2.2 70 0.8 15 2.4 76 1.0 22 2.6 82 1.2 30 2.8 86 1.4 39 3.0 89 1.6 47 3.2 92 CsF ≈1.7 时≈50% Hannay & Smyth 公式 %离子性=16( ∆X )+3.5( ∆X )2 温元凯译,戴安邦校,人教社,1978,P37,无机化学中的定量关系[美]R.B.Heslop 2.2.3 离子的特征 离子化合物的性质 → 取决于 离子键的强度 → 取决于 正、负离子的性质 (1)电荷 charge P44~45 详细说明了。 电荷愈高,吸引力愈强。 (2)半径 radius P45 ·严格讲,离子半径和原子半径一样也是无法确定的,因为量子力学不承认电子 云具有明确的边界。 ·核间距的一半就是原子半径,nuclear separation,离子晶体的核间距可由 X-射 线衍射法测定,关键是分割。 ·三套数据,P39 很详细,是自给的。 ·R.D.Shanon 半径数据(R.D.Shanon,Acta cryst,1976,A32,751),同时考虑配 位数,几何构型和电子自旋等影响。 ·离子半径的变化规律(P39~40) (3)电子构型 electronic configuration (P40)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 正离子随元素在周期表的不同位置而不同。 a. 8 电子和 2 电子构型(稀有气体构型) b. 18 电子构型(拟稀有气体构型)11~14 例 c. 18 +2 电子构型(含惰性电子对的构型)13~15 保留 s 电子 d. 不规则构型(9~17 电子构型) 2.3 共价键理论 2.3.1 电子对键的相关概念(P47~48) 1916 年 Lewis G N 提出 • 共享电子对——共价键(covalent bond) 键级 bond order 共价单键 single covalent bond 键数 bond number 共价双键 double covalent bond 共价叁键 triple covalent bond 两个原子间最多是三重键 • 配位共价键(由键合的一方原子提供电子对) coordinate covalent bond coordination 给予体原子 donor atom 接受体原子 acceptor atom 非极性共价键 non polar covalent bond 极性共价键 polar covalent bond + δ 和 − δ 解释 电负性原子 electronegative atom 电正性原子 electropositive atom 2.3.2 路易斯结构式(P48-49) ●基本书写步骤(P42) 例 2.1, 2.2 ●原子的形式电荷(formal charge) 形式电荷=(该原子的价电子数)-(孤对中的电子数)-(共用电子数/2) 目的:选择能量低的路易斯结构式: 例:指出下列化合物合理的结构是哪一种?不合理结构错在哪里? . . . . . . . . . . a. N2O N = N = O : N — N ≡ O : : N ≡ N — O : . . . . . . . . . . 不稳定,O 的电负性比 N 大,这样的对称结构 有可能使电趋向 O 原子, 势能高,不稳定 . . . . . . . . . . • 不稳定,O 的电负性比 N 大,这样的对称结构有 可能趋向 O 原子,势能 高,不稳定 同左 较稳定,合理
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 正离子随元素在周期表的不同位置而不同。 a. 8 电子和 2 电子构型(稀有气体构型) b. 18 电子构型(拟稀有气体构型)11~14 例 c. 18 +2 电子构型(含惰性电子对的构型)13~15 保留 s 电子 d. 不规则构型(9~17 电子构型) 2.3 共价键理论 2.3.1 电子对键的相关概念(P47~48) 1916 年 Lewis G N 提出 • 共享电子对——共价键(covalent bond) 键级 bond order 共价单键 single covalent bond 键数 bond number 共价双键 double covalent bond 共价叁键 triple covalent bond 两个原子间最多是三重键 • 配位共价键(由键合的一方原子提供电子对) coordinate covalent bond coordination 给予体原子 donor atom 接受体原子 acceptor atom 非极性共价键 non polar covalent bond 极性共价键 polar covalent bond + δ 和 − δ 解释 电负性原子 electronegative atom 电正性原子 electropositive atom 2.3.2 路易斯结构式(P48-49) ●基本书写步骤(P42) 例 2.1, 2.2 ●原子的形式电荷(formal charge) 形式电荷=(该原子的价电子数)-(孤对中的电子数)-(共用电子数/2) 目的:选择能量低的路易斯结构式: 例:指出下列化合物合理的结构是哪一种?不合理结构错在哪里? . . . . . . . . . . a. N2O N = N = O : N — N ≡ O : : N ≡ N — O : . . . . . . . . . . 不稳定,O 的电负性比 N 大,这样的对称结构 有可能使电趋向 O 原子, 势能高,不稳定 . . . . . . . . . . • 不稳定,O 的电负性比 N 大,这样的对称结构有 可能趋向 O 原子,势能 高,不稳定 同左 较稳定,合理

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 b. N — N = O : : N = N = O : : N = N = O : . . . . 左边的 N 原子不满 8 电子 同右 c. . . . . . . . . . . N = N = O : N — N ≡ O : : N ≡ N — O : . . . . . . . . N 左 -1[5-4-(4/2)] N 左 -2[5-6-(2/2)] N 左 0[5-2-(6/2)] N 中 -1[5-2-(8/2)] N 中 1[5-0-(8/2)] N 中 1[5-0-(8/2)] O 0[6-4-(4/2)] O 1[6-2-(6/2)] O -1[6-6-(2/2)] d. . . . . . . . . . . N — N = O : N = N = O : : N = N = O : . . . . . . N 左 0[5-4-(2/2)] N 左 1[5-2-(4/2)] N 左 1[5-2-(4/2)] N 中 0[5-2-(6/2)] N 中 1[5-0-(8/2)] N 中 1[5-0-(8/2)] O 0[6-4-(4/2 )] O 0[6-4-(4/2)] O -2[6-6-(4/2)] 局限性(P43) 问题的提出:Lewis 结构式只能给出分子中原子的单向排布,而不能给出其分子空间结 构排布。 2.4 VSEPR 法(Valence shell electron pair repulsion) (1).主要内容 孤—孤>孤—成>成—成 共价分子(或离子)中中心原子的价层电子对(包括键电子对和孤对电子对)由于静 电排斥作用而趋向尽可能彼此远离,使分子尽可能采取对称结构。 ①ABn 型分子,没有孤对电子时,其空间构型为 P45 表 2.6 所列和 P46 图 2.3。 ②若有孤对电子,则先依“标准形状”推演出“基本形状”,再考虑孤电子对键电 子对的排斥力往往使 BAB 键角压缩。 ③排斥力大小:(占据的空间大)三键-三键>三键-双键>双键-双键>双键-单键 >单-单 孤-孤>孤-键>键-键 这是因为键对电子受两个核而孤对电子只受一个核控制的原因,使后者比前者离 核更近些,常显“胖些”。 (2)价层电子对的总数和孤对数目推算公式(P47) 价层中电子对总数(VP)= 键对的数目(BP)+孤对的数目(LP) =与中心原子成键的原子数+ 2 (中心原子价电子数 − 配位原子未成对电子数之和) 见 P47 表 2.8 例题。图空(电子对分布图) 判断分子几何形状的几个附加说明(P45:1、2、3) 左边 N 未达 8 电 子,O 大于 8,不
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 b. N — N = O : : N = N = O : : N = N = O : . . . . 左边的 N 原子不满 8 电子 同右 c. . . . . . . . . . . N = N = O : N — N ≡ O : : N ≡ N — O : . . . . . . . . N 左 -1[5-4-(4/2)] N 左 -2[5-6-(2/2)] N 左 0[5-2-(6/2)] N 中 -1[5-2-(8/2)] N 中 1[5-0-(8/2)] N 中 1[5-0-(8/2)] O 0[6-4-(4/2)] O 1[6-2-(6/2)] O -1[6-6-(2/2)] d. . . . . . . . . . . N — N = O : N = N = O : : N = N = O : . . . . . . N 左 0[5-4-(2/2)] N 左 1[5-2-(4/2)] N 左 1[5-2-(4/2)] N 中 0[5-2-(6/2)] N 中 1[5-0-(8/2)] N 中 1[5-0-(8/2)] O 0[6-4-(4/2 )] O 0[6-4-(4/2)] O -2[6-6-(4/2)] 局限性(P43) 问题的提出:Lewis 结构式只能给出分子中原子的单向排布,而不能给出其分子空间结 构排布。 2.4 VSEPR 法(Valence shell electron pair repulsion) (1).主要内容 孤—孤>孤—成>成—成 共价分子(或离子)中中心原子的价层电子对(包括键电子对和孤对电子对)由于静 电排斥作用而趋向尽可能彼此远离,使分子尽可能采取对称结构。 ①ABn 型分子,没有孤对电子时,其空间构型为 P45 表 2.6 所列和 P46 图 2.3。 ②若有孤对电子,则先依“标准形状”推演出“基本形状”,再考虑孤电子对键电 子对的排斥力往往使 BAB 键角压缩。 ③排斥力大小:(占据的空间大)三键-三键>三键-双键>双键-双键>双键-单键 >单-单 孤-孤>孤-键>键-键 这是因为键对电子受两个核而孤对电子只受一个核控制的原因,使后者比前者离 核更近些,常显“胖些”。 (2)价层电子对的总数和孤对数目推算公式(P47) 价层中电子对总数(VP)= 键对的数目(BP)+孤对的数目(LP) =与中心原子成键的原子数+ 2 (中心原子价电子数 − 配位原子未成对电子数之和) 见 P47 表 2.8 例题。图空(电子对分布图) 判断分子几何形状的几个附加说明(P45:1、2、3) 左边 N 未达 8 电 子,O 大于 8,不
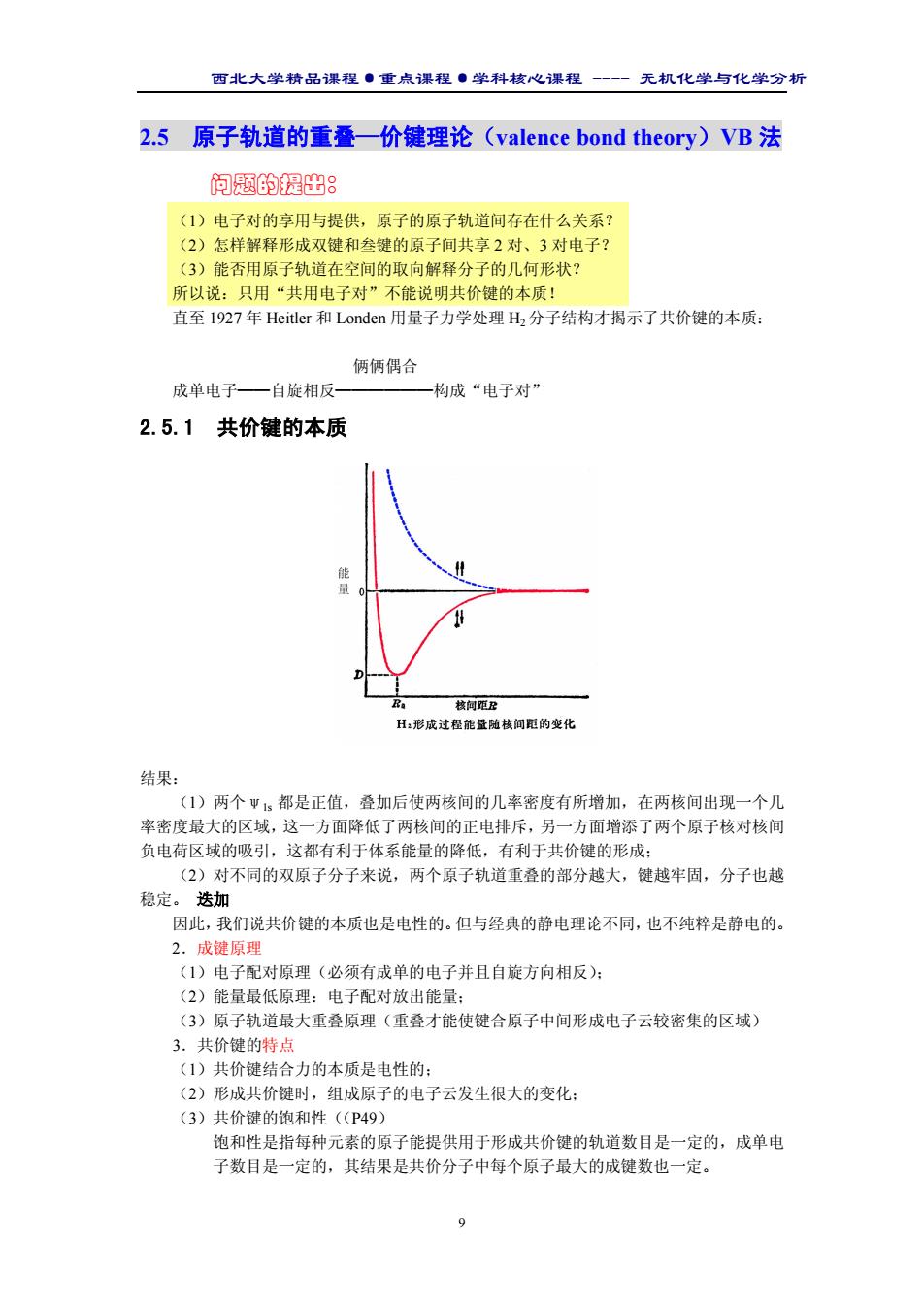
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 2.5 原子轨道的重叠—价键理论(valence bond theory)VB 法 问题的提出: (1)电子对的享用与提供,原子的原子轨道间存在什么关系? (2)怎样解释形成双键和叁键的原子间共享 2 对、3 对电子? (3)能否用原子轨道在空间的取向解释分子的几何形状? 所以说:只用“共用电子对”不能说明共价键的本质! 直至 1927 年 Heitler 和 Londen 用量子力学处理 H2 分子结构才揭示了共价键的本质: 俩俩偶合 成单电子——自旋相反——————构成“电子对” 2.5.1 共价键的本质 结果: (1)两个ψ1s 都是正值,叠加后使两核间的几率密度有所增加,在两核间出现一个几 率密度最大的区域,这一方面降低了两核间的正电排斥,另一方面增添了两个原子核对核间 负电荷区域的吸引,这都有利于体系能量的降低,有利于共价键的形成; (2)对不同的双原子分子来说,两个原子轨道重叠的部分越大,键越牢固,分子也越 稳定。 迭加 因此,我们说共价键的本质也是电性的。但与经典的静电理论不同,也不纯粹是静电的。 2.成键原理 (1)电子配对原理(必须有成单的电子并且自旋方向相反); (2)能量最低原理:电子配对放出能量; (3)原子轨道最大重叠原理(重叠才能使键合原子中间形成电子云较密集的区域) 3.共价键的特点 (1)共价键结合力的本质是电性的; (2)形成共价键时,组成原子的电子云发生很大的变化; (3)共价键的饱和性((P49) 饱和性是指每种元素的原子能提供用于形成共价键的轨道数目是一定的,成单电 子数目是一定的,其结果是共价分子中每个原子最大的成键数也一定
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 2.5 原子轨道的重叠—价键理论(valence bond theory)VB 法 问题的提出: (1)电子对的享用与提供,原子的原子轨道间存在什么关系? (2)怎样解释形成双键和叁键的原子间共享 2 对、3 对电子? (3)能否用原子轨道在空间的取向解释分子的几何形状? 所以说:只用“共用电子对”不能说明共价键的本质! 直至 1927 年 Heitler 和 Londen 用量子力学处理 H2 分子结构才揭示了共价键的本质: 俩俩偶合 成单电子——自旋相反——————构成“电子对” 2.5.1 共价键的本质 结果: (1)两个ψ1s 都是正值,叠加后使两核间的几率密度有所增加,在两核间出现一个几 率密度最大的区域,这一方面降低了两核间的正电排斥,另一方面增添了两个原子核对核间 负电荷区域的吸引,这都有利于体系能量的降低,有利于共价键的形成; (2)对不同的双原子分子来说,两个原子轨道重叠的部分越大,键越牢固,分子也越 稳定。 迭加 因此,我们说共价键的本质也是电性的。但与经典的静电理论不同,也不纯粹是静电的。 2.成键原理 (1)电子配对原理(必须有成单的电子并且自旋方向相反); (2)能量最低原理:电子配对放出能量; (3)原子轨道最大重叠原理(重叠才能使键合原子中间形成电子云较密集的区域) 3.共价键的特点 (1)共价键结合力的本质是电性的; (2)形成共价键时,组成原子的电子云发生很大的变化; (3)共价键的饱和性((P49) 饱和性是指每种元素的原子能提供用于形成共价键的轨道数目是一定的,成单电 子数目是一定的,其结果是共价分子中每个原子最大的成键数也一定

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 (4)共价键的方向性 所谓方向性是指共价分子中一个原子与周围原子形成共价键有一定的角度。原因 是因为原子轨道(p、d、f)有一定的方向性,它和相邻原子的轨道重叠成键要满足最大重 叠条件。 共价键的方向性决定着分子的空间构型,因而影响分子的性质(如极性等)。 氯化氢分子的成键示意图 H2S 分子的形成示意图 (5)共价键的键型 由于原子轨道重叠的方式不同,可以形成不同类型的共价键: σ键:“头碰头”,重叠轨道的电子云沿键轴方向的投影为圆形,P50 图 2.6(d)电子云 密度绕键轴对称。 π键:“肩并肩”,重叠轨道的电子云密度绕键轴不完全对称。 σ键与π键比较 名称 成键方式 键能大小 反应性大小 σ键 “头碰头” 大 小 π键 “肩并肩” 小 大 另外还有δ键:通过键轴有两个ψ为 0 的节面,见后。 这样我们就解决了本节提出的 3 个问题。 2.5.2 杂化轨道理论 hybrid orbital theory 问题的提出: 上面可以看到价键理论的 VB 法比较简明地阐述共价键的形成过程、本质、特点,但在 解释共价分子的空间结构方面遇到了一些困难: (1)CH4 是四面体结构,1s2 2s2 2px1 2py1 2pz0 不能解释形成 4 个键,而且是等同的。 (2)H2O(104.5°)、H2S(92°)、NH3 (107°)、PH3 (93.5°)、AsH3(92°)、SbH3(91.5 °) 为什么不是 90°? 1931 年 Pauling 提出“杂化轨道理论”(Pauling.L,J.A.C.S,1931,53:1367) 后 Slater .J.C., Phys.Rev., 1931,37:48 他们认为:成键时放出的能量一部分用来补偿激发过程耗去的能量,使 s、p 轨道“杂 化”,形成一种适于成键的“杂化轨道”——混合轨道。 我国的唐敖庆教授在 s-p-d-f 轨道杂化上作出了贡献,中国化学会志,1950,17:25; 1951,18:15;1951,18:18,(包括我系孙聚昌教授的工作) 为了使上述假设发展成为可以令人信服的理论,首先必须解决三个问题: (1)原子轨道为什么可以杂化?即可能性 (2)原子轨道为什么需要杂化?即必要性 (3)如何求得杂化轨道的对称轴间的夹角,并从而解释分子的几何构型问题
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 (4)共价键的方向性 所谓方向性是指共价分子中一个原子与周围原子形成共价键有一定的角度。原因 是因为原子轨道(p、d、f)有一定的方向性,它和相邻原子的轨道重叠成键要满足最大重 叠条件。 共价键的方向性决定着分子的空间构型,因而影响分子的性质(如极性等)。 氯化氢分子的成键示意图 H2S 分子的形成示意图 (5)共价键的键型 由于原子轨道重叠的方式不同,可以形成不同类型的共价键: σ键:“头碰头”,重叠轨道的电子云沿键轴方向的投影为圆形,P50 图 2.6(d)电子云 密度绕键轴对称。 π键:“肩并肩”,重叠轨道的电子云密度绕键轴不完全对称。 σ键与π键比较 名称 成键方式 键能大小 反应性大小 σ键 “头碰头” 大 小 π键 “肩并肩” 小 大 另外还有δ键:通过键轴有两个ψ为 0 的节面,见后。 这样我们就解决了本节提出的 3 个问题。 2.5.2 杂化轨道理论 hybrid orbital theory 问题的提出: 上面可以看到价键理论的 VB 法比较简明地阐述共价键的形成过程、本质、特点,但在 解释共价分子的空间结构方面遇到了一些困难: (1)CH4 是四面体结构,1s2 2s2 2px1 2py1 2pz0 不能解释形成 4 个键,而且是等同的。 (2)H2O(104.5°)、H2S(92°)、NH3 (107°)、PH3 (93.5°)、AsH3(92°)、SbH3(91.5 °) 为什么不是 90°? 1931 年 Pauling 提出“杂化轨道理论”(Pauling.L,J.A.C.S,1931,53:1367) 后 Slater .J.C., Phys.Rev., 1931,37:48 他们认为:成键时放出的能量一部分用来补偿激发过程耗去的能量,使 s、p 轨道“杂 化”,形成一种适于成键的“杂化轨道”——混合轨道。 我国的唐敖庆教授在 s-p-d-f 轨道杂化上作出了贡献,中国化学会志,1950,17:25; 1951,18:15;1951,18:18,(包括我系孙聚昌教授的工作) 为了使上述假设发展成为可以令人信服的理论,首先必须解决三个问题: (1)原子轨道为什么可以杂化?即可能性 (2)原子轨道为什么需要杂化?即必要性 (3)如何求得杂化轨道的对称轴间的夹角,并从而解释分子的几何构型问题