
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Chapter 10 Conditional stability constant and complexometric titration 教学要求 1. 了解分析化学中 EDTA 及其螯合物的分析特性; 2. 掌握络合平衡的副反应系数和条件稳定常数的计算; 3. 了解金属离子指示剂的作用原理、指示剂的选择原则及常用的金属离子指示剂 的使用条件; 4. 熟悉络合滴定曲线、化学计量点和滴定突跃; 5. 了解络合滴定的应用及计算。 课时分配(8 学时) 1. EDTA:络合滴定最重要的滴定剂,条件稳定常数(3 学时) 逐级稳定常数,不稳定常数,累积稳定常数,副反应系数,酸效应和酸效应系数, 条件稳定常数 2. 络合滴定原理,滴定干扰的消除 (3 学时) 金属指示剂,络合滴定曲线,突跃,滴定干扰及消除,掩蔽和络合掩蔽剂 3. 络合滴定方式 (2 学时) 返滴定,置换滴定 以络合剂与金属离子间的络合物形成反应为基础的滴定叫络合滴定(complexometric titration or complexometry)。沉淀滴定和络合滴定都看作是酸碱滴定, 即广义酸和广义碱之 间的滴定。 10.1 EDTA:络合滴定最重要的滴定剂 EDTA是乙二胺四乙酸(ethylenediamine tetraacetic acid)的英文缩写,通常用H4Y代表其化 学式。H4Y 本身在水中的溶解度不大(295K 时, 每 100g 水中 溶解 0.02 g), 作为滴定剂常用其二钠盐 Na2H2Y·2H2O(295K 时, 每 100g 水中溶解 11.1 g)。图 10.1 给出了 EDTA 负四价 阴离子(Y4-)的结构, 它以其 2 个氨基氮原子和 4 个羧基氧原 Figure 10.1 The anion of EDTA 第10章 条件稳定常数和络 合滴定
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 Chapter 10 Conditional stability constant and complexometric titration 教学要求 1. 了解分析化学中 EDTA 及其螯合物的分析特性; 2. 掌握络合平衡的副反应系数和条件稳定常数的计算; 3. 了解金属离子指示剂的作用原理、指示剂的选择原则及常用的金属离子指示剂 的使用条件; 4. 熟悉络合滴定曲线、化学计量点和滴定突跃; 5. 了解络合滴定的应用及计算。 课时分配(8 学时) 1. EDTA:络合滴定最重要的滴定剂,条件稳定常数(3 学时) 逐级稳定常数,不稳定常数,累积稳定常数,副反应系数,酸效应和酸效应系数, 条件稳定常数 2. 络合滴定原理,滴定干扰的消除 (3 学时) 金属指示剂,络合滴定曲线,突跃,滴定干扰及消除,掩蔽和络合掩蔽剂 3. 络合滴定方式 (2 学时) 返滴定,置换滴定 以络合剂与金属离子间的络合物形成反应为基础的滴定叫络合滴定(complexometric titration or complexometry)。沉淀滴定和络合滴定都看作是酸碱滴定, 即广义酸和广义碱之 间的滴定。 10.1 EDTA:络合滴定最重要的滴定剂 EDTA是乙二胺四乙酸(ethylenediamine tetraacetic acid)的英文缩写,通常用H4Y代表其化 学式。H4Y 本身在水中的溶解度不大(295K 时, 每 100g 水中 溶解 0.02 g), 作为滴定剂常用其二钠盐 Na2H2Y·2H2O(295K 时, 每 100g 水中溶解 11.1 g)。图 10.1 给出了 EDTA 负四价 阴离子(Y4-)的结构, 它以其 2 个氨基氮原子和 4 个羧基氧原 Figure 10.1 The anion of EDTA 第10章 条件稳定常数和络 合滴定
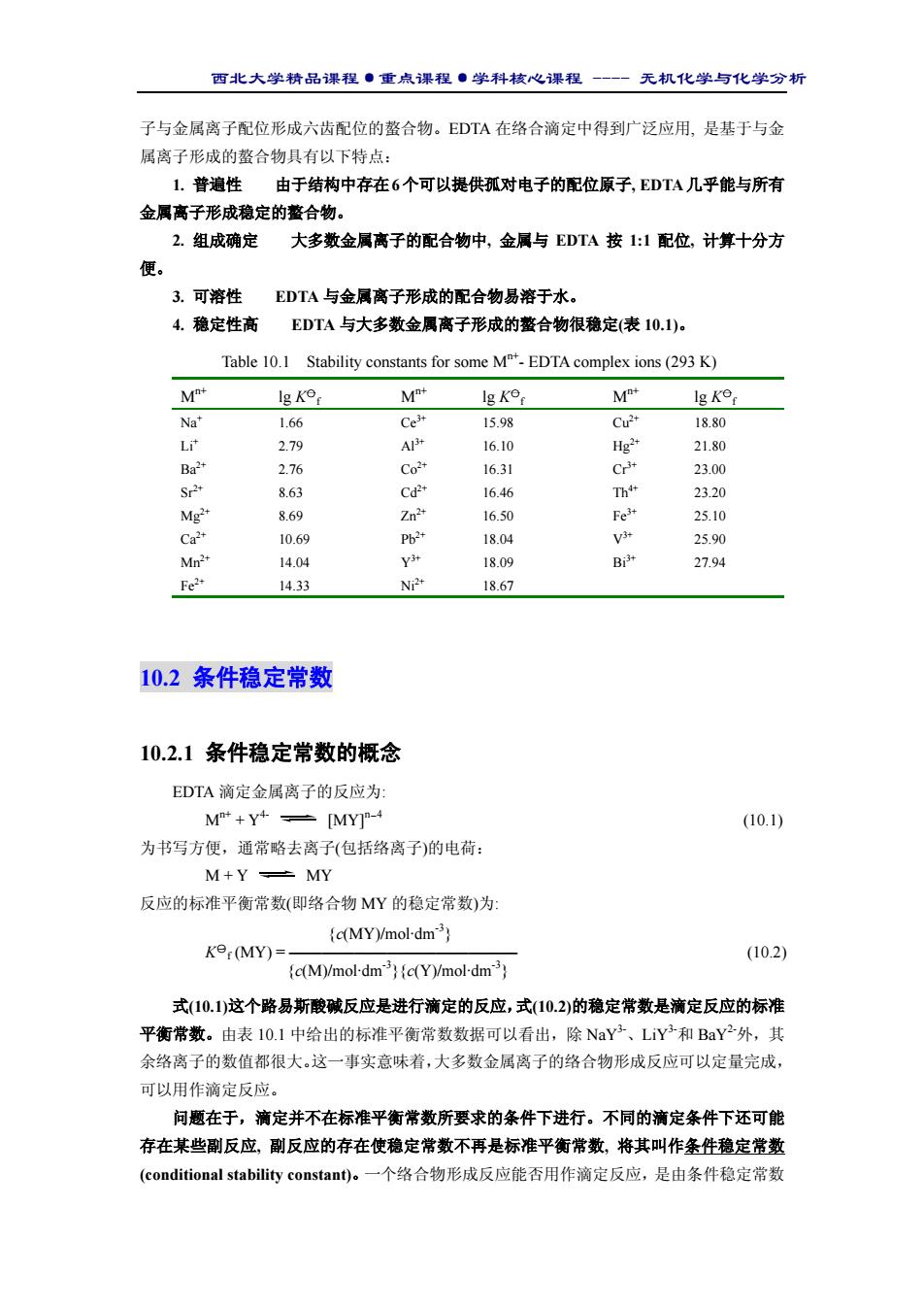
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 子与金属离子配位形成六齿配位的螯合物。EDTA 在络合滴定中得到广泛应用, 是基于与金 属离子形成的螯合物具有以下特点: 1. 普遍性 由于结构中存在6个可以提供孤对电子的配位原子, EDTA几乎能与所有 金属离子形成稳定的螯合物。 2. 组成确定 大多数金属离子的配合物中, 金属与 EDTA 按 1:1 配位, 计算十分方 便。 3. 可溶性 EDTA 与金属离子形成的配合物易溶于水。 4. 稳定性高 EDTA 与大多数金属离子形成的螯合物很稳定(表 10.1)。 Table 10.1 Stability constants for some Mn+- EDTA complex ions (293 K) Mn+ lg K○一f Mn+ lg K○一f Mn+ lg K○一f Na+ Li+ Ba2+ Sr2+ Mg2+ Ca2+ Mn2+ Fe2+ 1.66 2.79 2.76 8.63 8.69 10.69 14.04 14.33 Ce3+ Al3+ Co2+ Cd2+ Zn2+ Pb2+ Y3+ Ni2+ 15.98 16.10 16.31 16.46 16.50 18.04 18.09 18.67 Cu2+ Hg2+ Cr3+ Th4+ Fe3+ V3+ Bi3+ 18.80 21.80 23.00 23.20 25.10 25.90 27.94 10.2 条件稳定常数 10.2.1 条件稳定常数的概念 EDTA 滴定金属离子的反应为: Mn+ + Y4- [MY]n-4 (10.1) 为书写方便,通常略去离子(包括络离子)的电荷: M + Y MY 反应的标准平衡常数(即络合物 MY 的稳定常数)为: {c(MY)/mol·dm-3} K○一 f (MY) = —————————————— (10.2) {c(M)/mol·dm-3}{c(Y)/mol·dm-3} 式(10.1)这个路易斯酸碱反应是进行滴定的反应,式(10.2)的稳定常数是滴定反应的标准 平衡常数。由表 10.1 中给出的标准平衡常数数据可以看出,除 NaY3-、LiY3-和 BaY2-外,其 余络离子的数值都很大。这一事实意味着,大多数金属离子的络合物形成反应可以定量完成, 可以用作滴定反应。 问题在于,滴定并不在标准平衡常数所要求的条件下进行。不同的滴定条件下还可能 存在某些副反应, 副反应的存在使稳定常数不再是标准平衡常数, 将其叫作条件稳定常数 (conditional stability constant)。一个络合物形成反应能否用作滴定反应,是由条件稳定常数
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 子与金属离子配位形成六齿配位的螯合物。EDTA 在络合滴定中得到广泛应用, 是基于与金 属离子形成的螯合物具有以下特点: 1. 普遍性 由于结构中存在6个可以提供孤对电子的配位原子, EDTA几乎能与所有 金属离子形成稳定的螯合物。 2. 组成确定 大多数金属离子的配合物中, 金属与 EDTA 按 1:1 配位, 计算十分方 便。 3. 可溶性 EDTA 与金属离子形成的配合物易溶于水。 4. 稳定性高 EDTA 与大多数金属离子形成的螯合物很稳定(表 10.1)。 Table 10.1 Stability constants for some Mn+- EDTA complex ions (293 K) Mn+ lg K○一f Mn+ lg K○一f Mn+ lg K○一f Na+ Li+ Ba2+ Sr2+ Mg2+ Ca2+ Mn2+ Fe2+ 1.66 2.79 2.76 8.63 8.69 10.69 14.04 14.33 Ce3+ Al3+ Co2+ Cd2+ Zn2+ Pb2+ Y3+ Ni2+ 15.98 16.10 16.31 16.46 16.50 18.04 18.09 18.67 Cu2+ Hg2+ Cr3+ Th4+ Fe3+ V3+ Bi3+ 18.80 21.80 23.00 23.20 25.10 25.90 27.94 10.2 条件稳定常数 10.2.1 条件稳定常数的概念 EDTA 滴定金属离子的反应为: Mn+ + Y4- [MY]n-4 (10.1) 为书写方便,通常略去离子(包括络离子)的电荷: M + Y MY 反应的标准平衡常数(即络合物 MY 的稳定常数)为: {c(MY)/mol·dm-3} K○一 f (MY) = —————————————— (10.2) {c(M)/mol·dm-3}{c(Y)/mol·dm-3} 式(10.1)这个路易斯酸碱反应是进行滴定的反应,式(10.2)的稳定常数是滴定反应的标准 平衡常数。由表 10.1 中给出的标准平衡常数数据可以看出,除 NaY3-、LiY3-和 BaY2-外,其 余络离子的数值都很大。这一事实意味着,大多数金属离子的络合物形成反应可以定量完成, 可以用作滴定反应。 问题在于,滴定并不在标准平衡常数所要求的条件下进行。不同的滴定条件下还可能 存在某些副反应, 副反应的存在使稳定常数不再是标准平衡常数, 将其叫作条件稳定常数 (conditional stability constant)。一个络合物形成反应能否用作滴定反应,是由条件稳定常数
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 决定的。溶液酸度是影响滴定的最重要的条件, 本章只介绍不同酸度条件下的条件稳定常 数。 10.2.2 EDTA 的酸效应 1. EDTA 的离解平衡 EDTA(H4Y)在高酸度溶液中以 H6Y2+的形式存在, 多出的两个 质子分别键合于两个氨基 N 原子上(注意, N 原子上有孤对电子)。六元酸 H6Y2+在水溶液中 存在六级电离平衡: H6Y2+(aq) + H2O(l) H3O+ + H5Y+ (aq) H5Y+ (aq) + H2O(l) H3O+ + H4Y(aq) H4Y(aq) + H2O(l) H3O+ + H3Y- (aq) H3Y- (aq) + H2O(l) H3O+ + H2Y2-(aq) H2Y2-(aq) + H2O(l) H3O+ + HY3-(aq) HY3-(aq) + H2O(l) H3O+ + Y4-(aq) K○一 1 = 10-0.9 K○一 2 = 10-1.6 K○一 3 = 10-2.07 K○一 4 = 10-2.75 K○一 5 = 10-6.42 K○一 6 = 10-10.34 上述电离平衡表明, EDTA 在水溶液中总是以 H6Y2+,H5Y+ ,H4Y,H3Y- , H2Y2-,HY3- 和 Y4-等 7 种型体存在。各型体浓度随溶液 pH 值变化而变化, 您可以想象, c(H6Y2+)随 pH 值 升高而下降, c(Y4+)随 pH 值升高而上升, 其他 5 种形体的浓度随 pH 值升高先升后降。图 8.2 中我们看到过 H2C2O4 类似的变化趋势。 2. EDTA 的酸效应和酸效应系数 Y4-与 H3O+ 离子发生如下反应: Y4-(aq) + H3O+ (aq) HY3-(aq) + H2O(l) (10.3) 该副反应消耗了部分 Y4-离子, 导致 EDTA 参加主反应(10.1)的能力下降, 这一现象叫作 EDTA 的酸效应。酸效应的大小用酸效应系数 a(EDTA)衡量: c(EDTA) a(EDTA) = ————— c(Y4-) 式中 c(EDTA)是平衡系统中未参与配位的 EDTA 各型体浓度之和,c(Y4-)是 Y4-离子的平衡浓 度。酸效应系数只与溶液的酸度有关, 溶液的酸度越高(c(Y4-)值越小), 酸效应系数越大。表 10.2 给出不同 pH 溶液中的 lg a(EDTA)。 Table 10.2 lg a(EDTA) values as a function of pH pH lg a(EDTA) pH lg a(EDTA) 0.0 1.0 2.0 3.0 4.0 5.0 6.0 23.64 18.01 13.51 10.60 8.44 6.60 4.65 7.0 8.0 9.0 10.0 11.0 12.0 3.32 2.26 1.29 0.45 0.07 0.00
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 决定的。溶液酸度是影响滴定的最重要的条件, 本章只介绍不同酸度条件下的条件稳定常 数。 10.2.2 EDTA 的酸效应 1. EDTA 的离解平衡 EDTA(H4Y)在高酸度溶液中以 H6Y2+的形式存在, 多出的两个 质子分别键合于两个氨基 N 原子上(注意, N 原子上有孤对电子)。六元酸 H6Y2+在水溶液中 存在六级电离平衡: H6Y2+(aq) + H2O(l) H3O+ + H5Y+ (aq) H5Y+ (aq) + H2O(l) H3O+ + H4Y(aq) H4Y(aq) + H2O(l) H3O+ + H3Y- (aq) H3Y- (aq) + H2O(l) H3O+ + H2Y2-(aq) H2Y2-(aq) + H2O(l) H3O+ + HY3-(aq) HY3-(aq) + H2O(l) H3O+ + Y4-(aq) K○一 1 = 10-0.9 K○一 2 = 10-1.6 K○一 3 = 10-2.07 K○一 4 = 10-2.75 K○一 5 = 10-6.42 K○一 6 = 10-10.34 上述电离平衡表明, EDTA 在水溶液中总是以 H6Y2+,H5Y+ ,H4Y,H3Y- , H2Y2-,HY3- 和 Y4-等 7 种型体存在。各型体浓度随溶液 pH 值变化而变化, 您可以想象, c(H6Y2+)随 pH 值 升高而下降, c(Y4+)随 pH 值升高而上升, 其他 5 种形体的浓度随 pH 值升高先升后降。图 8.2 中我们看到过 H2C2O4 类似的变化趋势。 2. EDTA 的酸效应和酸效应系数 Y4-与 H3O+ 离子发生如下反应: Y4-(aq) + H3O+ (aq) HY3-(aq) + H2O(l) (10.3) 该副反应消耗了部分 Y4-离子, 导致 EDTA 参加主反应(10.1)的能力下降, 这一现象叫作 EDTA 的酸效应。酸效应的大小用酸效应系数 a(EDTA)衡量: c(EDTA) a(EDTA) = ————— c(Y4-) 式中 c(EDTA)是平衡系统中未参与配位的 EDTA 各型体浓度之和,c(Y4-)是 Y4-离子的平衡浓 度。酸效应系数只与溶液的酸度有关, 溶液的酸度越高(c(Y4-)值越小), 酸效应系数越大。表 10.2 给出不同 pH 溶液中的 lg a(EDTA)。 Table 10.2 lg a(EDTA) values as a function of pH pH lg a(EDTA) pH lg a(EDTA) 0.0 1.0 2.0 3.0 4.0 5.0 6.0 23.64 18.01 13.51 10.60 8.44 6.60 4.65 7.0 8.0 9.0 10.0 11.0 12.0 3.32 2.26 1.29 0.45 0.07 0.00

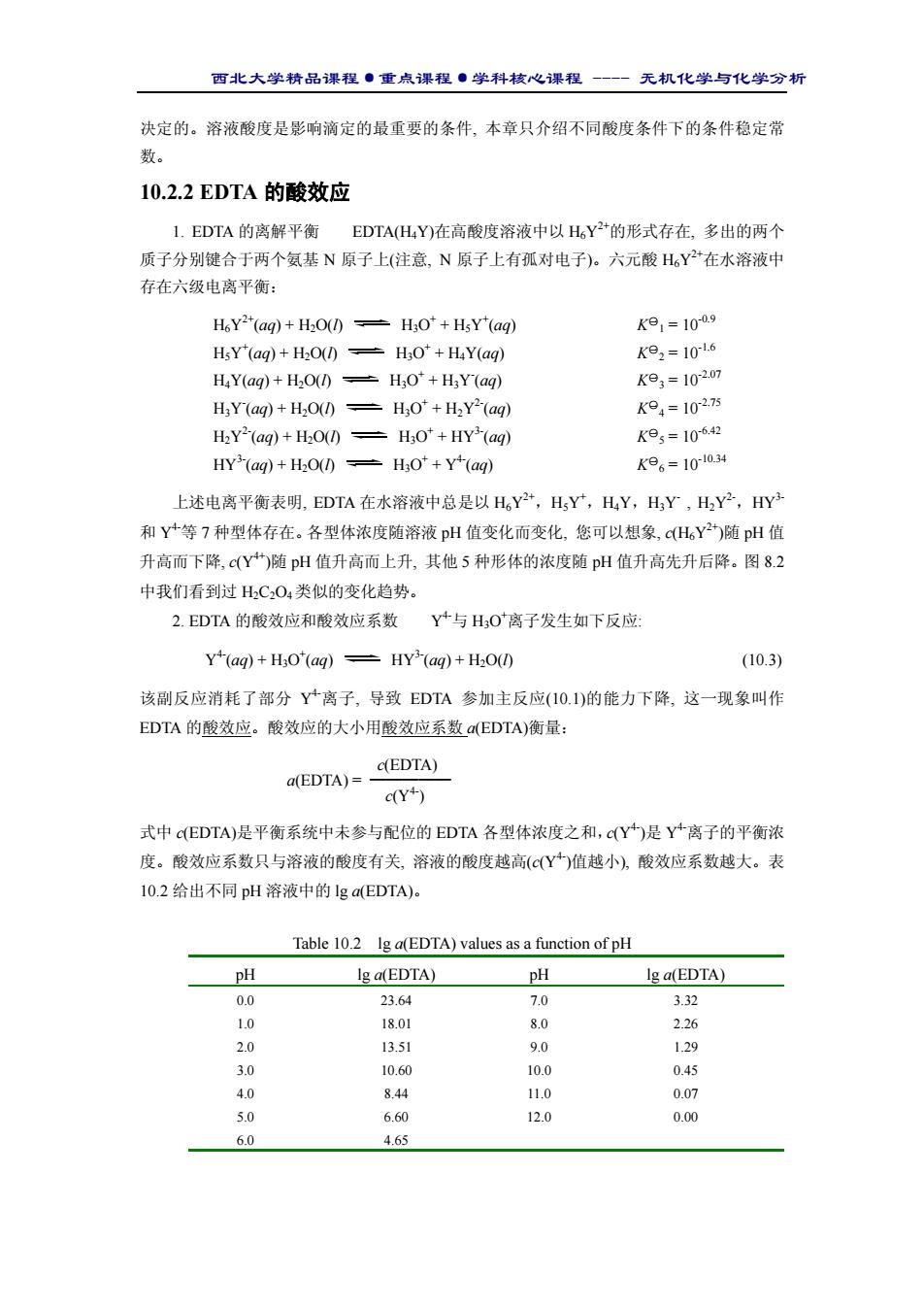
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10.2.3 与酸效应有关的条件稳定常数 由表 10.2 可知,pH≥12.0 时, a(EDTA) = 1, 即 c(Y4-) = c(EDTA)/1 = c(EDTA) 或者说, 平衡系统中存在的 EDTA 几乎全部以 Y4-这种型体存在。 当 pH 值低于 12.0 时,表 10.1 中的稳定常数数据已不再反映实际平衡状态, 显然需要寻 求特定 pH 条件下的平衡常数了。这种在特定 pH 条件下的平衡常数就是一种条件平衡常数, 符号为 K(MY’)。“’”加在 Y 的右上角, 表示相关的副反应是 Y 发生的副反应(见反应 10.3), 而不是金属离子 M 发生的副反应。 K(MY’)与 K○一 f(MY)的关系为: 1 K(MY’) = K○一 f(MY) × ————— (10.4) a(EDTA) 或 lgK(MY’) = lgK○一 f(MY)-lga(EDTA) (10.5) 【例题 10.1】由 BiY- 的标准稳定常数计算 pH=0.0 时的条件稳定常数 lgK(BiY’)。 解答: 由表 10.1 和表 10.2 查得: lg K一○f (BiY) = 27.94, lga(EDTA) = 23.64 代入式(10.5)得:lgK(BiY’) = 27.94 - 23.64 = 4.30 4. EDTA 的酸效应曲线 上例的计算表明, 酸度升高至一定程度时, 表 10.1 中稳定性 最大的络合物 BiY- 也变得如此不稳定, 以致不再能用 EDTA 滴定 Bi3+。为了适于滴定, 只能 让 K(MY’)等于或者高于某一最小值。 反应能否用于滴定不但与条件平衡常数有关,而且与被滴定金属离子的浓度有关。通 常将式(10.6)作为 EDTA 准确滴定单一金属离子的判别式: lg[{c(M)/mol·dm-3}·K(MY’)]≥6.0 (10.6) 式中的 c(M)代表被滴定金属离子的浓度。如果 c(M) = 0.01 mol·dm-3,上述判别式可写为: lgK(MY’)≥8.0 (10.7) 该式的含义是,滴定浓度为 0.01 mol·dm-3 的金属离子时,条件稳定常数的最小值为 8.0。 尽管 K(MY’)的最小值对所有金属离子的滴定都相同,但与之对应的 pH 值却各不不同。 由式(10.5)和式(10.7)可计算相应的 lga(EDTA),进而由表 10.2 查得能用于进行滴定的最低 pH 值。 【例题 10.2】 试计算 EDTA 络合滴定法滴定 Zn2+离子的最低 pH 值。 解答: (1) 将表 10.1 中查得的 lgK○一f(MY)值和条件式(10.7)限定的 lgK(MY’)值代入式(10.5)得: 8.0 = 16.5-lga(EDTA) lga(EDTA) = 16.5-8.0 = 8.5 (2) 由表 10.2 查得对应的 pH 值约为 4.0。这意味着, pH 值低于 4.0 时, 不能用 EDTA 准确滴定 Zn2+离子。 以最低 pH 值对 lgK○一 f(MY)或对 lga(EDTA)作图, 得到的曲线叫酸效应曲线或林邦曲线
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10.2.3 与酸效应有关的条件稳定常数 由表 10.2 可知,pH≥12.0 时, a(EDTA) = 1, 即 c(Y4-) = c(EDTA)/1 = c(EDTA) 或者说, 平衡系统中存在的 EDTA 几乎全部以 Y4-这种型体存在。 当 pH 值低于 12.0 时,表 10.1 中的稳定常数数据已不再反映实际平衡状态, 显然需要寻 求特定 pH 条件下的平衡常数了。这种在特定 pH 条件下的平衡常数就是一种条件平衡常数, 符号为 K(MY’)。“’”加在 Y 的右上角, 表示相关的副反应是 Y 发生的副反应(见反应 10.3), 而不是金属离子 M 发生的副反应。 K(MY’)与 K○一 f(MY)的关系为: 1 K(MY’) = K○一 f(MY) × ————— (10.4) a(EDTA) 或 lgK(MY’) = lgK○一 f(MY)-lga(EDTA) (10.5) 【例题 10.1】由 BiY- 的标准稳定常数计算 pH=0.0 时的条件稳定常数 lgK(BiY’)。 解答: 由表 10.1 和表 10.2 查得: lg K一○f (BiY) = 27.94, lga(EDTA) = 23.64 代入式(10.5)得:lgK(BiY’) = 27.94 - 23.64 = 4.30 4. EDTA 的酸效应曲线 上例的计算表明, 酸度升高至一定程度时, 表 10.1 中稳定性 最大的络合物 BiY- 也变得如此不稳定, 以致不再能用 EDTA 滴定 Bi3+。为了适于滴定, 只能 让 K(MY’)等于或者高于某一最小值。 反应能否用于滴定不但与条件平衡常数有关,而且与被滴定金属离子的浓度有关。通 常将式(10.6)作为 EDTA 准确滴定单一金属离子的判别式: lg[{c(M)/mol·dm-3}·K(MY’)]≥6.0 (10.6) 式中的 c(M)代表被滴定金属离子的浓度。如果 c(M) = 0.01 mol·dm-3,上述判别式可写为: lgK(MY’)≥8.0 (10.7) 该式的含义是,滴定浓度为 0.01 mol·dm-3 的金属离子时,条件稳定常数的最小值为 8.0。 尽管 K(MY’)的最小值对所有金属离子的滴定都相同,但与之对应的 pH 值却各不不同。 由式(10.5)和式(10.7)可计算相应的 lga(EDTA),进而由表 10.2 查得能用于进行滴定的最低 pH 值。 【例题 10.2】 试计算 EDTA 络合滴定法滴定 Zn2+离子的最低 pH 值。 解答: (1) 将表 10.1 中查得的 lgK○一f(MY)值和条件式(10.7)限定的 lgK(MY’)值代入式(10.5)得: 8.0 = 16.5-lga(EDTA) lga(EDTA) = 16.5-8.0 = 8.5 (2) 由表 10.2 查得对应的 pH 值约为 4.0。这意味着, pH 值低于 4.0 时, 不能用 EDTA 准确滴定 Zn2+离子。 以最低 pH 值对 lgK○一 f(MY)或对 lga(EDTA)作图, 得到的曲线叫酸效应曲线或林邦曲线
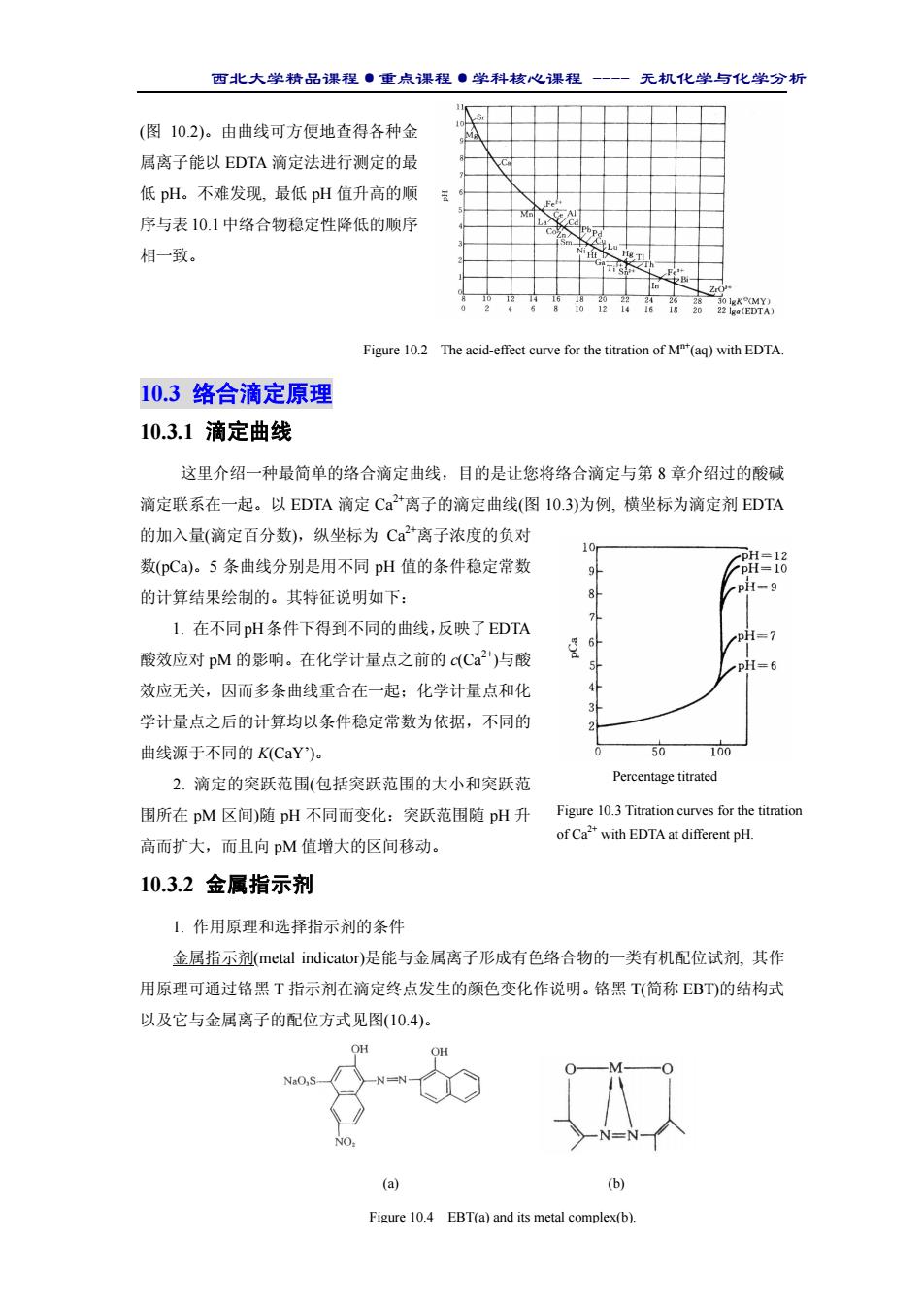
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 (图 10.2)。由曲线可方便地查得各种金 属离子能以 EDTA 滴定法进行测定的最 低 pH。不难发现, 最低 pH 值升高的顺 序与表10.1中络合物稳定性降低的顺序 相一致。 Figure 10.2 The acid-effect curve for the titration of Mn+(aq) with EDTA. 10.3 络合滴定原理 10.3.1 滴定曲线 这里介绍一种最简单的络合滴定曲线,目的是让您将络合滴定与第 8 章介绍过的酸碱 滴定联系在一起。以 EDTA 滴定 Ca2+离子的滴定曲线(图 10.3)为例, 横坐标为滴定剂 EDTA 的加入量(滴定百分数),纵坐标为 Ca2+离子浓度的负对 数(pCa)。5 条曲线分别是用不同 pH 值的条件稳定常数 的计算结果绘制的。其特征说明如下: 1. 在不同pH条件下得到不同的曲线,反映了EDTA 酸效应对 pM 的影响。在化学计量点之前的 c(Ca2+)与酸 效应无关,因而多条曲线重合在一起;化学计量点和化 学计量点之后的计算均以条件稳定常数为依据,不同的 曲线源于不同的 K(CaY’)。 2. 滴定的突跃范围(包括突跃范围的大小和突跃范 围所在 pM 区间)随 pH 不同而变化:突跃范围随 pH 升 高而扩大,而且向 pM 值增大的区间移动。 10.3.2 金属指示剂 1. 作用原理和选择指示剂的条件 金属指示剂(metal indicator)是能与金属离子形成有色络合物的一类有机配位试剂, 其作 用原理可通过铬黑 T 指示剂在滴定终点发生的颜色变化作说明。铬黑 T(简称 EBT)的结构式 以及它与金属离子的配位方式见图(10.4)。 Percentage titrated Figure 10.3 Titration curves for the titration of Ca2+ with EDTA at different pH. (a) (b) Figure 10.4 EBT(a) and its metal complex(b)
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 (图 10.2)。由曲线可方便地查得各种金 属离子能以 EDTA 滴定法进行测定的最 低 pH。不难发现, 最低 pH 值升高的顺 序与表10.1中络合物稳定性降低的顺序 相一致。 Figure 10.2 The acid-effect curve for the titration of Mn+(aq) with EDTA. 10.3 络合滴定原理 10.3.1 滴定曲线 这里介绍一种最简单的络合滴定曲线,目的是让您将络合滴定与第 8 章介绍过的酸碱 滴定联系在一起。以 EDTA 滴定 Ca2+离子的滴定曲线(图 10.3)为例, 横坐标为滴定剂 EDTA 的加入量(滴定百分数),纵坐标为 Ca2+离子浓度的负对 数(pCa)。5 条曲线分别是用不同 pH 值的条件稳定常数 的计算结果绘制的。其特征说明如下: 1. 在不同pH条件下得到不同的曲线,反映了EDTA 酸效应对 pM 的影响。在化学计量点之前的 c(Ca2+)与酸 效应无关,因而多条曲线重合在一起;化学计量点和化 学计量点之后的计算均以条件稳定常数为依据,不同的 曲线源于不同的 K(CaY’)。 2. 滴定的突跃范围(包括突跃范围的大小和突跃范 围所在 pM 区间)随 pH 不同而变化:突跃范围随 pH 升 高而扩大,而且向 pM 值增大的区间移动。 10.3.2 金属指示剂 1. 作用原理和选择指示剂的条件 金属指示剂(metal indicator)是能与金属离子形成有色络合物的一类有机配位试剂, 其作 用原理可通过铬黑 T 指示剂在滴定终点发生的颜色变化作说明。铬黑 T(简称 EBT)的结构式 以及它与金属离子的配位方式见图(10.4)。 Percentage titrated Figure 10.3 Titration curves for the titration of Ca2+ with EDTA at different pH. (a) (b) Figure 10.4 EBT(a) and its metal complex(b)

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 EBT 本身在 pH=8~11 的溶液中显蓝色, 而与 Ca2+、Mg2+等离子形成的络合物呈酒红色。 在指示剂存在的条件下, 金属离子溶液在开始滴定之前显示络合物的酒红色,滴定过程中该 颜色一直保持到 EDTA 的加入量接近化学计量点的理论量。这种情况下, 未与指示剂配位的 游离金属离子几乎全部形成了 EDTA 络合物,继续加入 EDTA 将夺走铬黑 T 配合物中的金 属离子而将铬黑 T 游离出来, 溶液由红色变为蓝色, 指示滴定终点到达。 M(EBT) + EDTA M(EDTA) + EBT (10.8) (酒红色) (蓝色) 金属指示剂不仅具有配位功能,而且常是多元弱酸或弱碱。像酸碱指示剂一样,随溶液 pH 的变化而显示不同的颜色。铬黑 T 是个三元弱酸,第二、第三级电离平衡和相应型体的 颜色为: H2In- HIn2- In3- (红色) (蓝色) (橙色) pH12 显然, 铬黑 T 在 pH<6 和 pH>12 的溶液中不能用作上述滴定的指示剂,因为在这样的 pH 区间内, 指示剂本身的颜色与指示剂配合物的颜色没有显著差别。由上述讨论不难得出 合适的指示剂应当具备的基本条件: 1) 配合物 MIn 的条件稳定常数必须小于 M(EDTA)的条件稳定常数, 否则, 如式(10.8) 那样的竞争反应将不可能向右进行。 2) 显色配合物(MIn)与指示剂(In)本身的颜色应显著不同。 3) 指示剂必须在滴定突跃范围内变色, 突跃范围太小时, 将严重限制选择指示剂的余 地。 金属指示剂大多是具有双键的化合物, 易受日光、空气、氧化剂的作用而分解。为了避 免指示剂变质, 往往将指示剂与中性盐配成固体混合物使用。有时可在配制的指示剂溶液中 加入盐酸羟胺或抗坏血酸, 以防止指示剂氧化。配好的指示剂一般不宜久置。 10.4 滴定干扰的消除 EDTA 能与多种金属离子形成配合物,溶液中存在的两种或多种金属离子时, 其他离子 可能对待测离子的测定造成干扰, 从而影响测定。在许多情况下, 这种干扰可通过下列方法 消除。 1. 选择合适的酸度以分别滴定 假定溶液中存在 M1 和 M2 两种金属离子, 同时假定 c(M1) = c(M2), K(M1Y’)>K(M2Y’)。加入 EDTA 时, M1 将先于 M2 被滴定。如果 K(M1Y’)与 K(M2Y’)的值相差足够大, 在 M1 的滴定定量完成之后, EDTA 才与 M2反应,即 M1和 M2可 以分别进行滴定。△lgK(MY’)越大, 进行分别滴定的可能性就越大。 2. 掩蔽干扰离子以分别滴定 若被测离子与干扰离子的△lgK(MY’)值太小, 或者干 扰离子比待测离子与 EDTA 形成更稳定的配合物,选择酸度以分别滴定的方法不再适用。 在这种情况下, 需要利用掩蔽剂来降低干扰离子的浓度以消除干扰。几种常用的掩蔽方法是:
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 EBT 本身在 pH=8~11 的溶液中显蓝色, 而与 Ca2+、Mg2+等离子形成的络合物呈酒红色。 在指示剂存在的条件下, 金属离子溶液在开始滴定之前显示络合物的酒红色,滴定过程中该 颜色一直保持到 EDTA 的加入量接近化学计量点的理论量。这种情况下, 未与指示剂配位的 游离金属离子几乎全部形成了 EDTA 络合物,继续加入 EDTA 将夺走铬黑 T 配合物中的金 属离子而将铬黑 T 游离出来, 溶液由红色变为蓝色, 指示滴定终点到达。 M(EBT) + EDTA M(EDTA) + EBT (10.8) (酒红色) (蓝色) 金属指示剂不仅具有配位功能,而且常是多元弱酸或弱碱。像酸碱指示剂一样,随溶液 pH 的变化而显示不同的颜色。铬黑 T 是个三元弱酸,第二、第三级电离平衡和相应型体的 颜色为: H2In- HIn2- In3- (红色) (蓝色) (橙色) pH12 显然, 铬黑 T 在 pH<6 和 pH>12 的溶液中不能用作上述滴定的指示剂,因为在这样的 pH 区间内, 指示剂本身的颜色与指示剂配合物的颜色没有显著差别。由上述讨论不难得出 合适的指示剂应当具备的基本条件: 1) 配合物 MIn 的条件稳定常数必须小于 M(EDTA)的条件稳定常数, 否则, 如式(10.8) 那样的竞争反应将不可能向右进行。 2) 显色配合物(MIn)与指示剂(In)本身的颜色应显著不同。 3) 指示剂必须在滴定突跃范围内变色, 突跃范围太小时, 将严重限制选择指示剂的余 地。 金属指示剂大多是具有双键的化合物, 易受日光、空气、氧化剂的作用而分解。为了避 免指示剂变质, 往往将指示剂与中性盐配成固体混合物使用。有时可在配制的指示剂溶液中 加入盐酸羟胺或抗坏血酸, 以防止指示剂氧化。配好的指示剂一般不宜久置。 10.4 滴定干扰的消除 EDTA 能与多种金属离子形成配合物,溶液中存在的两种或多种金属离子时, 其他离子 可能对待测离子的测定造成干扰, 从而影响测定。在许多情况下, 这种干扰可通过下列方法 消除。 1. 选择合适的酸度以分别滴定 假定溶液中存在 M1 和 M2 两种金属离子, 同时假定 c(M1) = c(M2), K(M1Y’)>K(M2Y’)。加入 EDTA 时, M1 将先于 M2 被滴定。如果 K(M1Y’)与 K(M2Y’)的值相差足够大, 在 M1 的滴定定量完成之后, EDTA 才与 M2反应,即 M1和 M2可 以分别进行滴定。△lgK(MY’)越大, 进行分别滴定的可能性就越大。 2. 掩蔽干扰离子以分别滴定 若被测离子与干扰离子的△lgK(MY’)值太小, 或者干 扰离子比待测离子与 EDTA 形成更稳定的配合物,选择酸度以分别滴定的方法不再适用。 在这种情况下, 需要利用掩蔽剂来降低干扰离子的浓度以消除干扰。几种常用的掩蔽方法是:

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1) 络合掩蔽法 掩蔽剂使用某种络合剂,它与干扰离子形成的络合物比 EDTA 与干 扰离子形成的络合物更稳定,但却不与被测离子形成稳定配合物。例如,用 EDTA 滴定水 中的 Ca2+和 Mg2+以测定水的硬度时, Fe3+、Al3+等离子的存在对测定有干扰。若加入三乙醇 胺使之与 Fe3+、Al3+ 生成更稳定的配合物,则 Fe3+、Al3+等离子为三乙醇胺掩蔽而不再干扰 测定。又如,在 Al3+和 Zn2+两种离子共存的系统中加入 NH4F, 使 Al3+生成更稳定的[AlF6] 3- 络离子而被掩蔽,因而在 pH=5~6 的条件下可以用 EDTA 滴定 Zn2+离子。 2) 沉淀掩蔽法 掩蔽剂使用只与干扰离子形成沉淀的化学试剂, 即选择性沉淀剂。 例如,在 Ca2+和 Mg2+离子共存的系统中加入 NaOH 使 pH>12,待 Mg2+生成 Mg(OH)2 沉淀后, 再加入钙指示剂用 EDTA 滴定 Ca2+离子。 3) 氧化还原掩蔽法 此法通过氧化还原反应变更干扰离子的氧化态以消除其干扰。 例如,用 EDTA 滴定 Bi3+,Zr4+,Th4+等离子时, 溶液中存在的 Fe3+离子对测定有干扰。加入抗 坏血酸或羟胺可将 Fe3+还原为 Fe2+。由于 Fe2+-EDTA 络合物的稳定性比 Fe3+-EDTA 小得多(见 表 10.1),从而使干扰被消除。 3. 干扰离子的预先分离 用前两类方法均不能满意地消除干扰时, 需要将干扰离子 预先分离。例如,钴、镍离子的混合物中测定 Ni2+和 Co2+离子时, 事先需要通过离子交换法 进行分离。又如,磷矿物中通常含大量氟组分,F- 离子的存在严重干扰某些离子(如 Al3+和 Ca2+,前者与 F- 离子形成稳定的配合物, 后者则生成 CaF2 沉淀)的测定。为消除 F- 离子造成 的干扰, 通常在酸化和加热条件下使 F- 以 HF 形式挥发而离开系统。 4. 其它方法 例如选用其他滴定剂。 10.5 络合滴定方式 采用不同滴定方式是扩大络合滴定应用范围的一条重要途径。第 8 章提到的4种滴定方 式在络合滴定中均适用。 1. 直接滴定(direct titration) 用滴定剂直接滴定待测离子的方式叫直接滴定。直接 滴定迅速方便、引入的误差小,但不是任何场合都能采用。例如, 待测离子不与滴定剂形成 络合物(如 SO4 2-, PO4 3-),或者不形成稳定的络合物(如 Na+ );待测离子虽能与滴定剂形成具 有一定稳定性的络合物, 但难以找到合适的指示剂(如 EDTA 滴定 Ba2+);待测离子与滴定剂 反应速率太慢(如 EDTA 与 Al3+和 Cr3+的反应)。 2. 间接滴定(indirect titration) 待测离子不形成络合物或不形成稳定络合物的情况 下, 可考虑采用间接滴定法。例如,PO4 3-与 EDTA 不形成络合物, 如果先加入准确量的过量 Bi(NO3)3 使之生成 BiPO4 沉淀,再用 EDTA 滴定过量的 Bi3+离子,不难计算出 PO4 3-的含量。 又如,Na+ 的 EDTA 络合物不稳定(见表 10.1),如果加入醋酸铀酰锌使之生成具有确定化学 组成的NaZn(UO2)3(Ac)9·xH2O沉淀, 则可将沉淀分离, 洗净, 溶解后用EDTA滴定Zn2+离子。 3. 返滴定(back titration) 直接滴定法面临的后两种困难可通过返滴定方式解决。即 先加入准确量的过量滴定剂, 使待测离子与滴定剂反应完全后, 再用金属离子的标准溶液返 滴过量的滴定剂。例如用 EDTA 测定 Al3+离子。由于 Al3+离子形成一系列羟基络合物,这种 络合物与EDTA的反应太缓慢, 因而无法进行直接滴定。如果先加入准确量的过量EDTA, 并
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1) 络合掩蔽法 掩蔽剂使用某种络合剂,它与干扰离子形成的络合物比 EDTA 与干 扰离子形成的络合物更稳定,但却不与被测离子形成稳定配合物。例如,用 EDTA 滴定水 中的 Ca2+和 Mg2+以测定水的硬度时, Fe3+、Al3+等离子的存在对测定有干扰。若加入三乙醇 胺使之与 Fe3+、Al3+ 生成更稳定的配合物,则 Fe3+、Al3+等离子为三乙醇胺掩蔽而不再干扰 测定。又如,在 Al3+和 Zn2+两种离子共存的系统中加入 NH4F, 使 Al3+生成更稳定的[AlF6] 3- 络离子而被掩蔽,因而在 pH=5~6 的条件下可以用 EDTA 滴定 Zn2+离子。 2) 沉淀掩蔽法 掩蔽剂使用只与干扰离子形成沉淀的化学试剂, 即选择性沉淀剂。 例如,在 Ca2+和 Mg2+离子共存的系统中加入 NaOH 使 pH>12,待 Mg2+生成 Mg(OH)2 沉淀后, 再加入钙指示剂用 EDTA 滴定 Ca2+离子。 3) 氧化还原掩蔽法 此法通过氧化还原反应变更干扰离子的氧化态以消除其干扰。 例如,用 EDTA 滴定 Bi3+,Zr4+,Th4+等离子时, 溶液中存在的 Fe3+离子对测定有干扰。加入抗 坏血酸或羟胺可将 Fe3+还原为 Fe2+。由于 Fe2+-EDTA 络合物的稳定性比 Fe3+-EDTA 小得多(见 表 10.1),从而使干扰被消除。 3. 干扰离子的预先分离 用前两类方法均不能满意地消除干扰时, 需要将干扰离子 预先分离。例如,钴、镍离子的混合物中测定 Ni2+和 Co2+离子时, 事先需要通过离子交换法 进行分离。又如,磷矿物中通常含大量氟组分,F- 离子的存在严重干扰某些离子(如 Al3+和 Ca2+,前者与 F- 离子形成稳定的配合物, 后者则生成 CaF2 沉淀)的测定。为消除 F- 离子造成 的干扰, 通常在酸化和加热条件下使 F- 以 HF 形式挥发而离开系统。 4. 其它方法 例如选用其他滴定剂。 10.5 络合滴定方式 采用不同滴定方式是扩大络合滴定应用范围的一条重要途径。第 8 章提到的4种滴定方 式在络合滴定中均适用。 1. 直接滴定(direct titration) 用滴定剂直接滴定待测离子的方式叫直接滴定。直接 滴定迅速方便、引入的误差小,但不是任何场合都能采用。例如, 待测离子不与滴定剂形成 络合物(如 SO4 2-, PO4 3-),或者不形成稳定的络合物(如 Na+ );待测离子虽能与滴定剂形成具 有一定稳定性的络合物, 但难以找到合适的指示剂(如 EDTA 滴定 Ba2+);待测离子与滴定剂 反应速率太慢(如 EDTA 与 Al3+和 Cr3+的反应)。 2. 间接滴定(indirect titration) 待测离子不形成络合物或不形成稳定络合物的情况 下, 可考虑采用间接滴定法。例如,PO4 3-与 EDTA 不形成络合物, 如果先加入准确量的过量 Bi(NO3)3 使之生成 BiPO4 沉淀,再用 EDTA 滴定过量的 Bi3+离子,不难计算出 PO4 3-的含量。 又如,Na+ 的 EDTA 络合物不稳定(见表 10.1),如果加入醋酸铀酰锌使之生成具有确定化学 组成的NaZn(UO2)3(Ac)9·xH2O沉淀, 则可将沉淀分离, 洗净, 溶解后用EDTA滴定Zn2+离子。 3. 返滴定(back titration) 直接滴定法面临的后两种困难可通过返滴定方式解决。即 先加入准确量的过量滴定剂, 使待测离子与滴定剂反应完全后, 再用金属离子的标准溶液返 滴过量的滴定剂。例如用 EDTA 测定 Al3+离子。由于 Al3+离子形成一系列羟基络合物,这种 络合物与EDTA的反应太缓慢, 因而无法进行直接滴定。如果先加入准确量的过量EDTA, 并

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 在加热条件下使之反应完全,则可用Cu2+或者 Zn2+标准溶液返滴过量的 EDTA。又如用 EDTA 滴定 Ba2+时选不到合适的指示剂,如果加入准确量的过量 EDTA,再用 Mg2+离子标准溶液 滴定剩余的 EDTA,就可采用滴定 Mg2+的指示剂铬黑 T。 4. 置换滴定(substitution titration) 相关的置换反应分两类: M + M’L ML + M’ MY + L ML + Y 式中略去了物种可能携带的电荷。前一个反应是待测金属离子(M)置换络合物中金属离子 (M’)的反应, M’是实际被滴定的离子。后一个反应是另一个配位体(L)置换 EDTA 络合物中 EDTA 的反应, 实际被滴定的是 EDTA。对置换出来的金属离子或 EDTA 进行滴定, 进而计 算待测离子含量的方法叫置换滴定法。 置换滴定法不但可以扩大络合滴定的适用范围, 而且是提高滴定选择性的一种有效途 径。除此之外, 还可利用置换滴定原理改善指示剂指示滴定终点的敏锐性。下边分别举几个 例子作说明。 Ag+ 的 EDTA 络合物不稳定, 不能用 EDTA 直接滴定。如果将待测的 Ag+ 离子溶液注到 [Ni(CN)4] 2-溶液中, 则可置换出后者中的 Ni2+离子: 2 Ag+ (aq) + [Ni(CN)4] 2-(aq) 2 [Ag(CN)2] - (aq) + Ni2+(aq) 在 pH 值为 10 的氨缓冲溶液中以紫脲酸胺作指示剂,用 EDTA 滴定置换出的 Ni2+,即可求 得 Ag+ 的含量。 测定合金中的 Sn 时, 可先加入过量滴定剂使 Sn4+和干扰离子 Pb2+、Zn2+、Cd2+、Bi3+等 一起生成 EDTA 络合物, 然后用 Zn2+的标准溶液滴定以除去过量的 EDTA,这样一种操作相 当于前述的返滴定。接下来加入 NH4F 将 SnY 中的 EDTA 释放出来,再用 Zn2+标准溶液滴 定释放出来的 EDTA, 即可求得 Sn4+的含量。上述干扰离子均不形成稳定的氟络合物, 从而 大大提高了滴定 Sn4+的选择性。 用 EDTA 滴定 Ca2+离子时, 铬黑 T 在滴定终点显色不灵敏。如果在溶液中加入少量 MgY,则发生下述置换反应: MgY(aq) +Ca2+(aq) CaY(aq) + Mg2+(aq) 置换出来的 Mg2+离子与铬黑 T 形成酒红色络合物 Mg(EBT)。滴定过程中加入的 EDTA 先与 Ca2+起反应, 达到滴定终点时夺取 Mg(EBT)中的 Mg2+, 显示出游离铬黑 T 的蓝色。由于滴定 前加入的 MgY 和最后生成的 MgY 等量,因而 MgY 的加入不影响滴定结果
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 在加热条件下使之反应完全,则可用Cu2+或者 Zn2+标准溶液返滴过量的 EDTA。又如用 EDTA 滴定 Ba2+时选不到合适的指示剂,如果加入准确量的过量 EDTA,再用 Mg2+离子标准溶液 滴定剩余的 EDTA,就可采用滴定 Mg2+的指示剂铬黑 T。 4. 置换滴定(substitution titration) 相关的置换反应分两类: M + M’L ML + M’ MY + L ML + Y 式中略去了物种可能携带的电荷。前一个反应是待测金属离子(M)置换络合物中金属离子 (M’)的反应, M’是实际被滴定的离子。后一个反应是另一个配位体(L)置换 EDTA 络合物中 EDTA 的反应, 实际被滴定的是 EDTA。对置换出来的金属离子或 EDTA 进行滴定, 进而计 算待测离子含量的方法叫置换滴定法。 置换滴定法不但可以扩大络合滴定的适用范围, 而且是提高滴定选择性的一种有效途 径。除此之外, 还可利用置换滴定原理改善指示剂指示滴定终点的敏锐性。下边分别举几个 例子作说明。 Ag+ 的 EDTA 络合物不稳定, 不能用 EDTA 直接滴定。如果将待测的 Ag+ 离子溶液注到 [Ni(CN)4] 2-溶液中, 则可置换出后者中的 Ni2+离子: 2 Ag+ (aq) + [Ni(CN)4] 2-(aq) 2 [Ag(CN)2] - (aq) + Ni2+(aq) 在 pH 值为 10 的氨缓冲溶液中以紫脲酸胺作指示剂,用 EDTA 滴定置换出的 Ni2+,即可求 得 Ag+ 的含量。 测定合金中的 Sn 时, 可先加入过量滴定剂使 Sn4+和干扰离子 Pb2+、Zn2+、Cd2+、Bi3+等 一起生成 EDTA 络合物, 然后用 Zn2+的标准溶液滴定以除去过量的 EDTA,这样一种操作相 当于前述的返滴定。接下来加入 NH4F 将 SnY 中的 EDTA 释放出来,再用 Zn2+标准溶液滴 定释放出来的 EDTA, 即可求得 Sn4+的含量。上述干扰离子均不形成稳定的氟络合物, 从而 大大提高了滴定 Sn4+的选择性。 用 EDTA 滴定 Ca2+离子时, 铬黑 T 在滴定终点显色不灵敏。如果在溶液中加入少量 MgY,则发生下述置换反应: MgY(aq) +Ca2+(aq) CaY(aq) + Mg2+(aq) 置换出来的 Mg2+离子与铬黑 T 形成酒红色络合物 Mg(EBT)。滴定过程中加入的 EDTA 先与 Ca2+起反应, 达到滴定终点时夺取 Mg(EBT)中的 Mg2+, 显示出游离铬黑 T 的蓝色。由于滴定 前加入的 MgY 和最后生成的 MgY 等量,因而 MgY 的加入不影响滴定结果