
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 16 章 f 区元素 Chapter 16 f Block 教学要求 1.熟悉镧系元素电子结构、名称,镧系收缩概念及其产生原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元素的相似性。 课时分配(4 学时) 1. 二镧系元素的存在,提取和应用:(2 学时) 2. 镧系元素的相互分离:(1 学时) 3. 锕系元素简介:(1 学时) 有关 f 区元素定义的争论仍在继续: 一种意见将镧系和锕系分别界定为 La 之后的 14 种元素和 Ac 之后的 14 种元 素,结果是镧系不包括 La 而锕系不包括 Ac ; 另一种意见是镧系应包括 La 而锕系应包括 Ac , 各有 15 个元素。 “稀土” — 别致有趣的名字: 稀土的英文是 Rare Earths,18 世纪得名,“稀”原指稀贵,“土” 是指其氧化物难溶 于水的 “土” 性。 其实稀土元素在地壳中的含量并不稀少,性质也不象土,而是 一组活泼金属, “稀土” 之称只是一种历史的习惯。 16.1 镧系元素 16.1.1 基本性质概述 周期表元素中基态 f 轨道最先在镧系元素出现,镧系元素的某些基本性质可见书里表中 所列。 对镧系元素的基本性质着重强调规律性: 1. 镧系元素分组 “二分组”,“三分组”和“四分组”现象及其产生原因。 2. 镧系元素的电子构型和性质 3. 氧化态特性
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 16 章 f 区元素 Chapter 16 f Block 教学要求 1.熟悉镧系元素电子结构、名称,镧系收缩概念及其产生原因和影响; 2.了解镧系元素的存在,制备及用途; 3.重点掌握镧系元素氧化物,氢氧化物的性质; 4.了解镧系元素的分离方法,特别注意溶剂萃取法及离子交换法的原理; 5. 简单了解锕系元素电子结构、名称及与镧系元素的相似性。 课时分配(4 学时) 1. 二镧系元素的存在,提取和应用:(2 学时) 2. 镧系元素的相互分离:(1 学时) 3. 锕系元素简介:(1 学时) 有关 f 区元素定义的争论仍在继续: 一种意见将镧系和锕系分别界定为 La 之后的 14 种元素和 Ac 之后的 14 种元 素,结果是镧系不包括 La 而锕系不包括 Ac ; 另一种意见是镧系应包括 La 而锕系应包括 Ac , 各有 15 个元素。 “稀土” — 别致有趣的名字: 稀土的英文是 Rare Earths,18 世纪得名,“稀”原指稀贵,“土” 是指其氧化物难溶 于水的 “土” 性。 其实稀土元素在地壳中的含量并不稀少,性质也不象土,而是 一组活泼金属, “稀土” 之称只是一种历史的习惯。 16.1 镧系元素 16.1.1 基本性质概述 周期表元素中基态 f 轨道最先在镧系元素出现,镧系元素的某些基本性质可见书里表中 所列。 对镧系元素的基本性质着重强调规律性: 1. 镧系元素分组 “二分组”,“三分组”和“四分组”现象及其产生原因。 2. 镧系元素的电子构型和性质 3. 氧化态特性
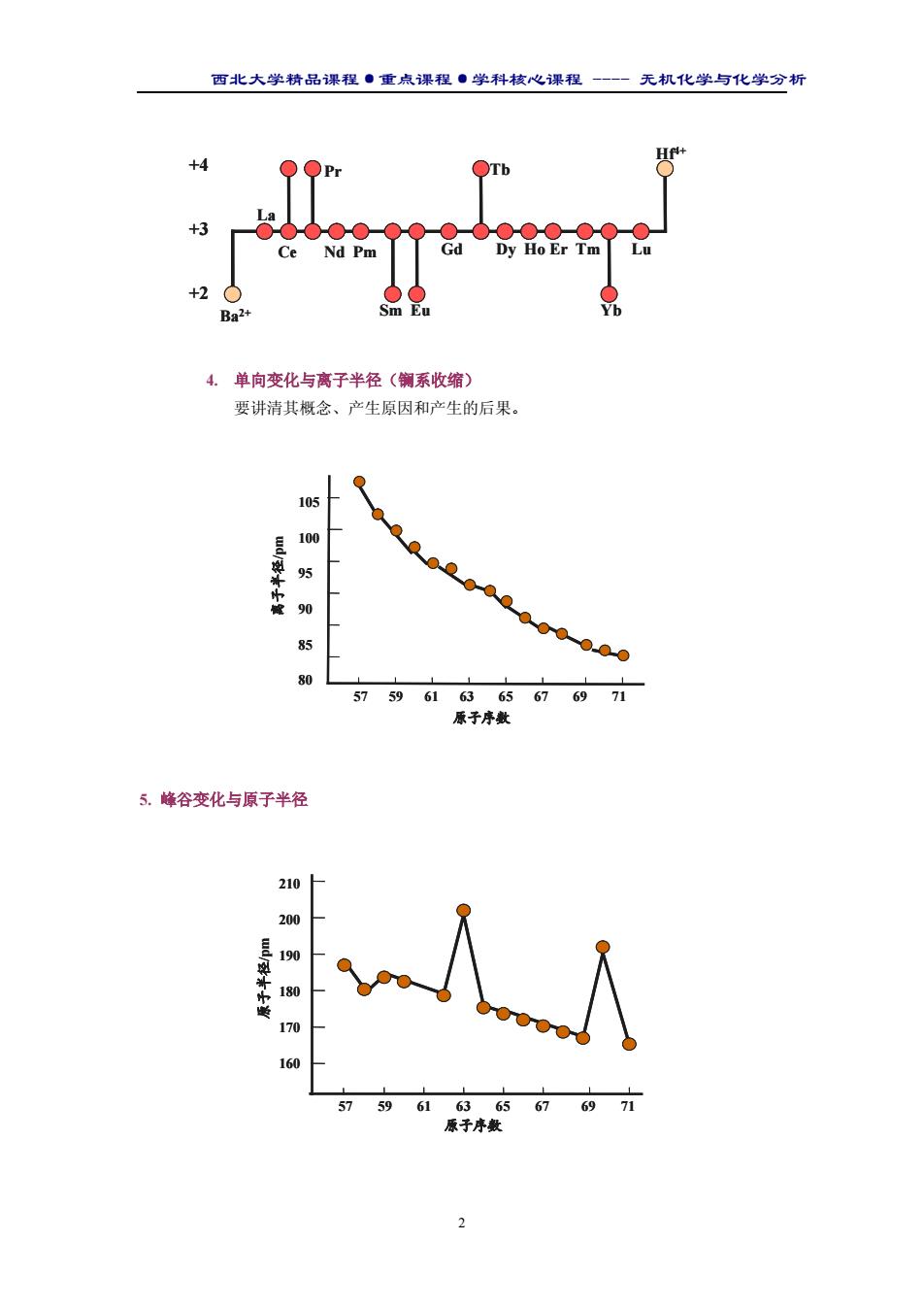
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 4. 单向变化与离子半径(镧系收缩) 要讲清其概念、产生原因和产生的后果。 5. 峰谷变化与原子半径 原子序数 离 子 半 径 p/ m 57 59 61 63 65 67 69 71 105 100 95 90 85 80 原子序数 离 子 半 径 p/ m 57 59 61 63 65 67 69 71 105 100 95 90 85 80 57 59 61 63 65 67 69 71 210 200 190 180 170 160 原 子 半 径 p/ m 原子序数 57 59 61 63 65 67 69 71 210 200 190 180 170 160 原 子 半 径 p/ m 原子序数 +4 +3 +2 Ba2+ Hf4+ Dy Ho Er Tm La Ce Pr Nd Pm Sm Eu Gd Tb Yb Lu +4 +3 +2 Ba2+ Hf4+ Dy Ho Er Tm La Ce Pr Nd Pm Sm Eu Gd Tb Yb Lu
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 4. 单向变化与离子半径(镧系收缩) 要讲清其概念、产生原因和产生的后果。 5. 峰谷变化与原子半径 原子序数 离 子 半 径 p/ m 57 59 61 63 65 67 69 71 105 100 95 90 85 80 原子序数 离 子 半 径 p/ m 57 59 61 63 65 67 69 71 105 100 95 90 85 80 57 59 61 63 65 67 69 71 210 200 190 180 170 160 原 子 半 径 p/ m 原子序数 57 59 61 63 65 67 69 71 210 200 190 180 170 160 原 子 半 径 p/ m 原子序数 +4 +3 +2 Ba2+ Hf4+ Dy Ho Er Tm La Ce Pr Nd Pm Sm Eu Gd Tb Yb Lu +4 +3 +2 Ba2+ Hf4+ Dy Ho Er Tm La Ce Pr Nd Pm Sm Eu Gd Tb Yb Lu
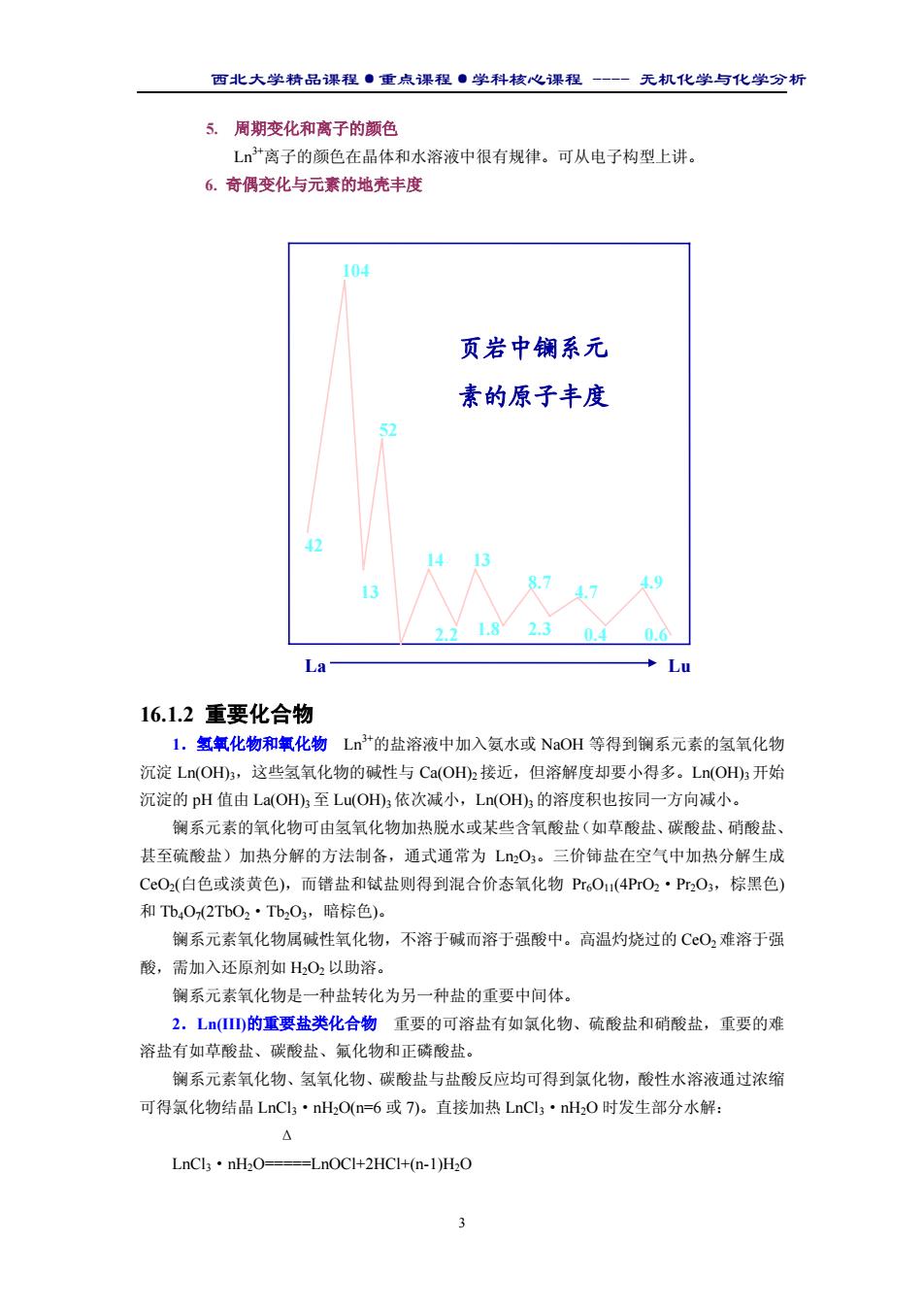
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 5. 周期变化和离子的颜色 Ln3+离子的颜色在晶体和水溶液中很有规律。可从电子构型上讲。 6. 奇偶变化与元素的地壳丰度 16.1.2 重要化合物 1.氢氧化物和氧化物 Ln3+的盐溶液中加入氨水或 NaOH 等得到镧系元素的氢氧化物 沉淀 Ln(OH)3,这些氢氧化物的碱性与 Ca(OH)2 接近,但溶解度却要小得多。Ln(OH)3开始 沉淀的 pH 值由 La(OH)3 至 Lu(OH)3 依次减小,Ln(OH)3 的溶度积也按同一方向减小。 镧系元素的氧化物可由氢氧化物加热脱水或某些含氧酸盐(如草酸盐、碳酸盐、硝酸盐、 甚至硫酸盐)加热分解的方法制备,通式通常为 Ln2O3。三价铈盐在空气中加热分解生成 CeO2(白色或淡黄色),而镨盐和铽盐则得到混合价态氧化物 Pr6O11(4PrO2·Pr2O3,棕黑色) 和 Tb4O7(2TbO2·Tb2O3,暗棕色)。 镧系元素氧化物属碱性氧化物,不溶于碱而溶于强酸中。高温灼烧过的 CeO2 难溶于强 酸,需加入还原剂如 H2O2 以助溶。 镧系元素氧化物是一种盐转化为另一种盐的重要中间体。 2.Ln(III)的重要盐类化合物 重要的可溶盐有如氯化物、硫酸盐和硝酸盐,重要的难 溶盐有如草酸盐、碳酸盐、氟化物和正磷酸盐。 镧系元素氧化物、氢氧化物、碳酸盐与盐酸反应均可得到氯化物,酸性水溶液通过浓缩 可得氯化物结晶 LnCl3·nH2O(n=6 或 7)。直接加热 LnCl3·nH2O 时发生部分水解: Δ LnCl3·nH2O=====LnOCl+2HCl+(n-1)H2O 42 104 52 13 14 13 8.7 4.7 4.9 2.2 1.8 2.3 0.4 0.6 La Lu 页岩中镧系元 素的原子丰度
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 5. 周期变化和离子的颜色 Ln3+离子的颜色在晶体和水溶液中很有规律。可从电子构型上讲。 6. 奇偶变化与元素的地壳丰度 16.1.2 重要化合物 1.氢氧化物和氧化物 Ln3+的盐溶液中加入氨水或 NaOH 等得到镧系元素的氢氧化物 沉淀 Ln(OH)3,这些氢氧化物的碱性与 Ca(OH)2 接近,但溶解度却要小得多。Ln(OH)3开始 沉淀的 pH 值由 La(OH)3 至 Lu(OH)3 依次减小,Ln(OH)3 的溶度积也按同一方向减小。 镧系元素的氧化物可由氢氧化物加热脱水或某些含氧酸盐(如草酸盐、碳酸盐、硝酸盐、 甚至硫酸盐)加热分解的方法制备,通式通常为 Ln2O3。三价铈盐在空气中加热分解生成 CeO2(白色或淡黄色),而镨盐和铽盐则得到混合价态氧化物 Pr6O11(4PrO2·Pr2O3,棕黑色) 和 Tb4O7(2TbO2·Tb2O3,暗棕色)。 镧系元素氧化物属碱性氧化物,不溶于碱而溶于强酸中。高温灼烧过的 CeO2 难溶于强 酸,需加入还原剂如 H2O2 以助溶。 镧系元素氧化物是一种盐转化为另一种盐的重要中间体。 2.Ln(III)的重要盐类化合物 重要的可溶盐有如氯化物、硫酸盐和硝酸盐,重要的难 溶盐有如草酸盐、碳酸盐、氟化物和正磷酸盐。 镧系元素氧化物、氢氧化物、碳酸盐与盐酸反应均可得到氯化物,酸性水溶液通过浓缩 可得氯化物结晶 LnCl3·nH2O(n=6 或 7)。直接加热 LnCl3·nH2O 时发生部分水解: Δ LnCl3·nH2O=====LnOCl+2HCl+(n-1)H2O 42 104 52 13 14 13 8.7 4.7 4.9 2.2 1.8 2.3 0.4 0.6 La Lu 页岩中镧系元 素的原子丰度

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 无水氯化物是电解法制备金属的起始物。通常要在氯化氢气流中或 NH2Cl 存在下或真 空脱水的方法制备。NH4Cl 存在下抑制 LnOCl 生成的反应如下: Δ LnOCl+2NH4Cl======LnCl3+H2O+2NH3 从水溶液中析出的硫酸盐通常是水合硫酸盐,除硫酸铈为九水合物外,其余皆形成八水 合物 Ln2(SO4)·8H2O。硫酸盐的溶解度随温度升高而下降。 XLn2(SO4)3+yM2SO4+zH2O===xLn2(SO4)3·yM2SO4·zH2O 式中的 M 代表 Na+ 或 K+ 或 NH4 + ,碱金属硫酸盐浓度较低时,x,y,z 值分别为 1,1,2 或 1, 1,4。硫酸复盐的溶解度随原子序数的增大而增大,处理以镧、铈、镨、钕等为主的矿物时 利用硫酸复盐较低的溶解度与溶液中的大量 Fe3+分离。 水溶液中的 Ln3+离子与 H2C2O4 生成难溶于水的水合草酸盐 Ln2(C2O4)3·nH2O,一般情 况下 n=10,但也有 n=6,7,9 和 11 的。由于草酸盐在酸性溶液中也难溶,可使镧系元素与许 多其他金属离子分离开来。 3.Ce(IV)和 Eu(II)的化合物 与酸性介质相比,碱性环境实现 Ce(III)至 Ce(IV)的转化 容易得多。例如空气能将 Ln(III)溶液中沉淀出来的 Ln(OH3)k r OHC3 氧化为 Ce(OH)4: 4Ce(OH)3+O2+2H2O===4Ce(OH)4 白色 黄色 Ce(OH)4 开始沉淀的 pH 值约为 0.7~1.0,比 Ln(OH)3 低得多。工业上分离铈利用 Ce(OH)4 与 Ln(OH)3 碱度的差别,控制 ph 约为 2.5,用稀硝酸可溶解 Ln(OH)3 而将 Ce(OH)4 留在沉淀 中。 与 Ce(III)转化为 Ce(IV)的条件不同,相反的转化往往在酸性介质中进行。酸性溶液中 的 Ce4+为强氧化剂,以铈(IV)盐溶液进行氧化还原滴定的方法叫铈量法,用铈量法测定 铁的反应为: Ce4++Fe2+=====Ce3++Fe3+ 铈量法的优点是:容易提纯 Ce(SO4)2·2(NH4)SO4·2H2O 配制标准溶液时可以直接称 量而不必用其他基准物标定;标准溶液可较长时间放置,加热煮沸也不易分解;与 KMnO4 法不同,可在 HCl 介质中滴定 Fe2+,这是因为稀 HCl 介质中 Ce4+与 Cl- 的反应缓慢,而且发 生在与 Fe2+反应完成之后;不生成中间氧化态,副反应少。 Ln3+离子中只有 Eu3+能被 Zn(锌粉、锌粒或锌汞齐)还原,还原反应为 2Eu3+(aq)+Zn(s)=====2Eu2+(aq)+Zn2+(aq) LnCl3•nH2O HCl,H HCl 2
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 无水氯化物是电解法制备金属的起始物。通常要在氯化氢气流中或 NH2Cl 存在下或真 空脱水的方法制备。NH4Cl 存在下抑制 LnOCl 生成的反应如下: Δ LnOCl+2NH4Cl======LnCl3+H2O+2NH3 从水溶液中析出的硫酸盐通常是水合硫酸盐,除硫酸铈为九水合物外,其余皆形成八水 合物 Ln2(SO4)·8H2O。硫酸盐的溶解度随温度升高而下降。 XLn2(SO4)3+yM2SO4+zH2O===xLn2(SO4)3·yM2SO4·zH2O 式中的 M 代表 Na+ 或 K+ 或 NH4 + ,碱金属硫酸盐浓度较低时,x,y,z 值分别为 1,1,2 或 1, 1,4。硫酸复盐的溶解度随原子序数的增大而增大,处理以镧、铈、镨、钕等为主的矿物时 利用硫酸复盐较低的溶解度与溶液中的大量 Fe3+分离。 水溶液中的 Ln3+离子与 H2C2O4 生成难溶于水的水合草酸盐 Ln2(C2O4)3·nH2O,一般情 况下 n=10,但也有 n=6,7,9 和 11 的。由于草酸盐在酸性溶液中也难溶,可使镧系元素与许 多其他金属离子分离开来。 3.Ce(IV)和 Eu(II)的化合物 与酸性介质相比,碱性环境实现 Ce(III)至 Ce(IV)的转化 容易得多。例如空气能将 Ln(III)溶液中沉淀出来的 Ln(OH3)k r OHC3 氧化为 Ce(OH)4: 4Ce(OH)3+O2+2H2O===4Ce(OH)4 白色 黄色 Ce(OH)4 开始沉淀的 pH 值约为 0.7~1.0,比 Ln(OH)3 低得多。工业上分离铈利用 Ce(OH)4 与 Ln(OH)3 碱度的差别,控制 ph 约为 2.5,用稀硝酸可溶解 Ln(OH)3 而将 Ce(OH)4 留在沉淀 中。 与 Ce(III)转化为 Ce(IV)的条件不同,相反的转化往往在酸性介质中进行。酸性溶液中 的 Ce4+为强氧化剂,以铈(IV)盐溶液进行氧化还原滴定的方法叫铈量法,用铈量法测定 铁的反应为: Ce4++Fe2+=====Ce3++Fe3+ 铈量法的优点是:容易提纯 Ce(SO4)2·2(NH4)SO4·2H2O 配制标准溶液时可以直接称 量而不必用其他基准物标定;标准溶液可较长时间放置,加热煮沸也不易分解;与 KMnO4 法不同,可在 HCl 介质中滴定 Fe2+,这是因为稀 HCl 介质中 Ce4+与 Cl- 的反应缓慢,而且发 生在与 Fe2+反应完成之后;不生成中间氧化态,副反应少。 Ln3+离子中只有 Eu3+能被 Zn(锌粉、锌粒或锌汞齐)还原,还原反应为 2Eu3+(aq)+Zn(s)=====2Eu2+(aq)+Zn2+(aq) LnCl3•nH2O HCl,H HCl 2

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 与 Eu3+相比,Eu2+(aq)与 Ln3+(aq)的分离要容易得多。Eu(OH)2 开始沉淀的 pH 值较 Ln(OH)3 高得多,以这种差别为基础的分离方法叫碱度法。 Eu2+离子表现出与碱土金属特别是与 Sr2+和 Ba2+离子相似的性质,例如 EuSO4 和 BaSO4 的溶解度都很小,而且属于类质同晶。碱度法分离后得到的 Eu2+溶液中加 BaCl2 和 Na2SO4 可使 EuSO4和 BaSO4 共沉淀,用稀 HNO3 洗涤时,沉淀中的 Eu2+被氧化至 Eu3+而进入溶液。 Eu2+(aq)亦可被 Fe3+(aq)氧化: Eu2+(aq)+Fe3+(aq)====Eu3+(aq)+Fe2+(aq) 该反应可用于 Eu2+的氧化还原滴定。以 NH4CNS 为指示剂,在过量 Fe3+存在时出现的红色 指示终点到达。 Eu2+空气中不稳定,分离和分析操作应在惰性气氛保护下进行。 4.配位化合物 与 d 区金属配合物相比较,镧系元素配合物表现出两个明显的特征: ★ 稀土离子的 4f 组态受外层全充满 5s 2 p 6 所屏蔽,故受配位场的影响小,配位 场稳定化能只有 4.18 kJ·mol-1 ,而 d 过渡元素 > 4.18 kJ·mol-1 。 ★ 与配体间的化学键主要是离子键。 ★ 特征配位原子是氧> 氮 >硫,而 d 过渡元素为氮 >硫>氧,或硫> 氮 >氧。 ★ 稀土离子的半径比较大,对配体的静电引力也较小,键强也较弱,并由于镧系 收缩,配合物的稳定常数一般随原子序数的增大而增大。 ★ 由于离子半径较大,配位数也较大。 ★ 由于配位数较大,故形成配合物的多面体也不同于 d 区金属配合物。 16.1.3 镧系元素的相互分离 (1) 分离方法 镧系元素因彼此性质相近而难以分离,致使单一化合物的价值曾经十分昂贵。溶剂萃 取法和离子交换法的出现从根本上改变了这种状况,这两种方法不但用于许多难分离元素 稀土元素分离方法的原理和特点 方 法 基 本 原 理 优 点 分级结晶法 溶解度不同 原理、设备简单 操作复杂、分离效果 差 分步沉淀法 溶度积不同 原理、设备简单 操作复杂、分离效果 差 氧化还原法 价态稳定性不同 原理、操作简单、 无非三价稳定态者不 可 化 学 分 离 离子交换法 与树脂、淋洗 分离效果很好、 周期长、成本高 剂结合不同 产品纯度高 溶剂萃取法 萃合物稳定性 分离效果良好、纯 某些试剂有毒 不同度 可满足要求
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 与 Eu3+相比,Eu2+(aq)与 Ln3+(aq)的分离要容易得多。Eu(OH)2 开始沉淀的 pH 值较 Ln(OH)3 高得多,以这种差别为基础的分离方法叫碱度法。 Eu2+离子表现出与碱土金属特别是与 Sr2+和 Ba2+离子相似的性质,例如 EuSO4 和 BaSO4 的溶解度都很小,而且属于类质同晶。碱度法分离后得到的 Eu2+溶液中加 BaCl2 和 Na2SO4 可使 EuSO4和 BaSO4 共沉淀,用稀 HNO3 洗涤时,沉淀中的 Eu2+被氧化至 Eu3+而进入溶液。 Eu2+(aq)亦可被 Fe3+(aq)氧化: Eu2+(aq)+Fe3+(aq)====Eu3+(aq)+Fe2+(aq) 该反应可用于 Eu2+的氧化还原滴定。以 NH4CNS 为指示剂,在过量 Fe3+存在时出现的红色 指示终点到达。 Eu2+空气中不稳定,分离和分析操作应在惰性气氛保护下进行。 4.配位化合物 与 d 区金属配合物相比较,镧系元素配合物表现出两个明显的特征: ★ 稀土离子的 4f 组态受外层全充满 5s 2 p 6 所屏蔽,故受配位场的影响小,配位 场稳定化能只有 4.18 kJ·mol-1 ,而 d 过渡元素 > 4.18 kJ·mol-1 。 ★ 与配体间的化学键主要是离子键。 ★ 特征配位原子是氧> 氮 >硫,而 d 过渡元素为氮 >硫>氧,或硫> 氮 >氧。 ★ 稀土离子的半径比较大,对配体的静电引力也较小,键强也较弱,并由于镧系 收缩,配合物的稳定常数一般随原子序数的增大而增大。 ★ 由于离子半径较大,配位数也较大。 ★ 由于配位数较大,故形成配合物的多面体也不同于 d 区金属配合物。 16.1.3 镧系元素的相互分离 (1) 分离方法 镧系元素因彼此性质相近而难以分离,致使单一化合物的价值曾经十分昂贵。溶剂萃 取法和离子交换法的出现从根本上改变了这种状况,这两种方法不但用于许多难分离元素 稀土元素分离方法的原理和特点 方 法 基 本 原 理 优 点 分级结晶法 溶解度不同 原理、设备简单 操作复杂、分离效果 差 分步沉淀法 溶度积不同 原理、设备简单 操作复杂、分离效果 差 氧化还原法 价态稳定性不同 原理、操作简单、 无非三价稳定态者不 可 化 学 分 离 离子交换法 与树脂、淋洗 分离效果很好、 周期长、成本高 剂结合不同 产品纯度高 溶剂萃取法 萃合物稳定性 分离效果良好、纯 某些试剂有毒 不同度 可满足要求
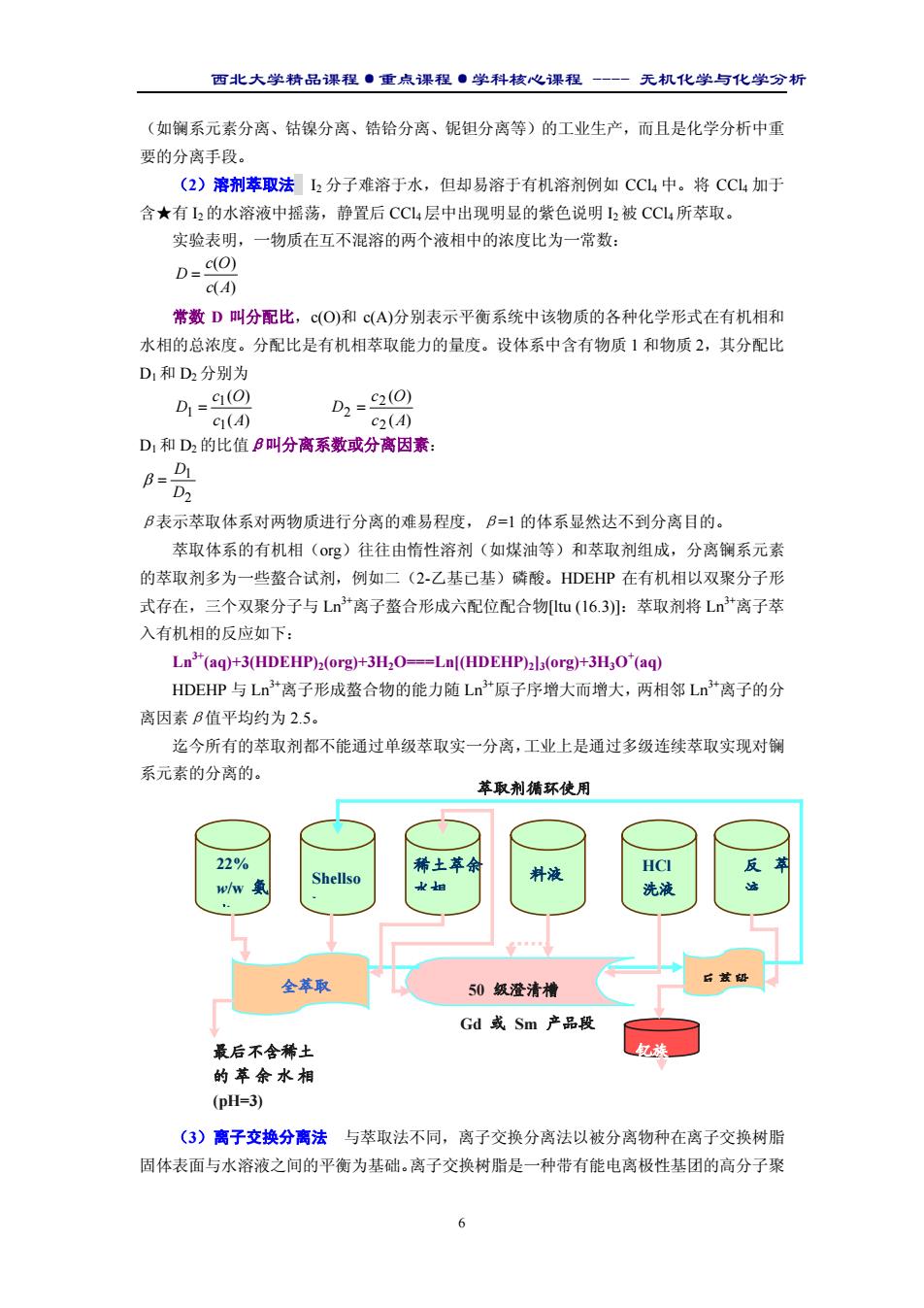
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 (如镧系元素分离、钴镍分离、锆铪分离、铌钽分离等)的工业生产,而且是化学分析中重 要的分离手段。 (2)溶剂萃取法 I2 分子难溶于水,但却易溶于有机溶剂例如 CCl4 中。将 CCl4 加于 含★有 I2 的水溶液中摇荡,静置后 CCl4 层中出现明显的紫色说明 I2 被 CCl4 所萃取。 实验表明,一物质在互不混溶的两个液相中的浓度比为一常数: ( ) ( ) c A c O D = 常数 D 叫分配比,c(O)和 c(A)分别表示平衡系统中该物质的各种化学形式在有机相和 水相的总浓度。分配比是有机相萃取能力的量度。设体系中含有物质 1 和物质 2,其分配比 D1 和 D2 分别为 ( ) ( ) 1 1 1 c A c O D = ( ) ( ) 2 2 2 c A c O D = D1 和 D2 的比值β叫分离系数或分离因素: 2 1 D D β = β表示萃取体系对两物质进行分离的难易程度,β=1 的体系显然达不到分离目的。 萃取体系的有机相(org)往往由惰性溶剂(如煤油等)和萃取剂组成,分离镧系元素 的萃取剂多为一些螯合试剂,例如二(2-乙基已基)磷酸。HDEHP 在有机相以双聚分子形 式存在,三个双聚分子与 Ln3+离子螯合形成六配位配合物[ltu (16.3)]:萃取剂将 Ln3+离子萃 入有机相的反应如下: Ln3+(aq)+3(HDEHP)2(org)+3H2O===Ln[(HDEHP)2]3(org)+3H3O+ (aq) HDEHP 与 Ln3+离子形成螯合物的能力随 Ln3+原子序增大而增大,两相邻 Ln3+离子的分 离因素β值平均约为 2.5。 迄今所有的萃取剂都不能通过单级萃取实一分离,工业上是通过多级连续萃取实现对镧 系元素的分离的。 (3)离子交换分离法 与萃取法不同,离子交换分离法以被分离物种在离子交换树脂 固体表面与水溶液之间的平衡为基础。离子交换树脂是一种带有能电离极性基团的高分子聚 22% w/w 氨 水 Shellso l 稀土萃余 水相 料液 HCl 洗液 反 萃 液 全萃取 50 级澄清槽 Gd 或 Sm 产品段 最后不含稀土 的萃余水相 (pH=3) 钇族 反萃段 萃取剂循环使用
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 (如镧系元素分离、钴镍分离、锆铪分离、铌钽分离等)的工业生产,而且是化学分析中重 要的分离手段。 (2)溶剂萃取法 I2 分子难溶于水,但却易溶于有机溶剂例如 CCl4 中。将 CCl4 加于 含★有 I2 的水溶液中摇荡,静置后 CCl4 层中出现明显的紫色说明 I2 被 CCl4 所萃取。 实验表明,一物质在互不混溶的两个液相中的浓度比为一常数: ( ) ( ) c A c O D = 常数 D 叫分配比,c(O)和 c(A)分别表示平衡系统中该物质的各种化学形式在有机相和 水相的总浓度。分配比是有机相萃取能力的量度。设体系中含有物质 1 和物质 2,其分配比 D1 和 D2 分别为 ( ) ( ) 1 1 1 c A c O D = ( ) ( ) 2 2 2 c A c O D = D1 和 D2 的比值β叫分离系数或分离因素: 2 1 D D β = β表示萃取体系对两物质进行分离的难易程度,β=1 的体系显然达不到分离目的。 萃取体系的有机相(org)往往由惰性溶剂(如煤油等)和萃取剂组成,分离镧系元素 的萃取剂多为一些螯合试剂,例如二(2-乙基已基)磷酸。HDEHP 在有机相以双聚分子形 式存在,三个双聚分子与 Ln3+离子螯合形成六配位配合物[ltu (16.3)]:萃取剂将 Ln3+离子萃 入有机相的反应如下: Ln3+(aq)+3(HDEHP)2(org)+3H2O===Ln[(HDEHP)2]3(org)+3H3O+ (aq) HDEHP 与 Ln3+离子形成螯合物的能力随 Ln3+原子序增大而增大,两相邻 Ln3+离子的分 离因素β值平均约为 2.5。 迄今所有的萃取剂都不能通过单级萃取实一分离,工业上是通过多级连续萃取实现对镧 系元素的分离的。 (3)离子交换分离法 与萃取法不同,离子交换分离法以被分离物种在离子交换树脂 固体表面与水溶液之间的平衡为基础。离子交换树脂是一种带有能电离极性基团的高分子聚 22% w/w 氨 水 Shellso l 稀土萃余 水相 料液 HCl 洗液 反 萃 液 全萃取 50 级澄清槽 Gd 或 Sm 产品段 最后不含稀土 的萃余水相 (pH=3) 钇族 反萃段 萃取剂循环使用

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 合物,其极性基团能与溶液中的离子起交换作用而称之为活性基。根据不同的活性基团将离 子交换树脂分为阳离子型和阴离子型两大类型。阳离子型树脂的活性基为横酸基时叫做强酸 型树脂(R-SO3H),若为羧酸基或酚基时则叫做弱酸型树脂(R-COOH)。阴离子树脂的活 性基团为碱性基团,为季胺基时称强碱型树脂(R-NX3),若为伯、仲、叔胺基时则称为弱 碱型树脂(R-NH2) 。 ( ) ( ) ( ) ( ) − − − − 2 3 3 R NH R NX R COOH R SO H 弱碱型阴离子交换树脂 强碱型阴离子交换树脂 阴离子型 弱酸型阳离子交换树脂 强酸型阳离子交换树脂 阳离子型 离子交换树脂 分离镧系元素采用强酸型阳离子交换树指,通常用 NH4Cl 溶液将其转化为铵型使用: R—SO3H+NH4 + +H2O→ RSO3NH4+H3O+ 分离操作包括吸附和淋洗两步:先将含有待分离 Ln3+(aq)离子的溶液注至离子交换柱 顶部并让其缓缓流经柱体,Ln3+离子置换树脂相(res)中的 NH4 + 离子,在柱上部形成 Ln3+ 离子吸附带。然后用淋洗剂(含阴离子孙螯合剂如柠檬酸盐,EDTA 等)缓慢流过柱体,淋 洗过程中 Ln3+离子与阴离子螯合配体形成电荷较 Ln3+离子而进入溶液,树脂表面 Ln3+的位 置重新被溶液中的 NH4 + 占据。 吸附过程:Ln3+(aq)+3NH4 + (res)====Ln3+(res)+3NH4 + (aq) 淋洗过程:Ln3+(res)+RCOO- +3NH4 + (aq)====3NH4 + (res)+Ln(RCOO)3(aq) 半径越小的 Ln3+离子与配位阴离子形成的螯合物越稳定,因而转入水溶液的趋势也越大。 淋洗中交替发生着无数次这种吸附与解吸附过程,导致小半径的 Ln3+离子先于大半径的 Ln3+ 离子出现在流出液中。 16.1.4 存在、提取和应用 以2-羟基异丁酸铵为淋洗剂时重镧系元素的流出顺
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 合物,其极性基团能与溶液中的离子起交换作用而称之为活性基。根据不同的活性基团将离 子交换树脂分为阳离子型和阴离子型两大类型。阳离子型树脂的活性基为横酸基时叫做强酸 型树脂(R-SO3H),若为羧酸基或酚基时则叫做弱酸型树脂(R-COOH)。阴离子树脂的活 性基团为碱性基团,为季胺基时称强碱型树脂(R-NX3),若为伯、仲、叔胺基时则称为弱 碱型树脂(R-NH2) 。 ( ) ( ) ( ) ( ) − − − − 2 3 3 R NH R NX R COOH R SO H 弱碱型阴离子交换树脂 强碱型阴离子交换树脂 阴离子型 弱酸型阳离子交换树脂 强酸型阳离子交换树脂 阳离子型 离子交换树脂 分离镧系元素采用强酸型阳离子交换树指,通常用 NH4Cl 溶液将其转化为铵型使用: R—SO3H+NH4 + +H2O→ RSO3NH4+H3O+ 分离操作包括吸附和淋洗两步:先将含有待分离 Ln3+(aq)离子的溶液注至离子交换柱 顶部并让其缓缓流经柱体,Ln3+离子置换树脂相(res)中的 NH4 + 离子,在柱上部形成 Ln3+ 离子吸附带。然后用淋洗剂(含阴离子孙螯合剂如柠檬酸盐,EDTA 等)缓慢流过柱体,淋 洗过程中 Ln3+离子与阴离子螯合配体形成电荷较 Ln3+离子而进入溶液,树脂表面 Ln3+的位 置重新被溶液中的 NH4 + 占据。 吸附过程:Ln3+(aq)+3NH4 + (res)====Ln3+(res)+3NH4 + (aq) 淋洗过程:Ln3+(res)+RCOO- +3NH4 + (aq)====3NH4 + (res)+Ln(RCOO)3(aq) 半径越小的 Ln3+离子与配位阴离子形成的螯合物越稳定,因而转入水溶液的趋势也越大。 淋洗中交替发生着无数次这种吸附与解吸附过程,导致小半径的 Ln3+离子先于大半径的 Ln3+ 离子出现在流出液中。 16.1.4 存在、提取和应用 以2-羟基异丁酸铵为淋洗剂时重镧系元素的流出顺

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 ★ 存在 钇在自然界与镧系元素共生。由于 Y3+离子半径处于 Ho3+与 Er3+之间,因而 主要与重镧系元素形成共生矿。 镧系元素在地壳中的存在呈奇偶变化规律,符合 Oddo-Harkins 规则。 世界上稀土储量的 80% 在我国,有三大矿:包头、攀枝花、江西。我国稀土矿有五大 特点:1. 储量大;2.品种全;3.品位高;4.多种金属矿物伴生;5.综合利用价值大。 ★ 提取 从矿中提取稀土分三个步骤: 1. 分解精矿,有火法和湿法,湿法又有酸法和碱法 2. 分离提纯,稀土与非稀土元素和稀土元素之间 3. 制备金属 酸法分解制取镧系元素氯化物的流程大体如下: 1.浓 H2SO4 与精矿高温焙烧使之转化为镧系元素的可溶性硫酸盐: Δ 2LnCO3F+3H2SO4=====Ln2(SO4)3+2CO2+2HF+2H2O 2.于焙烧产物的水浸液中加入 Na2SO4 使 Ln3+以硫酸复盐形式沉淀,以便与铁等大量 非镧系杂质分离(反应见前)。 3.将复盐转化为氢氧化物,转化过程中部分 Ce(OH)3 被氧化为 Ce(OH)4: Ln2(SO4)3·Na2SO4+6NaOH====2Ln(OH)3+4Na2SO4 4.盐酸溶解后的氯化物溶液浓缩结晶得产品。 ★ 应用 镧系元素在许多领域有着广泛的用途。这些领域涉及钢铁工业(例如制造球墨 铸铁)、石油工业(分子筛石油裂化催化剂)、玻璃工业(制造这特种玻璃和光学玻 璃,用做抛光材料,脱色剂和着色剂等)、陶瓷工业(如用做陶瓷颜料等)、制造磁 性材料(例如钕铁硼永磁体 Fe77Nd15B8,钐钴合金 SmCo5)、荧光材料(如彩色电机 荧光粉)等。镧系元素在诸多领域的应用正在开发研究之中,其中包括在农业和医 药上的应用。 16.2 锕系元素简介 1. 所有锕系元素都具有放射性。 提到放射性,我们就会想到玛丽·居里(Marie S.Curie) , 有代表性的稀土矿物 名 称 主要化学组成 说明 独 居 石 (Ln,Th)PO4 Ln 主要代表 La,Ce 等轻稀土元素 氟碳铈镧矿 LnCO3F Ln 主要代表 La,Ce 等轻稀土元素 磷 钇 矿 YPO4 除 YPO4 外,还含有重镧系元素磷酸盐
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 ★ 存在 钇在自然界与镧系元素共生。由于 Y3+离子半径处于 Ho3+与 Er3+之间,因而 主要与重镧系元素形成共生矿。 镧系元素在地壳中的存在呈奇偶变化规律,符合 Oddo-Harkins 规则。 世界上稀土储量的 80% 在我国,有三大矿:包头、攀枝花、江西。我国稀土矿有五大 特点:1. 储量大;2.品种全;3.品位高;4.多种金属矿物伴生;5.综合利用价值大。 ★ 提取 从矿中提取稀土分三个步骤: 1. 分解精矿,有火法和湿法,湿法又有酸法和碱法 2. 分离提纯,稀土与非稀土元素和稀土元素之间 3. 制备金属 酸法分解制取镧系元素氯化物的流程大体如下: 1.浓 H2SO4 与精矿高温焙烧使之转化为镧系元素的可溶性硫酸盐: Δ 2LnCO3F+3H2SO4=====Ln2(SO4)3+2CO2+2HF+2H2O 2.于焙烧产物的水浸液中加入 Na2SO4 使 Ln3+以硫酸复盐形式沉淀,以便与铁等大量 非镧系杂质分离(反应见前)。 3.将复盐转化为氢氧化物,转化过程中部分 Ce(OH)3 被氧化为 Ce(OH)4: Ln2(SO4)3·Na2SO4+6NaOH====2Ln(OH)3+4Na2SO4 4.盐酸溶解后的氯化物溶液浓缩结晶得产品。 ★ 应用 镧系元素在许多领域有着广泛的用途。这些领域涉及钢铁工业(例如制造球墨 铸铁)、石油工业(分子筛石油裂化催化剂)、玻璃工业(制造这特种玻璃和光学玻 璃,用做抛光材料,脱色剂和着色剂等)、陶瓷工业(如用做陶瓷颜料等)、制造磁 性材料(例如钕铁硼永磁体 Fe77Nd15B8,钐钴合金 SmCo5)、荧光材料(如彩色电机 荧光粉)等。镧系元素在诸多领域的应用正在开发研究之中,其中包括在农业和医 药上的应用。 16.2 锕系元素简介 1. 所有锕系元素都具有放射性。 提到放射性,我们就会想到玛丽·居里(Marie S.Curie) , 有代表性的稀土矿物 名 称 主要化学组成 说明 独 居 石 (Ln,Th)PO4 Ln 主要代表 La,Ce 等轻稀土元素 氟碳铈镧矿 LnCO3F Ln 主要代表 La,Ce 等轻稀土元素 磷 钇 矿 YPO4 除 YPO4 外,还含有重镧系元素磷酸盐

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 法籍波兰人(1867-1934) ,是举世闻名的女科学家,两次诺贝尔奖金获得者. 2. 氧化态不再单一。 3. 镧系收缩相似,随着原子序数的递增,锕系元素的离子半径递减; 4. 仍然采用离子交换法分离 锕系元素的配位化学保持了镧系元素的某些特征,也显示出某些重要差别。锕系元素也 显示出高配位数,例如钍的常见配位数为 8,钍的最重要氧化物 ThO2 为莹石结构,其中 O2- 离子围绕 Th(IV)排布在立方体的 8 个顶解上。[Th(NO3)4(OPPh3)2]中 Th 的配位数为 10,4 个 NO3 - 都是双齿配位体,6 个配位体围绕中心原子排布在八面体顶角。硝酸铀酰二水合物中 8 个氧原子与 U 原子配位,其中两个 H2O 分子的配位羼朱子和两个 NO3 - 的四个配位氧原子处 于同一平面,OUO 垂直于该平面: 最稳定氧化态 溶液内不存在 +2 +3 +4 +5 +6 +7 57 59 61 63 65 67 原子序数 离 子 半 径 /p m 11 10 10 9 9 8 8 锕系+3 镧系+3 锕系+4 89 91 93 95 以2-羟基异丁酸铵为淋洗剂时重镧系元素的流出顺序
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 法籍波兰人(1867-1934) ,是举世闻名的女科学家,两次诺贝尔奖金获得者. 2. 氧化态不再单一。 3. 镧系收缩相似,随着原子序数的递增,锕系元素的离子半径递减; 4. 仍然采用离子交换法分离 锕系元素的配位化学保持了镧系元素的某些特征,也显示出某些重要差别。锕系元素也 显示出高配位数,例如钍的常见配位数为 8,钍的最重要氧化物 ThO2 为莹石结构,其中 O2- 离子围绕 Th(IV)排布在立方体的 8 个顶解上。[Th(NO3)4(OPPh3)2]中 Th 的配位数为 10,4 个 NO3 - 都是双齿配位体,6 个配位体围绕中心原子排布在八面体顶角。硝酸铀酰二水合物中 8 个氧原子与 U 原子配位,其中两个 H2O 分子的配位羼朱子和两个 NO3 - 的四个配位氧原子处 于同一平面,OUO 垂直于该平面: 最稳定氧化态 溶液内不存在 +2 +3 +4 +5 +6 +7 57 59 61 63 65 67 原子序数 离 子 半 径 /p m 11 10 10 9 9 8 8 锕系+3 镧系+3 锕系+4 89 91 93 95 以2-羟基异丁酸铵为淋洗剂时重镧系元素的流出顺序

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 差别主要表现在成键作用上。镧系元素的 f 轨道参与成键的能力很弱,但高氧化态的锕 系元素则不同。高氧化态原子形成 AnO2 2+离子(An=U,Np,Pu,Am),两个配位氧原子在所有 配合物中均与 An 处在一条直线上[见图(16.5)]。这一事实是 f 轨道参与成键的强烈暗示, 作为这种暗示的另一个事实是,锕系元素配合物的光谱随配位体的不同而发生较大变化。 大多数锕系元素(特别是 Am 之后的元素)具有较强的放射性而且不易得到,有关化学 性质的研究是在微克量级甚至数百个原子的量级上进行的。铀和钍的放射性相对比较低而且 可以大量制备,因而可按一般的实验方法进行操作(当然要采取防护措施)。 钍在水溶液中唯一稳定的氧化态是+4。Th(IV)没有氧化性,从这个角度看,它不像镧系 元素中位置相对应的 Ce,而更像第 4 族的 Zr 与 Hf。 金属铀表面不形成保护性氧化膜,在空气中长期放置生成多种氧化物的混合物。最重要 的氧化物是 UO3,UO3 溶于酸生成铀酰离子 UO2 2+。在水中,这一黄绿色的离子能与许我配 体(如 NO3 - ,SO4 2-)形成稳定配合物,工业上正是利用电中性的铀酰配合物[UO2(NO3)2 (H2O)4]在有机溶剂中的可溶性,通过溶剂萃取的方法将铀与其他元素分离的。溶剂萃取 的方法也用于将锕系元素与核废料中的其他裂变产物相分离
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 差别主要表现在成键作用上。镧系元素的 f 轨道参与成键的能力很弱,但高氧化态的锕 系元素则不同。高氧化态原子形成 AnO2 2+离子(An=U,Np,Pu,Am),两个配位氧原子在所有 配合物中均与 An 处在一条直线上[见图(16.5)]。这一事实是 f 轨道参与成键的强烈暗示, 作为这种暗示的另一个事实是,锕系元素配合物的光谱随配位体的不同而发生较大变化。 大多数锕系元素(特别是 Am 之后的元素)具有较强的放射性而且不易得到,有关化学 性质的研究是在微克量级甚至数百个原子的量级上进行的。铀和钍的放射性相对比较低而且 可以大量制备,因而可按一般的实验方法进行操作(当然要采取防护措施)。 钍在水溶液中唯一稳定的氧化态是+4。Th(IV)没有氧化性,从这个角度看,它不像镧系 元素中位置相对应的 Ce,而更像第 4 族的 Zr 与 Hf。 金属铀表面不形成保护性氧化膜,在空气中长期放置生成多种氧化物的混合物。最重要 的氧化物是 UO3,UO3 溶于酸生成铀酰离子 UO2 2+。在水中,这一黄绿色的离子能与许我配 体(如 NO3 - ,SO4 2-)形成稳定配合物,工业上正是利用电中性的铀酰配合物[UO2(NO3)2 (H2O)4]在有机溶剂中的可溶性,通过溶剂萃取的方法将铀与其他元素分离的。溶剂萃取 的方法也用于将锕系元素与核废料中的其他裂变产物相分离