
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 15 章 d 区元素 Chapter 15 d Block 教学要求 1.了解 d 区元素的通性,即 d 电子化学的特征; 2.掌握钛单质、TiO2、TiCl4 的性质和制备,钛合金的应用; 3.掌握铬单质的特性与制备,三价铬与六价铬的转变; 4.了解钼和钨的简单化合物及同多酸、杂多酸的概念; 5.掌握从软锰矿制备单质锰,锰的变价及其氧化性; 6.了解铁、钴、镍氧化还原性变化规律,掌握其氧化物和氢氧化物性质; 7.掌握铜单质及其常见化合物,着重了解其歧化反应; 8.了解锌、镉、汞的单质及重要化合物。 课时分配(9 学时) 1. d 区元素的通性:(1 学时) 2. 金属钛及其化合物:(1 学时) 3. 金属铬及其化合物:(1 学时) 4. 钼和钨:(1 学时) 5. 锰及其化合物:(1 学时) 6. 铁、钴、镍及其化合物:(1 学时) 7. 铜及其化合物:(1 学时) 8. 钼及其化合物:(1 学时) 9. 锌、镉、汞及其化合物:(1 学时) d 区元素包括第 3 族至第 12 族共 40 种金属元素,以电子填充次外层 d 轨道为特征。第 4、第 5 和第 6 各周期的 10 种元素分别又叫第一过渡系元素(由 Sc 至 Zn)、第二过渡系元素(由 Y 至 Cd)和第 三过渡系元素(由 La 至 Hg),电子分别填充在 3d 亚层、4d 亚层和 5d 亚层上。德国科学家 1996 年 2 月宣布发现 112 号元素,使第四过渡系的空格终于被填满
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 1 第 15 章 d 区元素 Chapter 15 d Block 教学要求 1.了解 d 区元素的通性,即 d 电子化学的特征; 2.掌握钛单质、TiO2、TiCl4 的性质和制备,钛合金的应用; 3.掌握铬单质的特性与制备,三价铬与六价铬的转变; 4.了解钼和钨的简单化合物及同多酸、杂多酸的概念; 5.掌握从软锰矿制备单质锰,锰的变价及其氧化性; 6.了解铁、钴、镍氧化还原性变化规律,掌握其氧化物和氢氧化物性质; 7.掌握铜单质及其常见化合物,着重了解其歧化反应; 8.了解锌、镉、汞的单质及重要化合物。 课时分配(9 学时) 1. d 区元素的通性:(1 学时) 2. 金属钛及其化合物:(1 学时) 3. 金属铬及其化合物:(1 学时) 4. 钼和钨:(1 学时) 5. 锰及其化合物:(1 学时) 6. 铁、钴、镍及其化合物:(1 学时) 7. 铜及其化合物:(1 学时) 8. 钼及其化合物:(1 学时) 9. 锌、镉、汞及其化合物:(1 学时) d 区元素包括第 3 族至第 12 族共 40 种金属元素,以电子填充次外层 d 轨道为特征。第 4、第 5 和第 6 各周期的 10 种元素分别又叫第一过渡系元素(由 Sc 至 Zn)、第二过渡系元素(由 Y 至 Cd)和第 三过渡系元素(由 La 至 Hg),电子分别填充在 3d 亚层、4d 亚层和 5d 亚层上。德国科学家 1996 年 2 月宣布发现 112 号元素,使第四过渡系的空格终于被填满

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 本章先介绍 d 区元素的通性,接着介绍第一过渡系的 7 种普通元素(Ti、Cr、Mn、Fe、Co、 Ni 和 Cu)以及第 6 族的两种稀有金属 Mo 和 W。它们的物理和化学性质具有代表性,其应用范围也 是最广的。贵金属有效的催化性能和第 12 族元素性质的特殊性促使我们单独作讨论。 15.1 通性 d 区元素显示出许多区别于主族元素的性质: ● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物 和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强 d 区元素所有这些特征不同程度上与价层 d 电子的存在有关,因而有人将 d 区元素的化学归结为 d 电子的化学. 15.1.1 金属单质的物理性质 ★ 原子的价电子层构型 (n-1)d1-10ns1-2★ 原子半径和电离能(要注意其变化规律)★ 金属单 质的物理性质:●熔点、沸点高 ●硬度大 ●密度大 ●导电性,导热性,延展性好★ 原子化焓集 中地反映了单质的物理性质,下表给出 d 区金属的原子化焓。 过渡金属的原子化焓一般高于主族金属元素,原子化焓特高的那些元素处于第二、第三过渡系 中部,而钨则是所有金属中最高的。金属钨由于在高温下挥发得极慢而被用作灯丝材料。Zn,Cd, Hg 明显不同于其他过渡元素,原子化焓接近于碱金属。Hg 和 Na 的蒸气被用于荧光灯(即日光灯)和 路灯。 原子化焓是金属内部原子间结合力强弱的一种标志,较高的原子化焓可能是由于较多的价电子 (特别是较多的未成对 d 电子)参与形成金属键。这种结合力似乎也应当反映在其他性质上,例如熔点 (℃)最高的 10 种 d 区金属也处于第二、第三过渡系中部。 Zr Nb Mo Tc Ru Rh 2 125±2 2 741±10 2 890 2 445 2 583 2 239±3 Hf Ta W Re Os Ir 2 500±20 3 269 3 683±20 3 453 3 318±30 2 683 381 470 515 397 285 415 423 422 339 131 420 593 752 659 661 650 558 373 285 112 431 789 782 851 778 790 669 565 368 61
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 2 本章先介绍 d 区元素的通性,接着介绍第一过渡系的 7 种普通元素(Ti、Cr、Mn、Fe、Co、 Ni 和 Cu)以及第 6 族的两种稀有金属 Mo 和 W。它们的物理和化学性质具有代表性,其应用范围也 是最广的。贵金属有效的催化性能和第 12 族元素性质的特殊性促使我们单独作讨论。 15.1 通性 d 区元素显示出许多区别于主族元素的性质: ● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物 和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强 d 区元素所有这些特征不同程度上与价层 d 电子的存在有关,因而有人将 d 区元素的化学归结为 d 电子的化学. 15.1.1 金属单质的物理性质 ★ 原子的价电子层构型 (n-1)d1-10ns1-2★ 原子半径和电离能(要注意其变化规律)★ 金属单 质的物理性质:●熔点、沸点高 ●硬度大 ●密度大 ●导电性,导热性,延展性好★ 原子化焓集 中地反映了单质的物理性质,下表给出 d 区金属的原子化焓。 过渡金属的原子化焓一般高于主族金属元素,原子化焓特高的那些元素处于第二、第三过渡系 中部,而钨则是所有金属中最高的。金属钨由于在高温下挥发得极慢而被用作灯丝材料。Zn,Cd, Hg 明显不同于其他过渡元素,原子化焓接近于碱金属。Hg 和 Na 的蒸气被用于荧光灯(即日光灯)和 路灯。 原子化焓是金属内部原子间结合力强弱的一种标志,较高的原子化焓可能是由于较多的价电子 (特别是较多的未成对 d 电子)参与形成金属键。这种结合力似乎也应当反映在其他性质上,例如熔点 (℃)最高的 10 种 d 区金属也处于第二、第三过渡系中部。 Zr Nb Mo Tc Ru Rh 2 125±2 2 741±10 2 890 2 445 2 583 2 239±3 Hf Ta W Re Os Ir 2 500±20 3 269 3 683±20 3 453 3 318±30 2 683 381 470 515 397 285 415 423 422 339 131 420 593 752 659 661 650 558 373 285 112 431 789 782 851 778 790 669 565 368 61

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 15.1.2 无机颜料和化合物的颜色 1. 无机颜料 颜料(pigments)是指不溶解于粘合剂, 而只能以微粒状态分散于其中的着色剂。 例如: 可溶于粘合剂的着色剂则叫染料(dyes),例如:活性艳红 X-3B , 枣红色粉末,溶于水呈蓝光红色溶液.主要用于棉布、丝绸的染色, 色光艳亮,但牢度欠佳. 形成有色化合物是 d 区元素的一个重要特征,这一特征使 d 区元素化合物成为最重要的无机 颜料。更准确地说,那些最重要的无机颜料大都是 d 区元素化合物。下面列出一些重要的颜料和它 们的化学组成. 白色: 钛白 锌白 锌钡白 硫化锌 TiO2 ZnO ZnS/BaSO4 ZnS 红色: 镉红 钼红 红铅粉 红色氧化铁 CdS/CdSe Pb(Cr,Mo,S)O4 Pb3O4 α-Fe2O3 黄色: 镉黄 铬黄 铬锑钛黄 黄色氧化铁 CdS PbCrO4或 Pb(Cr,S)O4 (Ti,Cr,Sb)O2 α-FeO(OH) 绿色: 氧化铬绿 尖晶石绿 Cr2O3 (Co,Ni,Zn)2O4 2. 化合物的颜色与 d-d 电子跃迁 几种二价金属水合离子 M2+(aq)的颜色与这种跃迁有关: M2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+ 颜色 粉色 浅绿色 酒红色 绿色 蓝色 无色 电子在跃迁过程中吸收了某种波长的可见光, 人们看到的是被吸收光的互补色。由于 3d 亚层全满, Zn2+(aq)不发生 d-d 跃迁,其水溶液为无色;Mn2+(aq)的颜色较浅, 反映了半满 3d 亚层的相对稳定性。 Yellow lead chromate N N N N=N NaSO3S HO HN Cl SO3Na Cl 颜色的互补 青 红 黄 橙 绿 紫 青蓝 白光 蓝
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 3 15.1.2 无机颜料和化合物的颜色 1. 无机颜料 颜料(pigments)是指不溶解于粘合剂, 而只能以微粒状态分散于其中的着色剂。 例如: 可溶于粘合剂的着色剂则叫染料(dyes),例如:活性艳红 X-3B , 枣红色粉末,溶于水呈蓝光红色溶液.主要用于棉布、丝绸的染色, 色光艳亮,但牢度欠佳. 形成有色化合物是 d 区元素的一个重要特征,这一特征使 d 区元素化合物成为最重要的无机 颜料。更准确地说,那些最重要的无机颜料大都是 d 区元素化合物。下面列出一些重要的颜料和它 们的化学组成. 白色: 钛白 锌白 锌钡白 硫化锌 TiO2 ZnO ZnS/BaSO4 ZnS 红色: 镉红 钼红 红铅粉 红色氧化铁 CdS/CdSe Pb(Cr,Mo,S)O4 Pb3O4 α-Fe2O3 黄色: 镉黄 铬黄 铬锑钛黄 黄色氧化铁 CdS PbCrO4或 Pb(Cr,S)O4 (Ti,Cr,Sb)O2 α-FeO(OH) 绿色: 氧化铬绿 尖晶石绿 Cr2O3 (Co,Ni,Zn)2O4 2. 化合物的颜色与 d-d 电子跃迁 几种二价金属水合离子 M2+(aq)的颜色与这种跃迁有关: M2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+ 颜色 粉色 浅绿色 酒红色 绿色 蓝色 无色 电子在跃迁过程中吸收了某种波长的可见光, 人们看到的是被吸收光的互补色。由于 3d 亚层全满, Zn2+(aq)不发生 d-d 跃迁,其水溶液为无色;Mn2+(aq)的颜色较浅, 反映了半满 3d 亚层的相对稳定性。 Yellow lead chromate N N N N=N NaSO3S HO HN Cl SO3Na Cl 颜色的互补 青 红 黄 橙 绿 紫 青蓝 白光 蓝
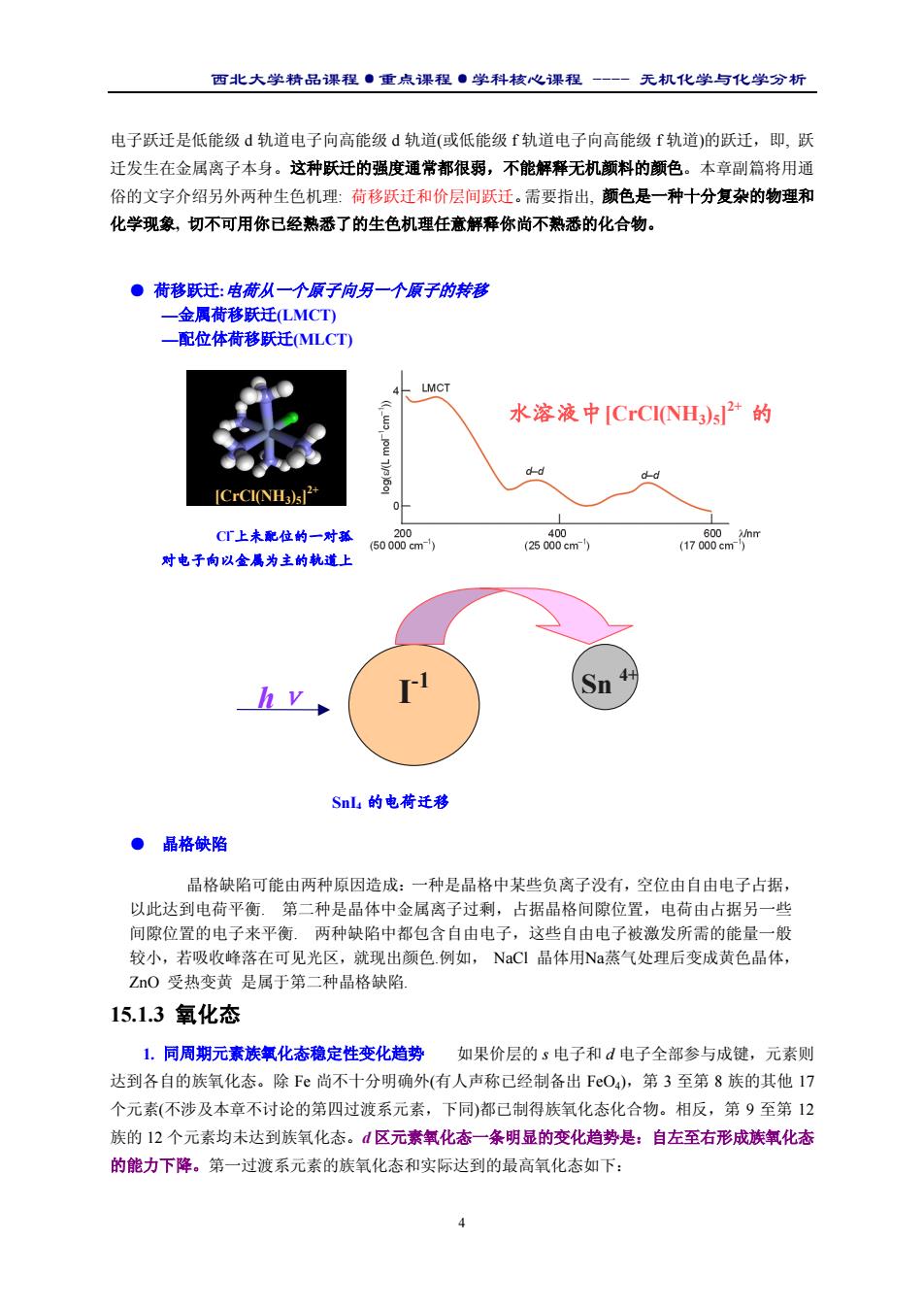
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 电子跃迁是低能级 d 轨道电子向高能级 d 轨道(或低能级 f 轨道电子向高能级 f 轨道)的跃迁,即, 跃 迁发生在金属离子本身。这种跃迁的强度通常都很弱,不能解释无机颜料的颜色。本章副篇将用通 俗的文字介绍另外两种生色机理: 荷移跃迁和价层间跃迁。需要指出, 颜色是一种十分复杂的物理和 化学现象, 切不可用你已经熟悉了的生色机理任意解释你尚不熟悉的化合物。 15.1.3 氧化态 1. 同周期元素族氧化态稳定性变化趋势 如果价层的 s 电子和 d 电子全部参与成键,元素则 达到各自的族氧化态。除 Fe 尚不十分明确外(有人声称已经制备出 FeO4),第 3 至第 8 族的其他 17 个元素(不涉及本章不讨论的第四过渡系元素,下同)都已制得族氧化态化合物。相反,第 9 至第 12 族的 12 个元素均未达到族氧化态。d 区元素氧化态一条明显的变化趋势是:自左至右形成族氧化态 的能力下降。第一过渡系元素的族氧化态和实际达到的最高氧化态如下: ● 荷移跃迁:电荷从一个原子向另一个原子的转移 —金属荷移跃迁(LMCT) 金属—配位体荷移跃迁(MLCT) Cl- 上未配位的一对孤 对电子向以金属为主的轨道上 水溶液中[CrCl(NH3)5] 2+ 的 [CrCl(NH3)5] 2+ SnI4 的电荷迁移 I -1 hν Sn 4+ ● 晶格缺陷 晶格缺陷可能由两种原因造成:一种是晶格中某些负离子没有,空位由自由电子占据, 以此达到电荷平衡. 第二种是晶体中金属离子过剩,占据晶格间隙位置,电荷由占据另一些 间隙位置的电子来平衡. 两种缺陷中都包含自由电子,这些自由电子被激发所需的能量一般 较小,若吸收峰落在可见光区,就现出颜色.例如, NaCl 晶体用Na蒸气处理后变成黄色晶体, ZnO 受热变黄 是属于第二种晶格缺陷
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 4 电子跃迁是低能级 d 轨道电子向高能级 d 轨道(或低能级 f 轨道电子向高能级 f 轨道)的跃迁,即, 跃 迁发生在金属离子本身。这种跃迁的强度通常都很弱,不能解释无机颜料的颜色。本章副篇将用通 俗的文字介绍另外两种生色机理: 荷移跃迁和价层间跃迁。需要指出, 颜色是一种十分复杂的物理和 化学现象, 切不可用你已经熟悉了的生色机理任意解释你尚不熟悉的化合物。 15.1.3 氧化态 1. 同周期元素族氧化态稳定性变化趋势 如果价层的 s 电子和 d 电子全部参与成键,元素则 达到各自的族氧化态。除 Fe 尚不十分明确外(有人声称已经制备出 FeO4),第 3 至第 8 族的其他 17 个元素(不涉及本章不讨论的第四过渡系元素,下同)都已制得族氧化态化合物。相反,第 9 至第 12 族的 12 个元素均未达到族氧化态。d 区元素氧化态一条明显的变化趋势是:自左至右形成族氧化态 的能力下降。第一过渡系元素的族氧化态和实际达到的最高氧化态如下: ● 荷移跃迁:电荷从一个原子向另一个原子的转移 —金属荷移跃迁(LMCT) 金属—配位体荷移跃迁(MLCT) Cl- 上未配位的一对孤 对电子向以金属为主的轨道上 水溶液中[CrCl(NH3)5] 2+ 的 [CrCl(NH3)5] 2+ SnI4 的电荷迁移 I -1 hν Sn 4+ ● 晶格缺陷 晶格缺陷可能由两种原因造成:一种是晶格中某些负离子没有,空位由自由电子占据, 以此达到电荷平衡. 第二种是晶体中金属离子过剩,占据晶格间隙位置,电荷由占据另一些 间隙位置的电子来平衡. 两种缺陷中都包含自由电子,这些自由电子被激发所需的能量一般 较小,若吸收峰落在可见光区,就现出颜色.例如, NaCl 晶体用Na蒸气处理后变成黄色晶体, ZnO 受热变黄 是属于第二种晶格缺陷
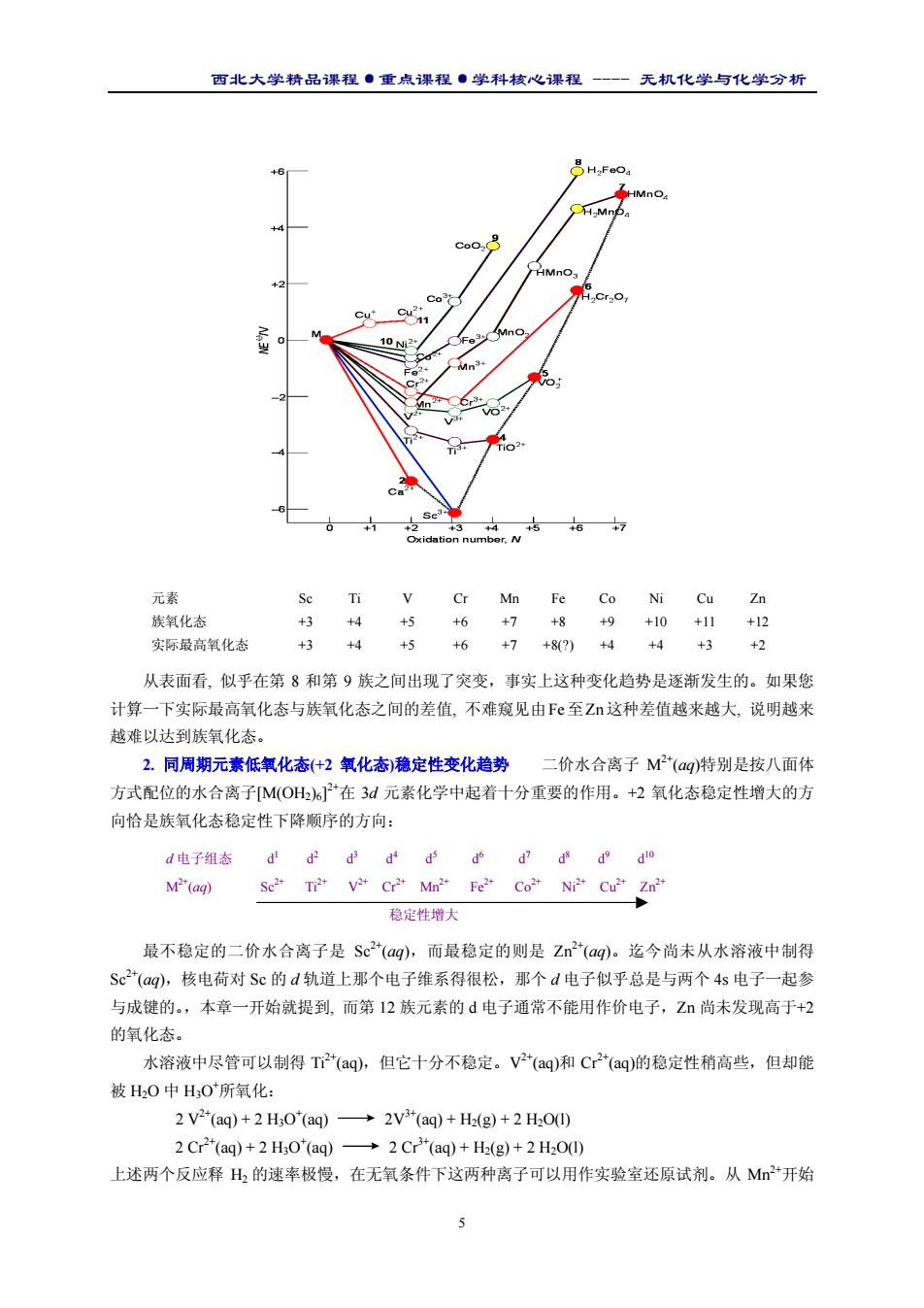
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn 族氧化态 +3 +4 +5 +6 +7 +8 +9 +10 +11 +12 实际最高氧化态 +3 +4 +5 +6 +7 +8(?) +4 +4 +3 +2 从表面看, 似乎在第 8 和第 9 族之间出现了突变,事实上这种变化趋势是逐渐发生的。如果您 计算一下实际最高氧化态与族氧化态之间的差值, 不难窥见由Fe至Zn这种差值越来越大, 说明越来 越难以达到族氧化态。 2. 同周期元素低氧化态(+2 氧化态)稳定性变化趋势 二价水合离子 M2+(aq)特别是按八面体 方式配位的水合离子[M(OH2)6] 2+在 3d 元素化学中起着十分重要的作用。+2 氧化态稳定性增大的方 向恰是族氧化态稳定性下降顺序的方向: d 电子组态 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 M2+(aq) Sc2+ Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+ 稳定性增大 最不稳定的二价水合离子是 Sc2+(aq),而最稳定的则是 Zn2+(aq)。迄今尚未从水溶液中制得 Sc2+(aq),核电荷对 Sc 的 d 轨道上那个电子维系得很松,那个 d 电子似乎总是与两个 4s 电子一起参 与成键的。,本章一开始就提到, 而第 12 族元素的 d 电子通常不能用作价电子,Zn 尚未发现高于+2 的氧化态。 水溶液中尽管可以制得 Ti2+(aq),但它十分不稳定。V2+(aq)和 Cr2+(aq)的稳定性稍高些,但却能 被 H2O 中 H3O+ 所氧化: 2 V2+(aq) + 2 H3O+ (aq) 2V3+(aq) + H2(g) + 2 H2O(l) 2 Cr2+(aq) + 2 H3O+ (aq) 2 Cr3+(aq) + H2(g) + 2 H2O(l) 上述两个反应释 H2 的速率极慢,在无氧条件下这两种离子可以用作实验室还原试剂。从 Mn2+开始
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 5 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn 族氧化态 +3 +4 +5 +6 +7 +8 +9 +10 +11 +12 实际最高氧化态 +3 +4 +5 +6 +7 +8(?) +4 +4 +3 +2 从表面看, 似乎在第 8 和第 9 族之间出现了突变,事实上这种变化趋势是逐渐发生的。如果您 计算一下实际最高氧化态与族氧化态之间的差值, 不难窥见由Fe至Zn这种差值越来越大, 说明越来 越难以达到族氧化态。 2. 同周期元素低氧化态(+2 氧化态)稳定性变化趋势 二价水合离子 M2+(aq)特别是按八面体 方式配位的水合离子[M(OH2)6] 2+在 3d 元素化学中起着十分重要的作用。+2 氧化态稳定性增大的方 向恰是族氧化态稳定性下降顺序的方向: d 电子组态 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 M2+(aq) Sc2+ Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cu2+ Zn2+ 稳定性增大 最不稳定的二价水合离子是 Sc2+(aq),而最稳定的则是 Zn2+(aq)。迄今尚未从水溶液中制得 Sc2+(aq),核电荷对 Sc 的 d 轨道上那个电子维系得很松,那个 d 电子似乎总是与两个 4s 电子一起参 与成键的。,本章一开始就提到, 而第 12 族元素的 d 电子通常不能用作价电子,Zn 尚未发现高于+2 的氧化态。 水溶液中尽管可以制得 Ti2+(aq),但它十分不稳定。V2+(aq)和 Cr2+(aq)的稳定性稍高些,但却能 被 H2O 中 H3O+ 所氧化: 2 V2+(aq) + 2 H3O+ (aq) 2V3+(aq) + H2(g) + 2 H2O(l) 2 Cr2+(aq) + 2 H3O+ (aq) 2 Cr3+(aq) + H2(g) + 2 H2O(l) 上述两个反应释 H2 的速率极慢,在无氧条件下这两种离子可以用作实验室还原试剂。从 Mn2+开始

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 的二价水合离子对水都稳定,Ni 和 Cu(当然还有 Zn)的稳定水合离子只能是二价的。 d 区金属自左至右族氧化态稳定性下降和低氧化态稳定性上升的趋势可以理解为核电荷逐渐增 高,对价层电子控制力逐渐加大的结果。 3. 同族元素族氧化态稳定性变化趋势 d 区元素氧化态另一条明显的变化趋势是:同族元素 自上而下形成族氧化态的趋势增强。更准确地应该说是形成高氧化态的趋势增强,因为有些族达不 到族氧化态。以第 6 族元素为例, 铬酸盐(如 K2CrO4, K2Cr2O7)是常用的氧化剂,钼酸盐和钨酸盐则 不是。这表明 Mo(+6)和 W(+6)物种比 Cr(+6)物种更稳定。 需要指出的是,这条规律对第 3 族和第 12 族表现不明显。这里体现了 d 区两个边界族的特殊性。 15.1.4 形成配位化合物 化学家制备成功的第一个金属配合物就是过渡元素形成的配合物 CoCl3·6NH3,该化合物的发现 促进了化学家对类似体系进行研究的极大兴趣,并最终导致维尔纳配位学说的建立。我们将“形成 配合物”作为过渡元素的特征之一,主要是相对于 s 区元素而言的。d 区元素与 s 区元素的重要差别 之一是,前者的 d 轨道能参与成键。 15.1.5 过渡金属与工业催化 中学实验用 d 区金属的氧化物 MnO2作为 KClO3 制氧的催化剂。事实上,几种产量最大、又涉 及催化过程的无机化学产品的生产没有例外地使用 d 区金属催化剂。例如: 工业过程 被催化的反应 催化剂 制造硫酸 2SO2(g)+O2(g) 2SO3(g) V2O5 合成氨 N2(g)+3H2(g) 2NH3(g) Fe3O4 制造硝酸 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) Pt-Rh 或 Pt-Rh-Pd 合金
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 6 的二价水合离子对水都稳定,Ni 和 Cu(当然还有 Zn)的稳定水合离子只能是二价的。 d 区金属自左至右族氧化态稳定性下降和低氧化态稳定性上升的趋势可以理解为核电荷逐渐增 高,对价层电子控制力逐渐加大的结果。 3. 同族元素族氧化态稳定性变化趋势 d 区元素氧化态另一条明显的变化趋势是:同族元素 自上而下形成族氧化态的趋势增强。更准确地应该说是形成高氧化态的趋势增强,因为有些族达不 到族氧化态。以第 6 族元素为例, 铬酸盐(如 K2CrO4, K2Cr2O7)是常用的氧化剂,钼酸盐和钨酸盐则 不是。这表明 Mo(+6)和 W(+6)物种比 Cr(+6)物种更稳定。 需要指出的是,这条规律对第 3 族和第 12 族表现不明显。这里体现了 d 区两个边界族的特殊性。 15.1.4 形成配位化合物 化学家制备成功的第一个金属配合物就是过渡元素形成的配合物 CoCl3·6NH3,该化合物的发现 促进了化学家对类似体系进行研究的极大兴趣,并最终导致维尔纳配位学说的建立。我们将“形成 配合物”作为过渡元素的特征之一,主要是相对于 s 区元素而言的。d 区元素与 s 区元素的重要差别 之一是,前者的 d 轨道能参与成键。 15.1.5 过渡金属与工业催化 中学实验用 d 区金属的氧化物 MnO2作为 KClO3 制氧的催化剂。事实上,几种产量最大、又涉 及催化过程的无机化学产品的生产没有例外地使用 d 区金属催化剂。例如: 工业过程 被催化的反应 催化剂 制造硫酸 2SO2(g)+O2(g) 2SO3(g) V2O5 合成氨 N2(g)+3H2(g) 2NH3(g) Fe3O4 制造硝酸 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) Pt-Rh 或 Pt-Rh-Pd 合金

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 氯碱工业 2NaCl(aq)+2H2O(l) Cl2(g)+2NaOH(aq)+H2(g) RuO2阳极(电解) 由合成气制汽油 CO(g)+H2(g) 多种烷烃的混合物 Fe 据认为, d 区元素的高催化恬性是因为它们容易失去 d 亚层的电子, d 亚层也容易得到电子。V2O5 催化 SO2 氧化的催化循环(catalytic cycle)可用来说明这类 d 电子参与的过程。 15.2 钛 15.2.1 存在、提取和用途单质 ★ 含量并不十分短缺的元素 钛虽被列为稀有元素,但在地壳中的丰度仅次于氧、硅、铝、铁、 钙、钠、钾、镁、氢而居第 10 位,比某些“普通元素”(例如锌、铅、锡、铜)高得多。与 3d 左部其 他几种元素一样,钛也是亲氧元素,自然界主要以氧化物或含氧酸盐的形式存在。最重要的矿物是 金红石(TiO2)和钛铁矿(FeTiO3)。 ★ 有多种优异性质 ● d = 4.54g· cm-3 ,比钢轻 43% ● 强度大:合金抗拉强度达180 kg· mm-2 ,适应温度宽 ● 耐腐蚀(不怕酸、碱、海水、体液) ★ 用途广泛:飞机、潜艇材料, 可增加深度 80% 达 4500 m 以下; Ni-Ti记忆合金;人造关 节等。 ★ 钛的化合物是第一过渡系中最难被还原为金属的化合物。例如铬、锰、铁的氧化物均可被碳 还原,但在电化学法建立之前, 还原钛化合物只能采用价格昂贵的强还原剂(如金属钠和金属镁)。以 金红石为原料制备金属钛时,首先通过氯化法制得四氯化钛(参见反应 14.57),然后在氩气氛中用熔 融的金属镁还原制得海绵钛: Δ TiCl4(l) + 2 Mg(s) Ti(s) + 2 MgCl2(s) 海绵钛再经真空电弧熔炼得钛锭。 • TICl4 海绵钛 Mg(l) MgCl2(l) 制备海绵钛反应器示意图 Ar
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 7 氯碱工业 2NaCl(aq)+2H2O(l) Cl2(g)+2NaOH(aq)+H2(g) RuO2阳极(电解) 由合成气制汽油 CO(g)+H2(g) 多种烷烃的混合物 Fe 据认为, d 区元素的高催化恬性是因为它们容易失去 d 亚层的电子, d 亚层也容易得到电子。V2O5 催化 SO2 氧化的催化循环(catalytic cycle)可用来说明这类 d 电子参与的过程。 15.2 钛 15.2.1 存在、提取和用途单质 ★ 含量并不十分短缺的元素 钛虽被列为稀有元素,但在地壳中的丰度仅次于氧、硅、铝、铁、 钙、钠、钾、镁、氢而居第 10 位,比某些“普通元素”(例如锌、铅、锡、铜)高得多。与 3d 左部其 他几种元素一样,钛也是亲氧元素,自然界主要以氧化物或含氧酸盐的形式存在。最重要的矿物是 金红石(TiO2)和钛铁矿(FeTiO3)。 ★ 有多种优异性质 ● d = 4.54g· cm-3 ,比钢轻 43% ● 强度大:合金抗拉强度达180 kg· mm-2 ,适应温度宽 ● 耐腐蚀(不怕酸、碱、海水、体液) ★ 用途广泛:飞机、潜艇材料, 可增加深度 80% 达 4500 m 以下; Ni-Ti记忆合金;人造关 节等。 ★ 钛的化合物是第一过渡系中最难被还原为金属的化合物。例如铬、锰、铁的氧化物均可被碳 还原,但在电化学法建立之前, 还原钛化合物只能采用价格昂贵的强还原剂(如金属钠和金属镁)。以 金红石为原料制备金属钛时,首先通过氯化法制得四氯化钛(参见反应 14.57),然后在氩气氛中用熔 融的金属镁还原制得海绵钛: Δ TiCl4(l) + 2 Mg(s) Ti(s) + 2 MgCl2(s) 海绵钛再经真空电弧熔炼得钛锭。 • TICl4 海绵钛 Mg(l) MgCl2(l) 制备海绵钛反应器示意图 Ar

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 单质钛为银白色,纯金属具有优良的机械加工性能。 金属钛可被浓热盐酸溶解生成 TiCl3(aq)和 H2(g),但最好的溶剂(反应试剂)则是氢氟酸或含有 F- 离子的无机酸: Ti(s) + 6 HF(aq) + 2H2O(l) [TiF6] 2-(aq) + 2 H3O+ (aq) + 2 H2(g) 在该反应中, F- 离子的配位作用促进了钛的溶解。 15.2.2 重要化合物 钛形成+4,+3 和+2 氧化态化合物,其中以族氧化态化合物最稳定和最常见。 1. 二氧化钛 TiO2 是最重要的钛化合物,自然界以矿物(金红石)形式存在,工业上可用钛铁 矿(FeTiO3)为原料制备。 硫酸分解钛铁矿的反应如下: ~80℃ FeTiO3(s) + 2 H2SO4(aq) FeSO4(aq) + TiOSO4(aq) + 2 H2O(l) 反应式中含有钛酰离子(TiO2+)的化合物叫硫酸钛酰。将反应后的溶液冷至 5℃使 FeSO4 以水合晶体 形式从体系中分离,含有硫酸钛酰的滤液经浓缩、水蒸气加热水解制得白色的偏钛酸: TiOSO4(aq) + 2 H2O(l) H2TiO3(s) + H2SO4(aq) 偏钛酸是 TiO2 的水合物(TiO2·H2O), 经过滤、洗涤并在高温下脱水得产物: 800~850℃ H2TiO3(s) TiO2(s) + H2O(g) 新制得的热的 TiO2粉末呈浅黄色,冷却后呈白色,俗称钛白。TiO2 不溶于水,在强酸和强碱中 均可缓慢溶解,分别生成钛酰盐(例如 TiOCl2)和偏钛酸盐(例如 Na2TiO3)。 TiO2 虽然显两性,但仍属化学性质稳定的物质。用作高级白色颜料时除安全性(无毒)外, 还兼有 铅白颜料的遮盖性和锌白颜料的持久性。此外,钛白还在造纸工业中用作增白剂,在合成纤维工业 中用作消光剂。 2. 四氯化钛 TiCl4 是钛的最重要的卤化物,以它为原料可制备一系列钛化合物和金属钛。常 温下 TiCl4 为无色液体(b.p. 136℃)并具有刺激性臭味。TiCl4 极易水解,暴露在潮湿空气中发白烟。 部分水解生成钛酰氯,完全水解生成偏钛酸: TiCl4(l) + H2O(l) TiOCl2(s) + 2 HCl(aq) (15.8) TiCl4(l) + 3 H2O(l) H2TiO3(s) + 4 HCl(aq) (15.9) 金红石TiO2 的结构
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 8 单质钛为银白色,纯金属具有优良的机械加工性能。 金属钛可被浓热盐酸溶解生成 TiCl3(aq)和 H2(g),但最好的溶剂(反应试剂)则是氢氟酸或含有 F- 离子的无机酸: Ti(s) + 6 HF(aq) + 2H2O(l) [TiF6] 2-(aq) + 2 H3O+ (aq) + 2 H2(g) 在该反应中, F- 离子的配位作用促进了钛的溶解。 15.2.2 重要化合物 钛形成+4,+3 和+2 氧化态化合物,其中以族氧化态化合物最稳定和最常见。 1. 二氧化钛 TiO2 是最重要的钛化合物,自然界以矿物(金红石)形式存在,工业上可用钛铁 矿(FeTiO3)为原料制备。 硫酸分解钛铁矿的反应如下: ~80℃ FeTiO3(s) + 2 H2SO4(aq) FeSO4(aq) + TiOSO4(aq) + 2 H2O(l) 反应式中含有钛酰离子(TiO2+)的化合物叫硫酸钛酰。将反应后的溶液冷至 5℃使 FeSO4 以水合晶体 形式从体系中分离,含有硫酸钛酰的滤液经浓缩、水蒸气加热水解制得白色的偏钛酸: TiOSO4(aq) + 2 H2O(l) H2TiO3(s) + H2SO4(aq) 偏钛酸是 TiO2 的水合物(TiO2·H2O), 经过滤、洗涤并在高温下脱水得产物: 800~850℃ H2TiO3(s) TiO2(s) + H2O(g) 新制得的热的 TiO2粉末呈浅黄色,冷却后呈白色,俗称钛白。TiO2 不溶于水,在强酸和强碱中 均可缓慢溶解,分别生成钛酰盐(例如 TiOCl2)和偏钛酸盐(例如 Na2TiO3)。 TiO2 虽然显两性,但仍属化学性质稳定的物质。用作高级白色颜料时除安全性(无毒)外, 还兼有 铅白颜料的遮盖性和锌白颜料的持久性。此外,钛白还在造纸工业中用作增白剂,在合成纤维工业 中用作消光剂。 2. 四氯化钛 TiCl4 是钛的最重要的卤化物,以它为原料可制备一系列钛化合物和金属钛。常 温下 TiCl4 为无色液体(b.p. 136℃)并具有刺激性臭味。TiCl4 极易水解,暴露在潮湿空气中发白烟。 部分水解生成钛酰氯,完全水解生成偏钛酸: TiCl4(l) + H2O(l) TiOCl2(s) + 2 HCl(aq) (15.8) TiCl4(l) + 3 H2O(l) H2TiO3(s) + 4 HCl(aq) (15.9) 金红石TiO2 的结构

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 3. 钛酸钡 具有钙钛矿型晶体结构的 BaTiO3 是最重要的电陶瓷材料。BaTiO3 陶瓷主要用 作电容器的介电体,全世界陶瓷电容器年产值在 20 亿美元以上。BaCO3 与 TiO2 通过高温固相反应 制备 BaTiO3: Δ BaCO3(s) + TiO2(s) BaTiO3(s) + CO2(g) 15.3 铬 15.3.1 存在、提取和用途 铬主要以铬铁矿的形式存在于自然界, 通常用 FeCr2O4表示其组成。实际矿物中的 Fe(II)部分被 Mg(II)取代, 而 Cr(III)则部分被 Al(III)和 Fe(III)取代,近似化学组成为(Fe,Mg)[Cr,Al,Fe(III)]2O4。铬 铁矿中铬的氧化态为+3, 这一事实暗示, 它的最稳定氧化态已不是其族氧化态(+6)。 80%以上的铬用于制造特种合金钢。进入特种钢炼制过程前,先要用碳还原铬铁矿制铬铁: Δ FeCr2O4(s) + 4C(s) (Fe+2Cr)(s) + 4 CO(g) 铬为银白色有光泽的金属,熔点(2 130±20 K)、沸点(2 945 K)和硬度都很高。铬的硬度是所有 金属单质中最高的。铬是化学性质活泼的金属,在无氧条件下, 表面未形成氧化膜的金属铬能与稀 HCI 或稀 H2SO4 反应生成蓝色 Cr2+离子的盐, 并置换出氢: Cr(s) + 2 HCl(aq) CrCl2(aq) + H2(g) 但是, 铬表面形成一层保护性氧化膜, 这层氧化膜不但使其对空气和湿气十分稳定,而且表现出 极好的抗腐蚀性能,常温下甚至不溶于 HNO3 和王水。特殊的物理和化学性质使铬成为一种重要的 合金元素,不锈钢中的铬含量在 12%~14%之间。 TiO2 Ti Cl4 H2 △ TiO2•xH2O 白色 TiCl3 紫色 Mg NaTiO3 TiOSO4 HCl H2O H2TiCl6深 黄色 △ C,Cl2 Ti △ 浓H2SO4 浓NaOH
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 9 3. 钛酸钡 具有钙钛矿型晶体结构的 BaTiO3 是最重要的电陶瓷材料。BaTiO3 陶瓷主要用 作电容器的介电体,全世界陶瓷电容器年产值在 20 亿美元以上。BaCO3 与 TiO2 通过高温固相反应 制备 BaTiO3: Δ BaCO3(s) + TiO2(s) BaTiO3(s) + CO2(g) 15.3 铬 15.3.1 存在、提取和用途 铬主要以铬铁矿的形式存在于自然界, 通常用 FeCr2O4表示其组成。实际矿物中的 Fe(II)部分被 Mg(II)取代, 而 Cr(III)则部分被 Al(III)和 Fe(III)取代,近似化学组成为(Fe,Mg)[Cr,Al,Fe(III)]2O4。铬 铁矿中铬的氧化态为+3, 这一事实暗示, 它的最稳定氧化态已不是其族氧化态(+6)。 80%以上的铬用于制造特种合金钢。进入特种钢炼制过程前,先要用碳还原铬铁矿制铬铁: Δ FeCr2O4(s) + 4C(s) (Fe+2Cr)(s) + 4 CO(g) 铬为银白色有光泽的金属,熔点(2 130±20 K)、沸点(2 945 K)和硬度都很高。铬的硬度是所有 金属单质中最高的。铬是化学性质活泼的金属,在无氧条件下, 表面未形成氧化膜的金属铬能与稀 HCI 或稀 H2SO4 反应生成蓝色 Cr2+离子的盐, 并置换出氢: Cr(s) + 2 HCl(aq) CrCl2(aq) + H2(g) 但是, 铬表面形成一层保护性氧化膜, 这层氧化膜不但使其对空气和湿气十分稳定,而且表现出 极好的抗腐蚀性能,常温下甚至不溶于 HNO3 和王水。特殊的物理和化学性质使铬成为一种重要的 合金元素,不锈钢中的铬含量在 12%~14%之间。 TiO2 Ti Cl4 H2 △ TiO2•xH2O 白色 TiCl3 紫色 Mg NaTiO3 TiOSO4 HCl H2O H2TiCl6深 黄色 △ C,Cl2 Ti △ 浓H2SO4 浓NaOH

西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 15.3.2 铬的重要化合物 铬形成多种氧化态,族氧化态(+6)物种为强氧化剂,低氧化态(+2)物种为强还原剂,最稳定的 氧化态为+3。 1. 铬酸盐和重铬酸盐 重铬酸钠 Na2Cr2O7(俗称红矾钠)为橙红色晶体,它往往是制备铬的其 他化学产品的起始物。由铬铁矿制备 Na2Cr2O7 涉及两个主要反应: 1 000~1 100℃ 4 FeCr2O4(s) + 8 Na2CO3(s) + 7 O2(g) 8 Na2CrO4(s) + 2 Fe2O3(s) + 8 CO2(g) 该反应中使用的 Na2CO3 可部分被 NaOH 代替。水浸焙烧产物时 Na2CrO4 进入溶液,从而与主要杂 质得到分离。所得的 Na2CrO4 溶液用 H2SO4 适度酸化得 Na2Cr2O7: 2 Na2CrO4(aq) + H2SO4(aq) Na2Cr2O7(aq) + Na2SO4(aq) + H2O(l) 该反应不过是利用了 Cr(VI)两种氧阴离子之间的平衡: 2 CrO4 2-(aq) + 2 H3O+ (aq) Cr2O7 2-(aq) + 3 H2O(l) (黄色) (橙红色) 平衡随介质酸度增高向生成 Cr2O7 2-离子方向移动,酸度降低则移向相反方向,这种移动可通过溶液 颜色的变化观察。不论是酸性还是碱性介质,溶液中加入 Ba2+,Pb2+,Ag+ 等金属离子得到的总是铬 酸盐沉淀而不是重铬酸盐沉淀,这是因为这类阳离子的铬酸盐有较小的溶度积。相关的沉淀反应除 用于制备(如制备 PbCrO4 颜料)外,还用来定性检测这些阳离子或 Cr(VI)氧阴离子: Ba2+(aq) + CrO4 2-(aq) BaCrO4(s, 黄色) Pb2+(aq) + CrO4 2-(aq) PbCrO4(s, 黄色) 2 Ag+ (aq) + CrO4 2-(aq) Ag2CrO4(s, 砖红色) 重铬酸钾(俗称红矾钾)和重铬酸铵也是橙红色晶体,由 Na2Cr2O7 与 KCl 或 NH4Cl 之间的复分解 反应制备。Na2Cr2O7 通常含 2 个结晶水,而 K2Cr2O7 不含结晶水, 且容易通过重结晶法提纯,提纯后 的 K2Cr2O7用作基准氧化试剂。用作氧化剂的 K2Cr2O7 在酸性溶液中的还原产物为 Cr3+离子,下面 列出一些代表性反应。 Cr2O7 2-(aq) + 6Fe2+(aq) + 14H3O+ (aq) 6Fe3+(aq) + 2Cr3+(aq) + 21H2O(l) Cr2O7 2-(aq) + 6I- (aq) +14H3O+ (aq) 2Cr3+(aq) + 3I2(s) + 21H2O(l) Cr2O7 2-(aq) + 3SO3 2-(aq) + 8H3O+ (aq) 2Cr3+(aq) + 3SO4 2-(aq) + 12H2O(l) Cr2O7 2-(aq) + 3H2S(g) + 8H3O+ (aq) 2Cr3+(aq) + 3S(s) + 15H2O(l) 加热时 K2Cr2O7 与浓 HCl 反应使 C1- 氧化逸出 Cl2: K2Cr2O7(s) + 14HCl(浓) 2KCl(aq) + 2CrCl3(aq) + 3Cl2(g) + 7H2O(l) 与重铬酸盐的强氧化性相比,铬酸盐的氧化性则要弱得多。 黄 橙
西北大学精品课程·重点课程·学科核心课程 - 无机化学与化学分析 10 15.3.2 铬的重要化合物 铬形成多种氧化态,族氧化态(+6)物种为强氧化剂,低氧化态(+2)物种为强还原剂,最稳定的 氧化态为+3。 1. 铬酸盐和重铬酸盐 重铬酸钠 Na2Cr2O7(俗称红矾钠)为橙红色晶体,它往往是制备铬的其 他化学产品的起始物。由铬铁矿制备 Na2Cr2O7 涉及两个主要反应: 1 000~1 100℃ 4 FeCr2O4(s) + 8 Na2CO3(s) + 7 O2(g) 8 Na2CrO4(s) + 2 Fe2O3(s) + 8 CO2(g) 该反应中使用的 Na2CO3 可部分被 NaOH 代替。水浸焙烧产物时 Na2CrO4 进入溶液,从而与主要杂 质得到分离。所得的 Na2CrO4 溶液用 H2SO4 适度酸化得 Na2Cr2O7: 2 Na2CrO4(aq) + H2SO4(aq) Na2Cr2O7(aq) + Na2SO4(aq) + H2O(l) 该反应不过是利用了 Cr(VI)两种氧阴离子之间的平衡: 2 CrO4 2-(aq) + 2 H3O+ (aq) Cr2O7 2-(aq) + 3 H2O(l) (黄色) (橙红色) 平衡随介质酸度增高向生成 Cr2O7 2-离子方向移动,酸度降低则移向相反方向,这种移动可通过溶液 颜色的变化观察。不论是酸性还是碱性介质,溶液中加入 Ba2+,Pb2+,Ag+ 等金属离子得到的总是铬 酸盐沉淀而不是重铬酸盐沉淀,这是因为这类阳离子的铬酸盐有较小的溶度积。相关的沉淀反应除 用于制备(如制备 PbCrO4 颜料)外,还用来定性检测这些阳离子或 Cr(VI)氧阴离子: Ba2+(aq) + CrO4 2-(aq) BaCrO4(s, 黄色) Pb2+(aq) + CrO4 2-(aq) PbCrO4(s, 黄色) 2 Ag+ (aq) + CrO4 2-(aq) Ag2CrO4(s, 砖红色) 重铬酸钾(俗称红矾钾)和重铬酸铵也是橙红色晶体,由 Na2Cr2O7 与 KCl 或 NH4Cl 之间的复分解 反应制备。Na2Cr2O7 通常含 2 个结晶水,而 K2Cr2O7 不含结晶水, 且容易通过重结晶法提纯,提纯后 的 K2Cr2O7用作基准氧化试剂。用作氧化剂的 K2Cr2O7 在酸性溶液中的还原产物为 Cr3+离子,下面 列出一些代表性反应。 Cr2O7 2-(aq) + 6Fe2+(aq) + 14H3O+ (aq) 6Fe3+(aq) + 2Cr3+(aq) + 21H2O(l) Cr2O7 2-(aq) + 6I- (aq) +14H3O+ (aq) 2Cr3+(aq) + 3I2(s) + 21H2O(l) Cr2O7 2-(aq) + 3SO3 2-(aq) + 8H3O+ (aq) 2Cr3+(aq) + 3SO4 2-(aq) + 12H2O(l) Cr2O7 2-(aq) + 3H2S(g) + 8H3O+ (aq) 2Cr3+(aq) + 3S(s) + 15H2O(l) 加热时 K2Cr2O7 与浓 HCl 反应使 C1- 氧化逸出 Cl2: K2Cr2O7(s) + 14HCl(浓) 2KCl(aq) + 2CrCl3(aq) + 3Cl2(g) + 7H2O(l) 与重铬酸盐的强氧化性相比,铬酸盐的氧化性则要弱得多。 黄 橙